Изучение процессов репаративной регенерации до сих пор остается актуальным в биологии и медицине [2, 5]. Особенно это важно для биологических тканей, в которых регенерация очень низка или практически отсутствует, в частности, в офтальмологии ‒ в ходе манипуляции для укрепления наружной стенки глаза при ее дистрофических процессах [3, 9, 10].
В предварительных исследованиях эффективности применения различных аллоплантов и имплантатов выявлено их значительное модулирующее влияние на поврежденные ткани [7]. Использование измельченных в порошок биологических материалов в виде крупнодисперсной взвеси уменьшает травматичность методики за счет минимизации разрезов слизистой оболочки, однако репаративная регенерация возникает также только на поверхности склеры в зоне ее введения [5, 6].
Известно, что измельчение до наноразмерной структуры вещества без изменения его химического состава изменяет в сторону увеличения его физические свойства: проникающую способность, гидрофильность и т.д. [4]. Однако изучение влияния имплантации биологических материалов, измельченных до наноразмерного уровня, на динамику репаративных процессов в соединительнотканных структурах передней стенки глаза в настоящее время не проводилось.
Цель исследования – изучить закономерности репаративной регенерации соединительнотканных структур передней стенки глаза в ответ на имплантацию нанодисперсной плаценты.
Материалы и методы исследования
Экспериментальные исследования выполнены на самцах белых крыс трехмесячного возраста с массой тела 220–300 г. В первой группе животным (опыт) под слизистую на склеру глаза под местной анестезией имплантировали биологический контейнер (БК) размерами 3,0 ± 0,5×1,0 ± 0,2 мм. Биоконтейнер представлял собой отрезок сосуда амниотической оболочки человека и был наполнен 0,05 ± 0,01 г порошком нанодисперсной плаценты, полученной методом механоактивации [1]. Порошок состоял [8] из отдельных частиц размером от 200 до 500 нм, сформированных зернами размером от 40 до 100 нм. Частицы в свою очередь образовывали слабосвязанные агломераты размером от 2 до 10 мкм. Во второй опытной группе животным под слизистую на склеру глаза под местной анестезией имплантировали биологический контейнер, заполненный порошком из крупноизмельченной плаценты с размерами частиц более 45 мкм, в аналогичной дозе. Третья группа животных (контроль) состояла из ложнооперированных крыс, которым под анестезией проводили разрез, аналогичный таковому в ходе имплантации.
Экспериментальные исследования проведены с соблюдением «Правил проведения работ с использованием экспериментальных животных». Забой производили под тиопенталовым наркозом путем декапитации. Изучены группы животных к концу 3, 7, 30 и 60 суток после манипуляций (по 5 животных в каждой группе). Фиксацию осуществляли в 10 % растворе нейтрального формалина, заливали в парафин. Исследование структуры порошка измельченной плаценты человека и поверхности гистологических срезов зоны оперативного вмешательства проводились на сканирующей зондовой лаборатории Ntegra (NT-MDT) в прерывисто-контактной методике на воздухе после предварительной химической очистки от парафина. Аналогичным образом изучена структурная организация коллагеновых волокон в участках предварительно проведенных манипуляций. Для общего морфологического анализа препараты окрашивали гематоксилин-эозином. Изучение пролиферативной активности соединительнотканного окружения трансплантируемого материала выявляли иммуногистохимически с определением экспрессии Ki-67 ПАП методом.
Результаты исследования и их обсуждение
В ходе проведенных экспериментальных исследований выявлено, что постимплантационный период у животных протекал без видимых осложнений: отсутствовали признаки отторжения и вторичной инфекции.
В ранние сроки (3–7-е сутки) после имплантации БК во всех рассмотренных случаях имплантат сохранялся в обеих опытных группах. Отмечалась умеренная воспалительная инфильтрация как оболочки БК, представленной стенкой сосуда, так и окружающей конъюнктивы и субконъюнктивальной основы. Это проявлялось в лимфоцитарно-моноцитарных клеточных ответах, умеренной инфильтрации мононуклеарами тканей прилежащей склеры и конъюнктивы, появлении отдельных лейкоцитов в стенке и в содержимом БК. В контроле же проявления клеточных реакций были значительно менее выражены. Прилегающий участок склеры реципиента в первой опытной группе характеризовался разрыхлением стромы, между коллагеновыми волокнами которой видны нейтрофилы и лимфоциты, а также мелкие полихромно окрашенные пылевидные частицы, аналогичные наблюдаемым при исследовании гистологического среза БК. При этом отмечено сохранение наноразмерной структуры измельченной плаценты 40–100 нм. Разволокнение поверхностных слоев склеры во второй опытной группе было незначительное, их инфильтрация под БК не отмечалась. В контроле склера была интактна.
Иммуногистохимическое исследование с определением экспрессии Ki-67 ПАП методом показало выраженную пролиферативную активность клеток соединительно-тканной основы слизистой оболочки глаза вокруг БК (рис. 1, 2) в первой контрольной группе, умеренновыраженную пролиферативную активность в зоне имплантации БК с крупноизмельченной плацентой (рис. 3) и низкую пролиферативную активность в зоне разреза слизистой и подслизистой оболочек в опытной группе (рис. 4).
Через 30 суток после проведенной манипуляции как у контрольных, так и опытных животных зона внешней поверхности раневого повреждения подвергалась полной реэпителизации. В контроле на месте хирургического вмешательства сформировался рубец в виде ограниченного участка плотной волокнистой соединительной ткани с сетевидно распределенными коллагеновыми волокнами. Лейкоцитарно-клеточные реакции в зоне и непосредственно вокруг повреждения у контрольных животных отсутствовали. У животных опытных групп в зоне имплантации наблюдались остатки стенки БК в виде небольших скоплений участков эластических и коллагеновых волокон с наличием лимфоцитарно-клеточного ответа в них. У животных обеих опытных групп в непосредственном окружении БК наблюдались значительные клеточные скопления, включающие лимфоциты, пролиферирующие и зрелые клетки фибробластического ряда, эпителиоидные клетки.
При этом фибробласты формировали тонкую соединительную капсулу вокруг БК с множеством гемокапиляров и наличием эпителиоидных клеток, однако в первой опытной группе при имплантации БК с нанодисперной плацентой процессы клеточных реакций, а также формирование новых капилляров было более выражено. Кроме того, отмечалась пролиферативная активность клеток фибробластического ряда в прилежащей к БК склере реципиента, в ее поверхностных и средних слоях, а также формирование в них гемокапилляров, что практически отсутствовало во второй группе животных с имплантацией БК с крупноизмельченной плацентой.
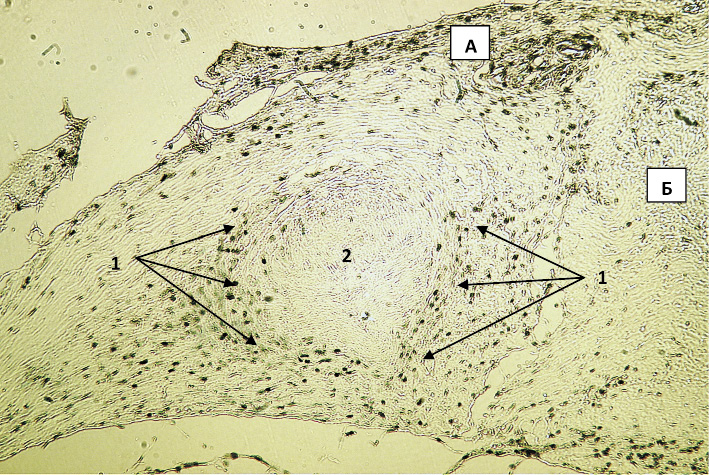
Рис. 1. Обзорное изображение экспрессии Ki-67 в зоне имплантации биоконтейнера в 1-й опытной группе на 7-е сутки после вмешательства. Вторые антитела, меченные пероксидазой. Ув. х50: 1 – участок соединительной ткани с признаками высокой пролиферативной активности, 2 – остатки биоконтейнера; А – слизистая оболочка; Б – подслизистая оболочка
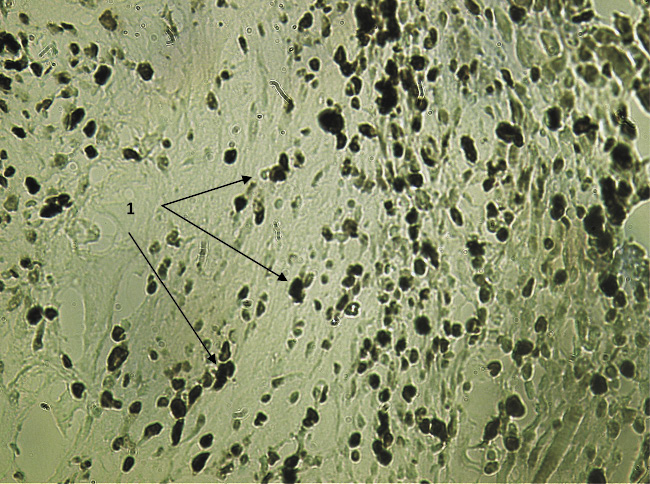
Рис. 2. Экспрессия Ki-67 в зоне, непосредственно прилежащей к имплантируемому биоконтейнеру в 1-й опытной группе на 7-е сутки после вмешательства. Вторые антитела, меченные пероксидазой. Ув. х200: 1 – пролиферативно активные клетки
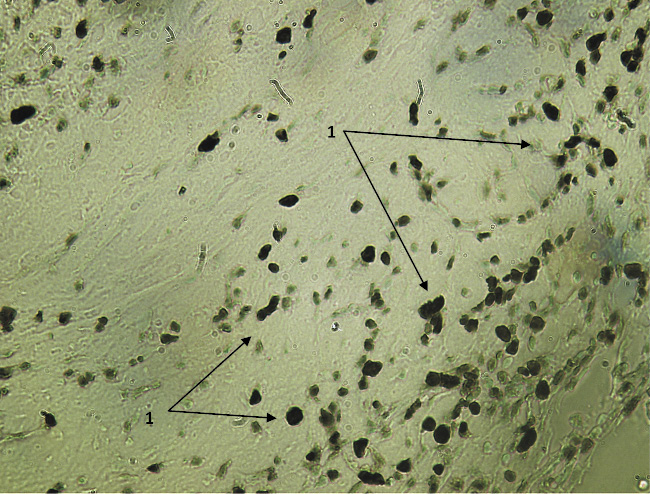
Рис. 3. Экспрессия Ki-67 в зоне, непосредственно прилежащей к имплантируемому биоконтейнеру во 2-й опытной группе на 7-е сутки после вмешательства. Вторые антитела, меченные пероксидазой. Ув. х200: 1 – пролиферативно активные клетки

Рис. 4. Экспрессия Ki-67 в зоне механической травмы в контрольной группе на 7-ые сутки после вмешательства. Вторые антитела, меченные пероксидазой. Ув. х200: 1 – пролиферативно активные клетки
Через 60 суток в области разреза у контрольных животных участок хирургического вмешательства выявлялся в виде ограниченной зоны рубцовой ткани конъюнктивы. В обеих опытных группах БК практически полностью рассасывался. Вокруг донорских структур в первой опытной группе образовалась капсула, внутренние слои которой состояли из эпителиоидных клеток и крупных макрофагов. Наружные слои капсулы состояли из вновь образованной рыхлой соединительной ткани с множеством вновь сформированных сосудов, активных фибробластов. Новообразованная соединительная ткань по плотности приближалась к отдаленной от зоны имплантации. Макромолекулярная организация вновь образованных коллагеновых волокон указывала на достаточную степень их морфологической зрелости. Волокнистая организация межклеточного вещества склеры приобретала упорядоченный характер. При имплантации БК с крупноизмельченной плацентой данные процессы проявлялись в значительно меньшей степени. Толщина склеры во второй опытной группе была на 23 %, а в контроле на 31 % меньше по отношению к первой опытной группе.
Заключение
Таким образом, нанодисперсная плацента, по всей видимости, за счет приобретения ею новых физических свойств вследствие механоактивации, таких как повышенная проницаемость и гидрофильность, значительно усиливает процессы пролиферации в соединительнотканных структурах реципиента в зоне ее введения. Кроме того, повышаются репаративные свойства склеральной ткани при ее изначально низкой пролиферативной активности.
Рецензенты:Васильев Ю.Г., д.м.н., профессор кафедры гистологии, эмбриологии и цитологии, ГБОУ ВПО «Ижевская государственная медицинская академия» Минздрава России, г. Ижевск;
Селякин С.П., д.м.н., профессор кафедры анатомии человека, ГБОУ ВПО «Ижевская государственная медицинская академия» Минздрава России, г. Ижевск.
Работа поступила в редакцию 18.02.2014.



