Комбинированное поражение органа зрения светом и ионизирующей радиацией также возможно в случае аэрокосмических испытаний, при захоронении радиационных отходов, применении ядерного оружия и особенно, как показали аварии на Чернобыльской АЭС и АЭС «Фукусима», при чрезвычайных ситуациях в атомной промышленности, когда радиоактивному загрязнению подверглись обширные территории, [1, 3, 9]. В доступной литературе подавляющее большинство работ отражает повреждающее действие света различной интенсивности на нейросенсорные клетки [2, 5, 10]. Крайне мало сведений о реакции и количественной оценке изменений на световое и комбинированное облучения всех компонентов гематоретинального барьера.
Цель настоящей работы – установить характер модифицирующего влияния ионизирующей радиации на повреждения гематоретинального барьера, вызываемые светом различной интенсивности.
Материалы и методы исследования
Эксперименты проведены на 125 беспородных половозрелых белых крысах обоего пола массой 180–200 г. В первой и второй серии опытов (n = 50) животных в течение 1, 2, 7, 14, 30 сут подвергали равномерному облучению люминесцентными лампами ЛБ-40. Освещенность крыс в каждой группе составила 200 и 3500 лк соответственно. Животных третьей и четвертой групп (n = 50) подвергали комбинированному тотальному воздействию рентгеновского излучения в дозе 5 Гр с помощью аппарата РУМ-17, и света (200, 3500 лк) с интервалом в один час. Количество животных на каждую экспериментальную точку – 5. В качестве контроля (n = 25) использовали интактных крыс, содержавшихся в условиях искусственного светового режима 12 ч день, 12 ч ночь с интенсивностью дневного освещения 25 лк. Взятие материала осуществляли после умерщвления животных декапитацией сразу после окончания экспериментального воздействий. Центральные участки задней стенки глаза фиксировали в 2,5 % глютаральдегиде на какодилатном буфере (PH 7,4), постфиксировали в 1 % растворе четырехокиси осмия и заливали в эпон. Ультратонкие срезы контрастировали уранилацетатом и цитратом свинца, просматривали в электронном микроскопе JEM -100 CX-II. На полутонких срезах, окрашенных толуидиновым синим производили подсчет удельной площади открытых капилляров хориоидеи и толщину пигментного эпителия. Для оценки достоверности различий при сравнении средних величин использовали критерий Манна‒Уитни.
Результаты исследования и их обсуждение
Описывая структурные реакции гематоретинального барьера при различных воздействиях, необходимо отметить, что составляющими последнего являются эндотелиоциты капилляров хориоидеи, базальный комплекс и пигментоэпителиоциты [8]. После 1–2 сут низкоинтенсивного (200 лк) светового воздействия часть хориоидальных капилляров полнокровна. Базальный комплекс сохраняет обычное строение. В части клеток пигментного эпителия обнаруживается увеличение содержания фагосом. В аналогичный срок после комбинированного воздействия ионизирующей радиации и низкоинтенсивного света эндотелий гемокапилляров хориоидеи имеет обычную ультраструктуру. Большинство пигментоэпителиоцитов сохраняет нормальное строение, но в некоторых клетках наблюдается набухание митохондрий, очаговая деструкция апикальных отростков. Незначительная часть клeтoк пигментного эпителия, напротив, резко гипертрофирована и характеризуется активацией фагоцитарной активности.
После 1–2 сут светового (3500 лк) облучения изменения в сосудистой оболочке носят очаговый характер. На одних участках сетчатки хориокапилляры резко сужены или закрыты за счет набухания ядросодержащей части эндотелия. Цитоплазма эндотелиоцитов содержит набухшие митохондрии, различной величины вакуоли, мембранные комплексы. Базальные мембраны таких капилляров характеризуются неравномерной толщиной и местами разрыхлены и утолщены. На других участках в капиллярах хориоидеи сосудов наблюдается полнокровие, стаз и сладж эритроцитов. Встречаются участки сетчатки на которых строение хориокапилляров не отличается от контроля. В клетках пигментного эпителия наблюдается увеличение базальной складчатости, набухание митохондрий, а в апикальных отделах возрастает количество фагосом. В аналогичный срок после комбинированного облучения ионизирующей радиации и высокоинтенсивного света просвет большинства капилляров сосудистой оболочки сужен или закрыт. В некоторых сосудах, прилегающих к базальному комплексу, наблюдается гиперемия. В части клеток пигментного эпителия обнаруживается существенное увеличение количества фагосом и базальной складчатости. В пигментном эпителии появляются гипертрофированные клетки. Крупные ядра (одно, два) располагаются в центре пигментоэпителиоцита. В апикальной части цитоплазмы резко повышается содержание фагосом. В базальных и центральных отделах выявляются многочисленные вакуоли, образующиеся в результате деструкции митохондрий. Однако большинство пигментоэпителиоцитов сохраняет обычное строение.
На 7–30-е сут низкоинтенсивного светового воздействия венозные и артериальные сосуды хориодеи расширены и полнокровны. В пигментоэпителиоцитах наблюдается гиперхромия ядер. Часть клеток гипертрофирована, в их цитоплазме увеличивается количество фагосом и вакуолей, апикальные микроворсинки увеличены в размерах и интенсивно поглощают деструктивные участки наружных сегментов нейросенсорных клеток. Также встречаются уменьшенные в размерах пигментоэпителиоциты. В их цитоплазме выявляются мембранные комплексы и осмиофильные гранулы, миелиноподобные тельца, число микроворсинок уменьшено, а базальная складчатость цитоплазмы снижена. Фотосенсорный слой, прилежащий к подобным клеткам, содержит неутилизированные фрагменты нейросенсорных клеток. В аналогичные сроки после комбинированного воздействия ионизирующей радиации и низкокоинтенсивного света на отдельных участках сетчатки повышается электронная плотность цитоплазмы эндотелия капилляров хориоидеи. Базальный комплекс местами незначительно утолщен за счет явлений отека. Изменения пигментного эпителия прогрессируют. В сетчатке встречаются пигментоэпителиоциты, в которых практически отсутствует базальная складчатость, микроворсинки единичны, а в ядрах наблюдается уменьшение объема и гиперконденсация хроматина.
После 7 сут воздействия высокоинтенсивным светом встречаются участки сетчатки, на которых наблюдается массовая гибель нейросенсорных клеток и отмечается снижение содержания открытых капилляров хориоидеи. Эндотелиоциты функционирующих капилляров набухшие, а содержание органелл в них снижено. Из-за деструкции отечных митохондрий в цитоплазме появляются крупные вакуоли. Цитоплазматический матрикс характеризуется низкой электронной плотностью. Вне очага поражения часть сосудов полнокровна. В части пигментоэпителиоцитов наблюдается снижение количества органелл. В аналогичный срок после комбинированного облучения ионизирующей радиации и высокоинтенсивного света цитоплазма эндотелиоцитов вне очага поражения отечна. Перициты вакуолизированы. В единичных сосудах наблюдается тромбоз. Базальный комплекс утолщен и расслоен. Подавляющее большинство пигментоэпителиоцитов гипертрофировано. Их цитоплазма гомогенна и содержит большое количество вакуолей. Сохранившиеся микроворсинки утолщены и захватывают поврежденные сегменты нейросенсорных клеток. Субретинальное пространство заполнено деструктивно измененными наружными сегментами нейросенсорных клеток.
После 14 сут воздействия светом (3500 лк) в очагах поражения резко уменьшается количество гемокапилляров хориоидеи. В эндотелиоцитах и перицитах наблюдается повышение осмиофилии цитоплазмы, увеличение числа лизосом, появление фагосом и миелинодобных телец. Толщина базальной мембраны неравномерна, местами видно её разволокнение. Большинство клеток пигментного эпителия имеет нормальное строение, но у многих гипертрофированы апикальные отростки. В аналогичный срок после комбинированного облучения ионизирующей радиации и высокоинтенсивного света количество гемокапилляров в сосудистой оболочке снижено. Эндотелий сохранившихся сосудов хориоидеи характеризуется выраженной вакуолизацией цитоплазмы. Цитоплазматический матрикс представляет собой мелкогранулярную структуру с весьма малым количеством органелл, среди которых преобладают деструктивные митохондрии, множественные вакуоли и лизосомы. Базальный комплекс неравномерно утолщен вследствие пролиферации волокнистого компонента. Сосудистая оболочка содержит большое количество малодифференцированных клеток соединительной ткани и макрофаги. Часть пигментоэпителиоцитов имеет нормальное строение. Встречаются клетки, цитоплазма которых в несколько раз увеличена в объеме и буквально «нафарширована» многочисленными фагосомами, которые, как правило, содержат фрагменты поврежденных наружных сегментов на разной стадии лизиса. В базальных отделах появляются отечные митохондрии. Апикальные отростки единичные и укороченные.
После 30 сут воздействия светом (3500 лк) в сохранившихся капиллярах хориоидеи обнаруживаются очаги деструкции. Часть пигментоэпителиоцитов подвержена кариопикнозу. Их цитоплазма представляет собой однородную мелкогранулярную структуру с малым количеством органелл (деструктивные митохондрии, отдельные лизосомы и вакуоли). Базальный комплекс утолщен. В эти сроки практически отсутствуют слои, образованные нейросенсорными клетками. Вследствие этого ядра внутреннего ядерного слоя приближены к пигментному эпителию (рисунок).
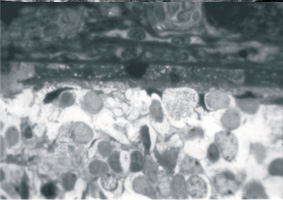
Полная деструкция нейросенсорных клеток, приближение внутреннего ядерного слоя к пигментному эпителию вследствие деструкции наружного ядерного слоя после воздействия высокоинтенсивного (3500 лк) света в течение 30 сут. Полутонкий срез, окраска толуидиновым синим. Ув. ×900
В аналогичный срок после комбинированного облучения ионизирующей радиации и высокоинтенсивного света нарушения гематоретинального барьера становятся более выраженными. Эндотелиоциты сохранившихся капилляров хориоидеи набухшие, содержание органелл в них резко снижено. В околоядерных зонах в цитоплазме встречаются миелиноподобные тельца. Пигментный эпителий в основном представлен увеличенными в объеме клетками, но базальная складчатость их цитолеммы сглажена, а количество митохондрий в таких клетках резко уменьшается. На участках сетчатки, где вследствие предшествующей деструкции отсутствуют пигментоэпителиоциты и нейросенсорные клетки, сосуды единичны. Здесь обнаруживаются единичные эпителиальные клетки, вблизи которых отмечается глиальная пролиферация, а внутренний ядерный слой приближен к базальному комплексу.
Анализ изменений удельной площади открытых хориокапилляров показал, что после низкоинтесивного светового воздействия и в серии с комбинированным облучением (5 Гр, 200 лк) данный показатель достоверно не отличается от контрольных значений. На 2-е сут светового (3500 лк) облучения удельная площадь открытых капилляров сосудистой оболочки составила 14,41 ± 0,12 %, (контроль 23 ± 1,6 %, р < 0,05). В дальнейшие сроки эксперимента наблюдалось снижение удельной площади хориокапилляров, и к 30-м сут она оказалась в 2,1 раза меньше контрольных значений. После 1–2 сут комбинированного облучения ионизирующей радиации в дозе 5 Гр и высокоинтенсивного света удельная площадь открытых хориокапилляров уменьшилась в 1,6 раза по сравнению с контролем. На 7-е сут удельная площадь составила 9 ± 0,26 %, а к 14-м сут была меньше контрольных значений в 3,2 раза. После 30 сут комбинированной ионизирующей радиации в дозе 5 Гр и высокоинтенсивного света облучения удельная плошадь гемокапилляров сосудистой оболочки была в 2,7 раза ниже таковой после светового облучения в аналогичный срок.
Анализ изменений толщины пигментного эпителия показал, что после 30 сут низкоинтенсивного светового облучения высота пигментоэпителиоцитов в 1,6 раза, а после высокоинтенсивного в 3 раза меньше таковой в контроле (рисунок). После 14 сут комбинированного облучения ионизирующей радиацией в дозе 5 Гр и света (200, 3500 лк) толщина пигментного эпителия в 1,4 раза меньше, чем в серии с изолированным световым воздействием. Данный показатель достоверно не меняется до 30-х сут эксперимента.
Заключение
Таким образом, в ранние сроки эксперимента (1–7 сут) изменения гематоретинального барьера при световом облучении различной интенсивности сходны. После окончания воздействия реакции сосудистых компонентов сетчатки проявляются полнокровием и вакуолизацией цитоплазмы эндотелия хориокапилляров. Изменения пигментного эпителия в основном касаются фагоцитарной активности пигментоэпителиоцитов и проявляются гипертрофией и увеличением в клетках базальной складчатости. Необходимо отметить, что в нашем исследовании наблюдалась очаговость поражения компонентов гематоретинального барьера, что, вероятно, связано с функционально неодинаковым исходным состоянием хориокапилляров. Вероятно, до 7-х сут эксперимента сохранность гематоретинального барьера обусловлена его мощными защитными механизмами от воздействия света (200, 3500 лк) [4, 7]. После 7–30 сут к реактивным добавляются деструктивные нарушения. Наблюдаются сужение просвета хориокапилляров, деструкция органелл эндотелия и утолщение базальной мембраны. Изменения пигментного эпителия выражаются в мозаичном повреждении единичных клеток, однако большинство пигментоэпителиоцитов остается сохранным, что доказывает их устойчивость к изучаемым воздействиям. Резкое снижение удельной площади открытых капилляров хориоидеи и высоты эпителиального пласта происходит в основном на участках с массовой гибелью нейросенсорных клеток, тогда как на других участках сетчатки отмечается полнокровие этих сосудов и гипертрофия пигментоэпителиоцитов.
Изменения гематоретинального барьера, индуцируемые комбинированным облучением ионизирующей радиации в дозе 5 Гр и низкоинтенсивным, напоминают таковые после изолированного светового (200 лк) воздействия. Изменения гематоретинального барьера при комбинированном облучении (5 гр, 3500 лк) более выражены и характеризуются уменьшением числа, сужением просвета, деструкцией эндотелия и перицитов хориокапилляров, изменениями со стороны базального комплекса, деструкцией пигментного эпителия. Данные явления способствуют дегенеративным процессам в нейронах сетчатки и срыву компенсаторно-приспособительных реакций.
Рецензенты:
Солонский А.В., д.м.н., руководитель лаборатории нейробиологии, ФГБУ «Научно-исследовательский институт психического здоровья» СО РАМН, г. Томск;
Мустафина Л.Р., д.м.н., старший преподаватель кафедры гистологии, эмбриологии и цитологии, ГБОУ ВПО «Сибирский государственный медицинский университет» Минздрава России, г. Томск.
Работа поступила в редакцию 15.01.2014.



