Среди патологических состояний нервной системы, возникающих при заболеваниях эндокринных желез, особое место занимают неврологические расстройства при сахарном диабете (СД) [1]. Это обусловлено не только распространенностью подобных нарушений, но и их тяжестью, значительным влиянием на прогноз и качество жизни. СД является одним из самых распространенных заболеваний в мире. По мнению экспертов, к 2025 году общее число больных диабетом достигнет 324 млн человек [3, 7, 11]. В настоящее время в РФ около 8 миллионов человек страдают СД, и их число непрерывно растет [11]. Несмотря на то, что доля СД 1 типа от всех форм диабета составляет не более 10–15 % [3], данная форма является важнейшей медико-социальной проблеме здравоохранения, т.к. это заболевание нередко возникает в детском и юношеском возрасте, характеризуется тяжестью течения, ранней инвалидизацией и нередко смертельным исходом [1, 4, 11].
Сосудистые поражения наблюдаются при всех формах сахарного диабета. Однако при СД 1 типа основной причиной высокой инвалидизации являются именно микроангиопатии, которые приводят к диабетической ретинопатии (ДР) [6,8]. Отмечено, что СД занимает одно из первых мест как причина слепоты и слабовидения во всех возрастных группах. Риск развития слепоты у больных СД в 25 раз выше, чем у людей без СД [9, 11, 12]. В этой связи изучение состояния всего пути зрительного анализатора при сахарном диабете 1 типа имеет особое значение.
Цель исследования: изучить нейрофизиологическое состояние проводящих путей зрительного анализатора у больных сахарным диабетом 1 типа в зависимости от черно-белого или цветного стимула.
Материалы и методы исследования
Было проведено комплексное клинико-терапевтическое обследование 81 пациента с сахарным диабетом 1 типа (33 мужчины, 48 женщин) с диагнозом «СД 1 типа», находившихся на лечении в эндокринологическом отделении ГКБ № 3 г. Ставрополя. Средний возраст больных составил 25,3 ± 4,5 лет. Длительность заболевания варьировалась от 1 года до 10 лет и составила в среднем 7,1 ± 1,4 года.
Большинство обследованных пациентов находились в состоянии относительной компенсации СД. Клиническое состояние зрительного анализатора у больных изучалось совместно с офтальмологом. Критерием возможности проведения исследования явилось наличие СД 1 типа с начальной стадией диабетической ретинопатии или без выраженных изменений на глазном дне. Из числа исследуемых пациентов были исключены лица с анизометропией, миопией выше 1,0 диоптрии, астигматизмом, амблиопией, экзофорией, цветоаномалиями, какими-либо другими (кроме диабетической ретинопатии) глазными заболеваниями или травмами, никому ранее не проводилась фотолазеркоагуляция.
Для оценки зрительного анализатора проводилось нейрофизиологическое исследование на приборе «Нейрон-Спектр-4/ВПМ» производства фирмы «НейроСофт» с компьютерной обработкой, разработанном в Академии МТН РФ (г. Иваново). Изучался латентный период (ЛП) и амплитуда ответа вызванных зрительных потенциалов (ВЗП) на реверсный черно-белый (ЧБ), красно-желтый (КЖ) и зелено-черный (ЗЧ) шахматный паттерн (ШП). Достоинством данного исследования является наиболее четкое выделение в графическом отображении основной волны Р100, что соответствует активации 17-го (первичная зрительная кора) и 18-го (зрительная ассоциативная кора) поля по Бродману [2,11]. Метод позволяет проследить проведение нервного импульса по зрительным волокнам, начиная от клеток сетчатки (палочки и колбочки, диполярные и ганглиозные клетки) далее по зрительному нерву, через зрительный тракт и структуры среднего мозга до затылочной доли коры головного мозга [2], давая возможность количественно оценить скорость проведения по зрительному анализатору по черно-белому и цветному спектру видимого света. Исследование проводилось по стандартной методике. Активный электрод размещался над затылочной областью в отведении О2, О1 международной схемы «10–20 %» и заземляющим электродом в лобной области (в точке Fрz). Ипсилатеральный электрод располагался в точке Сz. Импеданс под электродами составлял не более 5 кОм, размер ячейки 49’. Стимуляция проводилась на сменяющийся черно-белый и цветной шахматный паттерн поочередно на левый и правый глаз, в затемненной комнате с предварительной адаптацией в положении сидя за одно исследование. Оценивались компоненты ответа N75, P100 и N145 мс. Преимущественно делался упор на изучение основного компонента Р100 и амплитуды волны N75–P100. Все исследования проводились до начала базового лечения. Сравнительный анализ полученных результатов проводили с группой 15 здоровых лиц, статистически однородной по полу и возрасту.
Всем больным было проведено клинико-лабораторное обследование, включающее определение антител к основному белку миелина (ОБМ), которые определялись методом иммуноферментиого анализа с применением набора реагентов, разработанного Ястребовой Н.Е. и Ванеевой Н.П. (фирма «Навииа» г. Москва) [5].
Для анализа полученных результатов использовали расчет средних арифметических величин (М) и их ошибок (m), среднеквадратичное отклонение (δ). Достоверность различий средних значений оценивали с использованием критерия Стьюдента (t).
Результаты исследования и их обсуждение
При клиническом обследовании у 18 (58,1 %) больных была диагностирована диабетическая энцефалопатия, проявлением которой явились жалобы астенического характера: общая слабость, повышенная утомляемость, снижение работоспособности, тревожность, эмоциональная лабильность, нарушение концентрации внимания, снижение памяти. В 67,7 % случаев выявлялся цефалгический синдром. Следует отметить, что головная боль чаще носила характер сжимающей, сдавливающей по типу «тесного головного убора».
Симметричная дистальная полинейропатия встретилась у 28 (90,3 %) пациентов. При этом больных беспокоили покалывания, онемение, зябкость стоп и реже кистей или ощущение жжения, боль в конечностях, которое чаще усиливалось в ночное время или в покое. У больных было выявлено снижение болевой, температурной или вибрационной чувствительности по типу «носков» и «перчаток», снижение рефлексов, тонуса, в отдельных случаях умеренные двигательные нарушения. Гипостезия постепенно распространялась от дистальных отделов ног и рук к проксимальным. У 11 (35,5 %) пациентов отмечались депрессивные изменения разной степени выраженности как следствие болезни. Во всех случаях пациенты отмечали синдром вегетативной дистонии в виде разлитого дермографизма, диффузного гипергидроза, акроцианоза. В 3 случаях больные отмечали развитие предобморочных состояний. В 5 (16,1 %) случаях у больных развились вегетативно-трофические расстройства в виде артропатии, проявляющихся прогрессирующей деформацией голеностопного сустава и суставов стопы как следствие поражения вегетативных волокон.
Для уточнения степени поражения периферической нервной системы и, в частности зрительного анализатора были использованы показатели вызванных потенциалов. Для этого мы использовали метод зрительных ВП головного мозга, позволяющий объективно оценить именно состояние проводящей системы зрительного анализатора от сетчатки до коры головного мозга. Функциональное состояние зрительно-нервных путей у больных СД 1 типа исследовали с помощью ЗВП на сменяющийся шахматный паттерн. ЗВП представляют собой электрические сигналы, генерируемые нейронами головного мозга в ответ на импульсную-световую стимуляцию фоторецепторов глаза. Нами исследована степень нарушения проводимости оптических путей у больных СД 1 типа без диабетической ретинопатии (ДР).
Проведенное нейрофизиологическое обследование позволило выявить ряд закономерностей. Результаты представлены в таблице.
Динамика количественных показателей ВЗП у больных с сахарным диабетом 1 типа на черно-белый шахматный паттерн (М ± m)
|
Период |
СД 1 типа (n = 36) до лечения |
Контрольная группа (n = 15) |
|
Латентный период (мс) N75 Р100 N145 Амплитуда (мкВ) P100 |
76,1 ± 2,81 109,3 ± 2,78 164,2 ± 2,49 4,3 ± 1,63 |
72,1 ± 2,09 103,1 ± 1,72 151,3 ± 2,22 8,1 ± 1,21 |
Примечание. * – достоверные различия (р < 0,05) – с контрольной группой.
Так, анализируя результаты ЗВП на черно-белый ШП волны Р100, было установлено, что у пациентов с СД 1 типа отмечалось умеренное увеличение ЛП справа и слева, которое составило 109,3 ± 2,78 мс (в контрольной группе 103,1 ± 1,72 мс). Достоверных изменений волны Р100 нами найдено не было. Результаты исследования указывают, что удлинение ЛП волны Р100 наблюдалось в 87,1 % случаев. Графически это представлено на рис. 1.
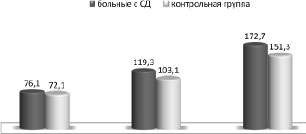
Рис. 1. Показатели компонентов ЗВП на черно-белый ШП относительно контрольной группы (в мс)
Другой важной закономерностью при ЗВП на ЧБ ШП было снижение амплитуды волны N75-P100, где анализ амплитудного компонента позволил отметить расщепленность гребня волны в трети случаев. Так, у обследованных больных амплитуда волны N75-Р100 составила 4,3 ± 1,63 мкВ, что указывало на состояние «депрессии» ответной реакции зрительных нейронов.
Наибольший исследовательский интерес представлял анализ полученных результатов на цветной сменяющийся шахматный паттерн. Во второй пробе использовался красный цвет (с диапазоном длины волны 625–740 нм) со сменяющимся на желтый цвет (с диапазоном длины волны 565–590 нм). Проведенные исследования позволили выявить достоверные изменения как по показателям ЛП, так и по амплитуде ответа. Графически это представлено на рис. 2. Было установлено, что на красно-желтый ШП (клетка 49’) было выявлено достоверное (р < 0,01) значительное увеличение ЛП волны Р100 во всех пробах относительно контрольной группы справа и слева и составило 143,2 ± 3,38 мс (контроль 109,8 ± 2,87 мс). Достоверные (р < 0,01) изменения по показателям ЛП были выявлены поздних компонентов ВП. Так ЛП волны N145 составил 185,2 ± 3,97 мс (контроль 149,4 ± 2,79 мс). Нами отмечено, что только в 3 (11,5 %) случаях ЛП волны Р100 был несколько выше результатов контроля, тем не менее превышал значения контрольной группы.
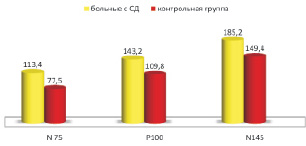
Рис. 2. Показатели компонентов ЗВП на красно-желтый реверсный ШП относительно контрольной группы (в мс)
Анализ амплитуды волны N75-P100 на красно-желтый ШП позволил отметить, что у больных с СД 1 типа также было отмечено достоверное (р < 0,05) снижение амплитуды ответа на стимул, который составил 2,2 ± 1,79 мкВ.
Результаты на зеленый-черный реверсный ШП, где импульсное воздействие было направлено в моноцветовом режиме видимого света только на систему клеток (колбочек) (зеленый цвет – диапазон длины волны 500–565 нм). В данной пробе ЗВП на зеленый цвет было установлено достоверное (р < 0,05) увеличение ЛП, которое составило по длине волны Р100 – 139,3 ± 3,78 (контрольная группа 107,3 ± 2,82 мс). Показатели ЛП волны N145 также имели достоверные изменения. Результаты представлены на рис. 3.
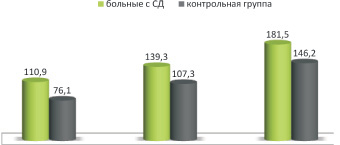
Рис. 3. Показатели компонентов ЗВП на зеленный-черный реверсный ШП относительно контрольной группы (в мс)
В данной пробе на зеленый цвет амплитуда волны N75-P100 была достоверно снижена. У обследованных пациентов амплитуда волны N75-Р100 составила 3,21 ± 2,14 мкВ. Результаты исследования дают основание полагать, что снижение амплитуды ответа по результатам ВЗП в разных световых волновых диапазонах связано со снижением импульсного потока по волокнам зрительного анализатора и, как следствие этого, уменьшением числа нейронов, которые активируют ответную реакцию коры на предъявляемый стимул. Принимая во внимание полученные результаты, мы считаем, что увеличение ЛП по зрительному анализатору у больных с СД 1 типа является следствием процессов демиелинизации. В этой связи для уточнения данных механизмов нами были проведены иммунологические исследования, связанные с уточнением концентрации антител Ig G к основному белку миелин как проявления хронической иммунологической реакции. При исследовании 19 пациентов с СД 1 типа было выявлено, что концентрация уровня антител IgG к ОБМ у больных с СД достоверно (p < 0,001) превышала уровень контрольной группы и составила в исследуемой группе 188,6 ± 4,1 мкг/мл (контрольная группа 50,1 ± 2,12 мкг/мл). Следует отметить, что повышение антител к ОБМ было выявлено во всех случаях.
Заключение
Таким образом, полученные нейрофизиологические и иммунологические результаты указывают, что при СД 1 типа происходят процессы демиелинизации в структурах зрительного анализатора, которые способствуют снижению проводимости «потока» зрительного импульса в корковые структуры зрительного анализатора. Данные изменения приводят к снижению ответной корковой реакции на предъявляемый стимул, преимущественно на цветной видимый спектр видимого света. Результаты исследования позволяют уже на ранних стадиях СД 1 типа выявить патологию зрительного анализатора, еще до появления клинически значимых проявлений. Данный метод может быть использован в диагностике ранних проявлений патологии зрительного анализатора у больных с СД 1 типа.
Рецензенты:
Долгова И.Н., д.м.н., доцент кафедры неврологии Ставропольского государственного медицинского университета, г. Ставрополь;
Христофорандо Д.Ю., д.м.н., доцент, заведующий отделением челюстно-лицевой хирургии Городской клинической больницы скорой медицинской помощи, г. Ставрополь.
Работа поступила в редакцию 17.01.2014.



