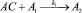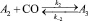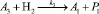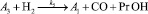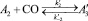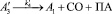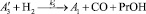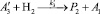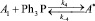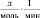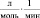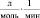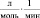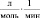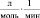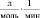Одним из наиболее важных мономеров, имеющим основополагающее значение для развития целого ряда отраслей в мире, является 1,4-бутандиол (1,4-БД). Он используется в производстве полиэфирных материалов и полиуретанов, полибутилентерефталата, поливинилпирролидона и специальных растворителей типа N-метилпирролидона [2].
По оценкам аналитиков [1, 3], мировой рынок потребления 1,4-бутандиола ежегодно растет. В США и Европе прирост составляет 4 % в год, а в Азии, включая Китай, годовой рост превышает 10 % в год. За последние годы темп роста потребления 1,4-БД превысил темп роста мирового производства на 15–25 %. Такое положение привело к дефициту 1,4-БД и его производных на рынках Европы и Азии и к заметному росту цен. По данным ICIS, цены на продукт сегодня вышли на уровень в 2500–2700 евро за тонну. Снижения или стабилизации цен на 1,4-бутандиол в ближайшем будущем не предвидится. Превышение спроса над предложением, а также бурный рост цен обусловлены разными факторами. Кроме того, высокий уровень спроса связан с растущим рынком потребления полибутилентерефталата (ПБТ), волокна спандекс, а также с открытием новых направлений использования инженерных пластиков. Так, для инновационного российского проекта компании «Макполимер» по выпуску ПБТ с применением нанокомпозитов потребуется не менее 50 тыс. т 1,4-бутандиола в год. В 2011 году мировые производственные мощности 1,4-БД приблизились к 2,5 млн т в год, а к 2014 году ожидается рост объема производства почти в 1,5 раза. Ведущим регионом производства 1,4-БД останется Азия, где львиную долю занимает Китай. Европа и США не намерены вводить новые мощности, однако на Ближнем Востоке намечается тенденция к расширению производства.
Наряду с основными способами производства 1,4-бутандиола из ацетилена и формальдегида по методу Реппе ~ 60% (фирмы Du Pont, BASF AG, GAF Corp и др.,), а также гидрированием малеинового ангидрида и его производных (~25 % – метод Дэви) фирма Davy Process Technology (DPT) и др., на мировой рынок вышла новая технология получения 1,4- бутандиола с использованием оксосинтеза из аллилового спирта и синтез газа (СО + Н2). В свою очередь аллиловый спирт получают из пропилена, либо его окислением с последующей изомеризацией окиси пропилена (компании Arco и Lyondell), либо ацетоксилированием пропилена с последующим гидролизом аллилацетата в целевой продукт (компания Dairen).
В основе вышеуказанного процесса оксосинтеза лежит проведение гомогенного гидроформилирования аллилового спирта с последующей водной экстракцией альдегидов и гидрированием их до целевых продуктов. Технология процесса была разработана ранее в Японии компаниями Kuraray Co. Ltd. и Daicel Chemical Industries. Ltd [10, 11] и параллельно в России во ВНИПИМ МинХимПром СССР с участием ИНХС АН СССР [4]. В дальнейшем американские компании, сначала Arco Chemical Technology L.P., затем Lyondell Chemical Technology L.P., приобрели данную технологию получения 1,4-бутандиола и совершенствуют его производство [12–15].
Существуют и менее распространенные технологии получения 1,4-БД, в частности, ацетоксилирование бутадиена на палладиевом катализаторе с последующим гидролизом ацетата (компания Mitsubishi) и одна из новых разработок (компания Du Pont) с использованием для производства 1,4-БД янтарной кислоты, полученной биологическим путем.
Цель работы – изучение основных кинетических закономерностей реакции гидроформилирования аллилового спирта с использованием гомогенного Rh-катализатора.
Материалы и методы исследования
Катализатор гидроформилирования HRh(CO)(PPh3)3 синтезировали по методике [7], трифенилфосфин производства фирмы «Мerck» использовали без дополнительной очистки, аллиловый спирт брали свежеперегнанный в токе аргона. ГЖХ-анализ проводили на приборе «Цвет-102» с пламенно-ионизационным детектором на составных колонках ПЭГ-20М на хроматоне N-AW и апиезон-L на хроматоне N-AW с диметиловым эфиром диэтиленгликоля (диглим) в качестве внутреннего стандарта.
Кинетические исследования проводились на установке оксосинтеза в металлическом реакторе объемом 30 мл с пробоотборником и электромагнитной мешалкой возвратно-поступательного типа (скорость перемешивания от 120 до 240 ударов в минуту). Общая методика проведения реакций: раствор 0,05 г (2,7 ммоль/л) HRh(CO)(PPh3)3 и 0,21 г (40,0 ммоль/л) PPh3 с 1 мл (0,735 моль/л) АС в 20 мл толуола выдерживали при нагревании в заданных условиях и компенсации постоянного давления синтез-газа определенного состава в течение 1,5 часа. Протекание реакции фиксировалось по поглощению синтез-газа, анализ продуктов и контроль за ходом реакции осуществлялся методом ГЖХ, для чего из реактора с интервалом в 10 мин отбирались пробы на ГЖХ-анализ.
Результаты исследования и их обсуждение
Использование гомогенных катализаторов на основе родия в процессах оксосинтеза имеет преимущество по сравнению с кобальтовыми и гетерогенными катализаторами, т.к. позволяет осуществлять процесс в более мягких условиях с высокой активностью и селективностью, что перспективно с точки зрения экономии энергосырьевых ресурсов. Температура и перемешивание реакционной смеси лучше контролируются, концентрации катализатора и лигандов регулируются значительно легче, т.е. появляется хорошая возможность применения современных автоматических систем управления процессом.
Для отработки и оптимизации условий получения 1,4-бутандиола из аллилового спирта и синтез-газа на опытном заводе ВНИПИМ (г. Тула) было создано опытное производство 1.4-БД (производительность ~ 15–30 т/год), включающее комплекс модельных и опытных установок и отработаны все стадии технологического процесса получения целевого продукта с выделением альдегидов водной экстракцией, гидрированием и ректификацией целевых продуктов в периодическом и непрерывном режимах, проведено сопоставление полученных собственных экспериментальных данных с имеющимися литературными и патентными данными.
Основной и наиболее важной стадией процесса является реакция гидроформилирования, т.е. взаимодействие аллилового спирта с синтез-газом (СО + Н2) в присутствии Rh-катализатора и лигандных добавок на основе соединений фосфора.
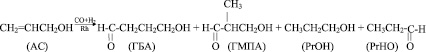
Поэтому для изучения влияния наиболее важных параметров реакции (температура, давление и состав синтез-газа, концентрация катализатора и подаваемого АС) были проведены научно-исследовательские работы на лабораторной установке оксосинтеза в рабочих интервалах: t = 25–130 °С, Робщ = 0,1–1,5 МПа, СRh = 1,6–6,5 ммоль/л и изучены в этих условиях основные кинетические закономерности гидроформилирования аллилового спирта с использованием каталитической системы, включающей HRh(CO)(PPh3)3 и 15-кратный избыток PPh3.
При исследовании зависимости скорости образования основных продуктов химической реакции: 4-гидроксибутиральдегида (ГБА), 2-метил-1,3-гидроксипропионового альдегида (ГМПА) и побочных: пропилового спирта (РrОН) и пропионового альдегида (РrНО) от давления в интервале 0,6–1,2 МПа было установлено, что увеличение давления выше 0,6 МПа не приводит к изменению выхода и селективности продуктов, а скорость реакции увеличивается лишь незначительно, что согласуется с общими представлениями об увеличении скорости реакций, протекающих по мономолекулярному механизму при увеличении давления.
При исследовании изменения состава синтез-газа (СО + Н2) от 1:1 до 1:3 были установлены следующие закономерности. С увеличением содержания Н2 в синтез-газе увеличивается доля побочных продуктов изомеризации и гидрирования, что приводит к увеличению содержания РrНО и РrОН. Вследствие этого присходит небольшое уменьшение общего выхода оксиальдегидов (ГБА и ГМПА), однако при этом в три раза повышается селективность реакции по ГБА. Вместе с тем при повышении парциального давления Н2 в смеси происходит незначительное снижение скорости реакции, тогда как при уменьшении парциального давления Н2, при соотношении (СО:Н2) от 2:1 до 3:1 реакция практически не идет.
При увеличении концентрации катализатора от 1,6 до 5,4 ммоль/л происходит значительное (в несколько раз) увеличение скорости реакции, тогда как выход продуктов и селективность практически не изменяются.
Наконец, при исследовании влияния изменения температуры в интервале от 65 до 120 °С оказалось, что скорость реакции возрастает с ростом температуры, причем происходит это не равномерно, а скачкообразно: при увеличении температуры до 75 °С происходит значительное увеличение скорости реакции, затем при 75–85 °С скорость находится на одном уровне и, наконец, при дальнейшем увеличении температуры до 90 °С опять происходит существенное ускорение реакции.
Дальнейшее повышение температуры малоэффективно, так как не приводит к заметному ускорению реакции, однако происходит увеличение доли побочных процессов: изомеризации АС в РrНО, дегидратации ГМПА в метакролеин (МА), образованию из оксиальдегидов вторичных продуктов конденсации и дезактивации родиевого катализатора.
Также было установлено, что при повышении температуры до 100 °С конверсия АС количественная, но при дальнейшем увеличении температуры до 110 и 120 °С при загрузке 15 %, масс часть аллилового спирта остается непрореагировавшей в реакционной смеси по окончании реакции. Возможно, это происходит в результате снижения концентрации активного Rh-катализатора из-за резкого повышения его скорости дезактивации, которая начинает сравниваться со скоростью гидроформилирования.
Наблюдаемое увеличение селективности по 2-окситетрагидрофурану(2-ОТГФ), в который переходит альдегид нормального строения(ГБА) в условиях реакции, при температуре выше 90 °С явление кажущееся, что связано с дегидратацией ГМПА в метакролеин, искажающее общую картину соотношения н/изо продуктов.
Для описания механизма реакции гидроформилирования аллилового спирта на основании полученных экспериментальных данных с учетом известных мнений [5–6 и 8–9] была принята следующая схема, приведенная на рисунке.
В основу кинетической модели был положен вышеуказанный механизм, согласно которому реакции соответствует следующая последовательность стадий.
Равновесие стадии (9) сдвинуто в сторону диссоциации комплекса А*, поэтому в первом приближении можно принять А* = 0.
Брутто-реакции, соответствующие этим пяти маршрутам реакции имеют следующий вид:
1. 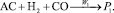
2. 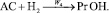
3. 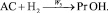
4. 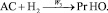
5. 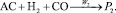
Реакции по маршрутам 1 и 5 представляют собой гидроформилирование аллилового спирта с образованием оксиальдегидов н- и изостроения. Реакции 2 и 3 представляют гидрирование аллилового спирта, протекающее по двум маршрутам. Реакция 4 – изомеризация аллилового спирта.
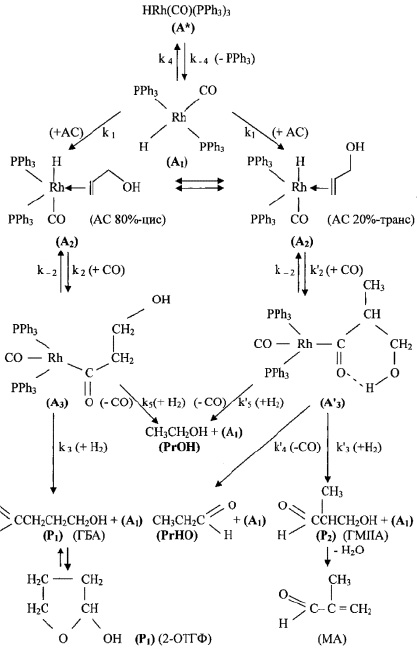
Схема механизма реакции гидроформилирования аллилового спирта
Таблица 1
Последовательность стадий и маршрутов реакций
|
№ п/п |
Стадия реакции |
Маршруты реакций |
||||
|
I |
II |
III |
IV |
V |
||
|
1 |
|
I |
I |
I |
I |
I |
|
2 |
|
I |
I |
0 |
0 |
0 |
|
3 |
|
I |
0 |
0 |
0 |
0 |
|
4 |
|
0 |
I |
0 |
0 |
0 |
|
5 |
|
0 |
0 |
I |
I |
I |
|
6 |
|
0 |
0 |
0 |
I |
0 |
|
7 |
|
0 |
0 |
I |
0 |
0 |
|
8 |
|
0 |
0 |
0 |
0 |
I |
|
9 |
|
|||||
Кинетические выражения для скоростей по маршрутам реакции были получены из принципа квазистационарности каталитических комплексов и общего баланса по катализатору. В результате получены следующие выражения для скоростей по маршрутам:
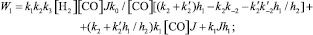
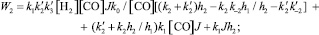
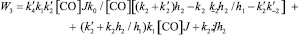
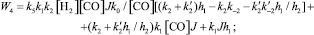
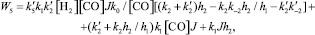
где 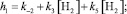
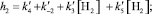
J – концентрация АС; [Н2], [СО] – концентрации Н2 и СО в жидкой фазе; k0 – исходная концентрация катализатора.
Из кинетических выражений следует, что все скорости имеют первый порядок по катализатору и дробные – по концентрации АС, Н2 и СО, причем эти порядки изменяются в течение реакции в пределах 0–1, что подтверждается полученными экспериментальными данными.
Решением обратной кинетической задачи были определены константы элементарных стадий, входящих в выражения для скоростей. Значения констант для различных температур приведены в табл. 2.
Были проведены теоретические расчеты измерения концентраций аллилового спирта и оксиальдегидов, эти данные сравнивались с экспериментальными значениями изменения концентраций этих веществ для различных условий гидроформилирования. При этом было установлено, что относительная ошибка теоретического описания экспериментальных данных не превышает 20%.
Таблица 2
Значения кинетических параметров, энергий активации и предэкспоненциальных множителей
|
Т, °С |
k1 |
k2 |
k–2 |
k3 |
k’2 |
k’-2 |
k’3 |
k’4 |
k5 |
k’5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
65 |
44,8 |
4283 |
0,48 |
6757 |
2033 |
2,0 |
3054 |
44,4 |
704,4 |
101,3 |
|
75 |
111,3 |
4688 |
1,38 |
22270 |
2100 |
5,5 |
5414 |
88,7 |
2918 |
242 |
|
85 |
141 |
4944 |
3,25 |
28230 |
2424 |
12,1 |
8449 |
158 |
5000 |
498 |
|
95 |
227 |
22780 |
10,0 |
55200 |
8804 |
22,4 |
25150 |
399 |
8776 |
908 |
|
Еакт, ккал/моль |
12,6 |
12,3 |
24,5 |
16,2 |
11,0 |
19,8 |
16,6 |
17,6 |
20,1 |
18,0 |
|
ln К0 |
22,8 |
26,4 |
35,9 |
33,2 |
23,8 |
30,3 |
32,7 |
30,1 |
36,8 |
31,6 |
Заключение и выводы
Из полученных данных следует, что лимитирующей стадией образования целевого продукта (2-окситетрагидрофурана) является стадия присоединения аллилового спирта (k1), тогда как стадии гидрирования и карбонилирования протекают со значительно более высокими соизмеримыми скоростями. К тому же, константы скоростей обратных реакций (k-2 и k’-2) значительно меньше соответствующих констант скоростей прямых реакций (k2 и k’2). Поэтому обратимостью указанных стадий можно пренебречь, и рассмотренный механизм носит существенно необратимый характер.
Таким образом, из наиболее важных технологических параметров (Р, Т, °С, Скат, и др.) наибольшее влияние на гидроформилирование аллилового спирта оказывают температура, состав синтез-газа и концентрация катализатора. Повышение температуры до 90 °С приводит к заметному ускорению реакции, однако при Т > 80 °С начинается дезактивация катализатора, поэтому повышение температуры выше 80 °C нежелательно. Увеличение концентрации катализатора также ускоряет реакцию, но использование больших количеств Rh-соединений нежелательно из-за экономической целесообразности. На селективность реакции оказывает влияние прежде всего состав синтез-газа, с увеличением содержания Н2 в смеси увеличивается селективность по 2-ОТГФ, однако при этом увеличивается и степень изомеризации и гидрирования аллилового спирта, поэтому лучше использовать синтез-газ составаН2/СО = (1:1) ~ (2:1).
Давление не оказывает принципиального влияния на ход реакции, поэтому с целью упрощения аппаратурного оформления процесса нецелесообразно применять давление выше 0,6 МПа.
Установленные на основании экспериментальных данных кинетические закономерности позволили определить возможные направления интенсификации процесса гидроформилирования аллилового спирта, включающие необходимость исследования влияния роли аллилового спирта и гидродинамических параметров колонных аппаратов реакторного узла на опытном заводе. Кроме того, показано, что существенное влияние на протекание реакции могут оказывать факторы, способствующие образованию побочных продуктов и дезактивации Rh-катализатора.
Рецензенты:
Вулах Е.Л., д.х.н., профессор, генеральный директор ООО «Фенил», г. Тула;
Шахкельдян И.В., д.х.н., профессор, декан факультета естественных наук, ФГБОУ ВПО «Тульский государственный педагогический университет им. Л.Н. Толстого», г. Тула.
Работа поступила в редакцию 19.07.2013.