Наиболее распространенными среди заболеваний органов зрения являются воспалительные поражения глаз инфекционной природы. Проблема оптимизации методов лечения этих заболеваний глаз в современных условиях приоб ретает особую актуальность в связи с широкой их рас пространенностью, рецидивирующим течением, опасностью снижения остроты зрения вплоть до слепоты. В Российской Федерации число больных с инфекционными заболеваниями глаз достигает 16 млн. в год, составляя 40,2 % среди амбулаторных больных и свыше 50 % – среди госпитализированных. Среди общего числа больных с заболеваниями глаз бактериальной природы 66,7 % составляют больные с конъюнктивитами, 23,3 % – с блефаритами, реже встречаются воспалительные поражения роговицы, внутренних оболочек глаза (4,2 %) и невриты (5,8 %) [4].
По данным литературных источников, в подавляющем большинстве случаев причиной инфекционных поражений глаз являются грамположительные микроорганизмы: S. epidermidis (75,0 %), S. aureus (14,1 %), Streptococcus spp. (6,2 %), Micrococcus spp. (1,6 %) и Enterococcus spp. (3,1 %) [1]. По данным Endophthalmitis Vitrectomy Study, возбудителями конъюнктивитов в США в 75 %–95 % случаев являются грамположительные кокки: S. aureus, S. epidermidis и другие коагулазанегативные стафилококки (КНС) [ 7 ].
Для установления точного диагноза и выбора рациональной специфической терапии бактериальных заболеваний глаз необходимо бактериологическое исследование отделяемого конъюнктивы для установления типа возбудителя и его чувствительности к антибиотикам. В связи с этим был проведен анализ результатов бактериальных посевов отделяемого конъюнктивы 98 больных, обратившихся по поводу инфекционных поражений глаз за три года (2006–2008 гг.). Проанализированы результаты 173-х бактериальных исследований (в разных случаях посевы проводились из одного или двух глаз пациентов в зависимости от локализации инфекции). По результатам посевов было идентифицировано 11 видов бактерий, давших рост в 198 случаях (в одних случаях были выявлены бактерии только одного вида, в других – инфекционный процесс был вызван комбинированным воздействием двух или трех видов бактерий). Процентные соотношения патогенной микрофлоры глаза, вызывающей его бактериальные поражения по данным анализа представлены на диаграмме.
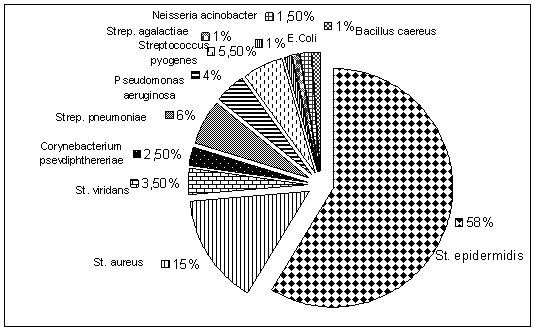
Рис. 1. Процентные соотношения патогенной микрофлоры, вызывающей бактериальное поражения глаза.
Из представленных данных можно сделать вывод, что наиболее частыми возбудителями бактериальных конъюнктивитов (более 90 % всех случаев) являются: Staphylococcus epidermidis,aureus, viridans; Streptococcus pyogenes, pneumoniae; Pseudomonas aeruginosa, в единичных случаях - Neisseria acinobacter, Escherichia Coli, Bacillus caereus.
Длительное использование антибактериальных препаратов в офтальмологии не могло не изменить степень чувствительности к ним микроорганизмов. Так, большинство обычных возбудителей глазных инфекций, включая H. influenzae, Ps. aeruginosa и St. viridans, имеют высокую резистентность к эритромицину; Ps. aeruginosa, кроме того, устойчив к левомицетину, а около 50 % стафилококков не чувствительны к сульфаниламидам [5]. Аминогликозиды – гентамицин и тобрамицин – обычно резервируются для грамотрицательной флоры, они не обладают высокой эффективностью против стрептококков; также возросла резистентность к этим антибиотикам со стороны стафилококков [5]. Несмотря на то, что исследования, проведенные в Санкт-Петербурге, показали, что резистентность КНС к тобрамицину и гентамицину в последние годы была относительно невысокой и составляла 10,7 % и 12,7 % соответственно, по данным зарубежных авторов, только 64 % изолятов микроорганизмов возбудителей глазных инфекций оказались чувствительны к тобрамицину [1] .
В отечественной и зарубежной литературе имеются данные о том, что, начиная с 1993 года, был отмечен рост резистентности к ципрофлоксацину и офлоксацину среди S. aureus, КНС, Streptococcus spp. и Ps. Aeruginosa доля резистентных изолятов этих микроорганизмов достигала 50 % [3]. Следует сказать, что каждые 15 лет признано проводить ротацию перечня применяемых антибиотиков для предупреждения развития к ним резистентности.
Учитывая вышеизложенное, в качестве перспективного антибактериального агента при разработке офтальмологической лекарственной формы может быть использован азитромицин. Данный антибиотик является лидирующим из группы макролидных антибиотиков (подкласс азалиды) и широко применяется в терапии многих инфекционных заболеваний. Азитромицин обладает широким спектром антибактериальной активности в отношении многих грамотрицательных и грамположительных патогенных микроорганизмов.
Таблица 1
Спектр антимикробной активности азитромицина in vitro [6]
| Наименование возбудителя | МПК 50 % (мг/л) | МПК 90 %(мг/л) |
| Staphylococcus epidermidis | 16 | > 128 |
| Staphylococcus aureus | > 128 | > 128 |
| Streptococcus viridans | 2,0 | 8,0 |
| Streptococcus pyogenes | 0,12 | 0,25 |
| Streptococcus pneumoniae | 0,125 | 1,0 |
| Streptococcus agalactiae | 0,06 | 0,12 |
| Corynebacterium psevdiphthereriae | 0,044 | 0,058 |
| Chlamydia trachomatis | 0,125 | 0,25 |
В таблице 1 представлены минимальные ингибирующие концентрации азитромицина для штаммов стрептококков и стафилококков, наиболее часто вызывающих поражения глаз, что было показано раннее. Также следует обратить внимание на антихламидийную активность азитромицина, так как в настоящее время количество инфекционных поражений глаз, вызванных хламидиями, резко возросло.
Азитромицин в высоких концентрациях накапливается в пораженных клетках, включая фагоциты. В свою очередь фагоциты, «нагруженные» антибиотиком, осуществляют его доставку непосредственно в очаг инфекции. Уникальность азитромицина определяется его высоким тканевым аффинитетом и длительным периодом полувыведения, составляющим в среднем 68 часов [6]. В таблице представлены данные по внутриклеточному накоплению азитромицина в сравнении с другими антибиотиками.
Таблица 2
Данные по внутриклеточному накоплению азитромицина и антибиотиков других классов [1]
|
| Концентрация мг/л | |
| Антибиотик | Внутри клетки | Внеклеточное пространство |
| Азитромицин | 51,7+4,3 | 0,1 |
| Ципрофлоксацин | 24,8+4,8 | 4,0 |
| Левофлоксацин | 28,8+4,8 | 6,0 |
| Моксифлоксацин | 50,2+2,7 | 4,5 |
| Бензилпенициллин | 1,6+0,2 | 10,0 |
| Телитромицин | 19,7+2,7 | 0,1 |
Из данных таблицы следует, что азитромицин существенно превосходит по показателю внутриклеточного накопления представителей наиболее широко применяемого в настоящее время класса антимикробных препаратов – фторхинолонов.
В настоящее время эффективным средством оптимизации подбора состава лекарственных форм может явиться квантово-химическое моделирование. В последнее десятилетие расчетные методы квантовой химии заняли прочное положение во многих областях фармации. Создание новых лекарственных препаратов выводится на качественно иной уровень при использовании квантово-химического моделирования молекул и процессов межмолекулярного взаимодействия.
Для подтверждения правильности выбора азитромицина в качестве антимикробного агента были проведены расчеты параметров, характеризующих его молекулу методами квантовой химии.
Оптимизация геометрии и валентных углов молекулы азитромицина проводилась с помощью программного пакета HyperChem (версия 8.0). Для оптимизации геометрии молекулы был применен блок – диагональный метод Ньютона-Рэфсона, основанный на оптимизации матрицы вторых производных, что позволяет достичь весьма высокой точности расчета при нахождении минимума на поверхности потенциальной энергии молекулы. На практике минимуму ППЭМ отвечает множество решений, связанное с конформационной заселенностью молекулы. Трехмерная модель молекулы, полученная в результате эксперимента, представлена на рисунке 2.
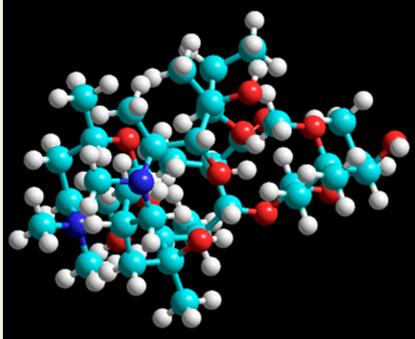
Рис. 2. Структура молекулы азитромицина после оптимизации геометрии молекулы.
Также были рассчитаны значения основных физико-химических дескрипторов, характеризующих параметры молекулы азитромицина. Расчет производился полуэмпирическим квантово-химическим методом АМ-1 при помощи пакета программ MOPAC 6.0. Значения физико-химических дескрипторов, полученных в результате эксперимента, представлены в таблице.
Таблица 3
Значения некоторых физико-химических дескрипторов молекулы азитромицина
| Энергия гидратации, ккал/мол | -6,16 |
| Липофильность log P | 2,3 |
| Поляризуемость Å | 77,9 |
| Энергия высшей занятой орбитали (эВ) | 8,46 |
| Энергия низшей вакантной орбитали (эВ) | 0,71 |
Параметр – значение энергии гидратации (сольватации) – используется для прогнозирования растворимости веществ в воде. Поляризуемость является дескриптором, характеризующим полярность молекулы и позволяющим судить о сродстве БАВ к различным средам, а также характеризует степень смещения электронной плотности в молекуле при межмолекулярных взаимодействиях. Энергия высшей занятой орбитали характеризует электроннодонорную способность молекулы. Энергия низшей вакантной орбитали характеризует электронакцепторную способность. Величина десятичного логарифма коэффициента распределения (log P) в модельной системе «октанол-вода» позволяет прогнозировать проницаемость молекулы вещества через биомембраны. По данным литературы, вещества, имеющие значение коэффициента распределения от 0 до 3, отличаются оптимальным сродством к липофильным соединениям, в том числе к мембранам клеток.
Таким образом, нами показано, что использование азитромицина в офтальмологических формах возможно и целесообразно.
СПИСОК ЛИТЕРАТУРЫ:
1. Вохмяков, А.В. Выбор оптимального антибиотика для профилактики инфекционных осложнений в офтальмологии / А.В. Вохмяков, П.А. Гурченок, И.Н. Околов // РМЖ: Клиническая офтальмология. – 2007. – Т. 8, № 1. – C. 36–40.
2. Егоров, Е.А. Противовоспалительная и антибактериальная терапия синдрома «красного глаза» / Е.А. Егоров, Т.В. Ставицкая // РМЖ: Клиническая офтальмология. – 2004. – Т. 5, № 3. – С. 132–135.
3. Каргальцева, Н.М. Резистентность к фтохинолонам микроорганизмов, выделенных от больных с конъюнктивитами / Н.М. Каргальцева, Л.А. Кафтырева // Офтальмохирургия и терапия. – 2004. – Т. 4, № 4. – С. 21–24.
4. Майчук Ю.Ф. Фармакотерапия инфекционных заболеваний глаз. //Антибиотики и химиотерапия. – 1999. – № 1. – С. 20–30.
5. Околов, И.Н. Резистентность коагулазанегативных стафилококков, выделенных от больных с конъюнктивитами, к антибактериальным препаратам / И.Н. Околов, Л.А. Кафтырева // Новое в офтальмологии. – 2006. – № 4. – С. 34–36.
6. Романовских, А.Г. Новая лекарственная форма азитромицина при лечении внебольничных инфекций верхних дыхательных путей / А.Г. Романовских, А.И. Синопальников // Клиническая микробиология и антимикробная химиотерапия. – 2006. – Т. 8, № 4. – С. 350–358.
7. Сергиенко Н.М. Профилактика послеоперационного эндофтальмита // Офтальмологический журнал. – 2006, № 3. – С. 151–152.



