Бактериальный липополисахарид (ЛПС, эндотоксин) представляет собой амфифильный биополимер, содержащий гидрофильные (О-специфические цепи, олигосахарид кора) и гидрофобный (липид А) фрагменты. Он является важнейшим фактором патогенности грам-отрицательных микроорганизмов, ответственным за развитие бактериального эндотоксикоза и его наиболее тяжелой формы – бактериально-токсического шока. Влияние ЛПС на макроорганизм проявляется в стимуляции лейкоцитов, тромбоцитов и эндотелиальных клеток, усилении продукции интерлейкинов, фактора некроза опухолей-альфа и ряда других медиаторов, в активации системы комплемента и факторов свертывания крови, что может заканчиваться развитием диссеминированного внутрисосудистого свертывания крови, эндотоксинового шока и острой полиорганной недостаточности [3, 6].
Актуальным является поиск способов уменьшения летальных эффектов ЛПС, что может открыть новые перспективы в детоксикации организма. Обычно для снижения токсичности ЛПС применяются различные химические вещества (катионные амфифильные молекулы, синтетические пептиды, полиамины, нетоксичный полисахарид хитозан), уменьшающие патогенное действие ЛПС в результате образования с ним макромолекулярных комплексов [1, 2, 7, 8]. Перспективным направлением является создание олигонуклеотидных аптамеров, специфически связывающихся с ЛПС и снижающих его патогенную активность [5, 9].
Однако химическая модификация молекулы ЛПС не всегда оказывается доступной, удобной и приемлемой в силу дороговизны и малой доступности применяемых для этой цели веществ. Кроме того, вещества, использующиеся для модификации токсической молекулы, сами могут обладать биологической активностью и оказывать влияние на исследуемые функции.
В настоящей работе была поставлена цель: исследовать модифицирующее влияние низкоинтенсивного электромагнитного излучения с частотой 1 ГГц на структурообразовательные свойства и летальный эффект бактериального липополисахарида.
Материалы и методы исследования
В работе использовался ЛПС кишечной палочки 055:B5 (Sigma, США). Для исследования структурообразовательных свойств ЛПС разводили ex tempore в 0,9 % растворе натрия хлорида (20 мг/мл). Приготовленную суспензию (2 мл) делили на 2 пробы: одна являлась контролем, а другая в течение 10 мин подвергалась электромагнитному воздействию (частота – 1 ГГц, плотность мощности – 0,1 мкВт/см2) с помощью аппарата «Акватон-2» (производитель – НПП «Телемак», Саратов, Россия). Раструб излучателя помещался на расстоянии 10 см от облучаемого объекта.
Для изучения процесса спонтанного структурообразования ЛПС использовался метод клиновидной дегидратации [4], основанный на исследовании структурного следа (фации), формирующегося при высыхании капли препарата в стандартных условиях. 1 мкл исследуемой суспензии (контрольная проба) помещался на сухое, чистое, обезжиренное предметное стекло. Обычно наносились 6–8 капель для сравнительного анализа. Далее предметное стекло с препаратом в строго горизонтальном положении помещали в термостат и высушивали при 37 ○С в течение 30 мин. Аналогично с контрольными пробами готовились опытные препараты.
После высыхания препараты подвергались микроскопическому исследованию. Применялась световая микроскопия (Zeiss, Germany) с фоторегистрацией структурного следа и сохранением информации в файле компьютера. Анализ фаций включал определение количественных показателей с последующей статистической обработкой. При этом использовалась специальная компьютерная программа, позволяющая рассчитывать следующие параметры: S1 – площадь периферического ободка, нормированная на общую площадь фации; S2 – площадь промежуточной (приободковой) зоны, нормированная на общую площадь фации; S3 – площадь центральной зоны, нормированная на общую площадь фации; S1/S2 – смещение центра промежуточной зоны относительно центра ободка фации; S2/S3 – смещение центра центральной зоны относительно центра ободка фации. В центральной и промежуточной зонах фации рассчитывались: N – количество гребешков в типичном фрагменте фации; Average size (AS) – средний размер гребешков в типичном фрагменте фации; Entr. – неоднородность поверхности фации в типичном фрагменте; D corr. – корреляционная размерность типичного фрагмента. Количественные параметры обрабатывались статистически с расчетом средней арифметической (М) и её ошибки (m) с использованием статистического пакета программ Prizm-4. Достоверность различий средних вычисляли с использованием t-критерия Стьюдента. Различия считались достоверными при р < 0,05.
Определение летальных доз (ЛД) эндотоксина проводили на 84 нелинейных белых мышах-самцах массой 20 г, которые были разделены на 2 группы. Предварительно 25 мг ЛПС разводили в 25 мл дистиллированной воды (концентрация ЛПС = 1000 мкг/мл). Затем раствор ЛПС делился на 2 пробы: 10 мл – для контроля, 15 мл – для облучения. Облучение раствора ЛПС производилось в малой чашке Петри аппаратом «Акватон-02» в течение 10 мин. Выбор времени облучения был обоснован тем, что в течение 10 мин происходила модификация процесса структурообразования молекул ЛПС, что позволяло предположить изменение при этом его летальных свойств. Мышам первой группы (контроль) внутрибрюшинно вводили нативный (необлученный) ЛПС в дозах 100, 200, 300 и 400 мкг/мышь (соответственно 0,1, 0,2, 0,3 и 0,4 мл ЛПС). Число животных для каждой дозы – 8. Мыши второй (опытной) группы получали внутрибрюшинные инъекции предварительно облученного ЛПС в тех же дозах (объемах). Число животных для каждой дозы – 13. Наблюдение за животными проводилось в течение 24 часов после введения ЛПС. При этом учитывали количество погибших и выживших особей. Расчет летальных доз ЛПС производился методом пробит-анализа.
Результаты исследования и их обсуждение
Картина фаций, получаемых при дегидратации необлучённой суспензии ЛПС в физиологическом растворе, отличалась разнообразием структурных элементов. Здесь чётко визуализировались 3 зоны: приподнятый ободок, обрамляющий фацию по периферии (периферическая зона), приободковая (или промежуточная) и центральная зоны. Облучение суспензии ЛПС низкоинтенсивным электромагнитным излучением приводило к заметной модификации процесса структурообразования. Результаты количественной обработки фаций, получаемых при клиновидной дегидратации суспензии ЛПС в контроле и после УВЧ облучения, представлены на рисунке.
Как видно из рисунка, воздействие низкоинтенсивным электромагнитным излучением с частотой 1 ГГц приводило к изменению относительных размеров различных зон фации: уменьшались периферическая и приободковая зоны (p < 0,01 и p < 0,001 соответственно), в то время как размер центральной зоны увеличивался на 20 % (p < 0,01). После УВЧ-воздействия примерно в 2 раза возрастало количество гребешковых объектов в центральной и приободковой зонах фации (p < 0,05). Однако их средний размер не претерпевал существенных изменений. На этом фоне в 1,2 раза увеличивался показатель Entr, характеризующий структурную неоднородность центральной зоны фации (p < 0,05), а также на 32 % возрастал показатель Entr приободковой зоны (p < 0,02). Достоверно изменялась и структурированность (корреляционная размерность) обеих анализируемых зон (p < 0,02).
Результаты экспериментов по определению летальных доз эндотоксина представлены в таблице. Как следует из таблицы, в контрольной группе при введении минимальной дозы ЛПС (100 мкг) погибла 1 мышь из 8, тогда как при введении максимальной дозы (400 мкг) погибли все мыши. В группе животных, получавших облученный ЛПС, от минимальной дозы яда не погибла ни одна мышь из 13, а при введении максимальной дозы погибли 12 мышей из 13.
Электромагнитное воздействие на бактериальный эндотоксин снижает его летальный эффект
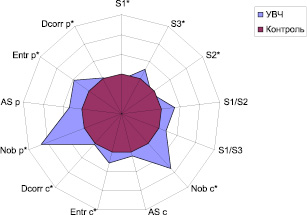
Изменение количественных параметров фаций бактериального ЛПС после УВЧ-облучения; контроль – 100 % (условные обозначения показателей см. в тексте)
Результаты исследования летального эффекта нативного бактериального ЛПС и ЛПС после электромагнитного облучения
|
Нативный ЛПС (контроль) |
Облучённый ЛПС (опыт) |
||
|
Доза ЛПС (мкг/мышь) |
Умерло/всего |
Доза ЛПС (мкг/мышь) |
Умерло/всего |
|
100 |
1/8 |
100 |
0/13 |
|
200 |
3/8 |
200 |
3/13 |
|
300 |
7/8 |
300 |
6/13 |
|
400 |
8/8 |
400 |
12/13 |
Для контрольной группы расчетные параметры ЛД составили:
ЛД16 – 124,7 мкг/мышь;
ЛД50 – 212,2 мкг/мышь;
ЛД84 – 299,7 мкг/мышь;
ЛД100 – 343,4 мкг/мышь.
Для опытной группы расчетные параметры ЛД составили:
ЛД16 – 188,2 мкг/мышь;
ЛД50 – 287,1 мкг/мышь;
ЛД84 – 386,0 мкг/мышь;
ЛД100 – 435,4 мкг/мышь.
Для группы контроля М ± m ЛД50 составило – 212,2 ± 25,2, для опытной группы – 287,1 ± 22,3. Достоверность разницы (р) между ЛД50 группы контроля и опытной группы < 0,02.
Результаты данных экспериментов свидетельствуют о том, что низкоинтенсивное электромагнитное излучение частотой 1 ГГц, плотностью мощности 0,1 мкВт/см2, воздействующее в течение 10 мин, достоверно снижает летальный эффект ЛПС на 26 % (р < 0,02) и приводит к изменениям в суспензионной системе ЛПС-физиологический раствор, которые отражаются на кинетике структурообразования.
Данное наблюдение, несомненно, заинтересует как теоретиков, так и клиницистов, поскольку оно открывает перспективу немедикаментозной коррекции свойств бактериальных токсинов.
Рецензенты:
Чеснокова Н.П., д.м.н., профессор кафедры патологической физиологии, ГБОУ ВПО «Саратовский ГМУ» Минздрава России, г. Саратов;
Зимняков Д.А., д.ф.-м.н., профессор, заведующий кафедрой физики, ФГБОУ ВПО «Саратовский государственный технический университет имени Гагарина Ю.А.», г. Саратов.
Работа поступила в редакцию 28.05.2014.



