Использование аутологичных стволовых/прогениторных клеток, в том числе мультипотентных мезенхимальных стромальных клеток (ММСК) и эндотелиальных прогениторных клеток (ЭПК) в клинической практике рассматривается как перспективный метод терапии заболеваний сердечно-сосудистой системы, в том числе и при хронической сердечной недостаточности [6, 8–9]. Известно, что ЭПК принимают активное участие в процессах репарации/регенерации повреждений стенок сосудов. Формирование новых сосудов в постнатальном периоде осуществляется как за счет развития коллатеральных сосудов (артериогенез), новых капилляров (неоангиогенез) путем миграции и пролиферации предсуществующих дифференцированных эндотелиальных клеток, так и васкулогенеза, когда сосуды образуются из ЭПК [4]. Также показано, что резидентные прогениторные клетки, через продукцию биоактивных веществ, стимулируют миграцию в зону повреждения зрелых эндотелиальных клеток и ЭПК из других зон, программируя их дифференцировку в зрелые клетки и способствуя тем репарации повреждений [4]. Использование ММСК, в том числе и из жировой ткани (ЖТ), в медицине связано с противовоспалительной активностью, способностью стимулировать процессы васкуляризации в зоне ишемии тканей и органов, а также дифференцировкой в адипогенном, остеогенном, хондрогенном и миогенном направлениях, в том числе и в кардиомиоциты [2–4, 6, 9]. Функциональная активность ММСК регулируется различными биологически активными веществами, в том числе цитокинами и ростовыми факторами, продуцируемыми микроокружением. Известно, что ЭПК продуцируют ряд биологически активных веществ, способных оказывать влияние на окружающие их ткани и клетки [2]. В доступной литературе имеются единичные исследования, посвященные взаимодействию ММСК с ЭПК, в которых главная роль отводится именно биологически активным веществам, продуцируемым данными клетками [4–5].
Целью данного исследования было изучение эффекта цитокинов и ростовых факторов, продуцируемых эндотелиальными клетками на функциональную активность ММСК.
Материалы и методы исследования
ММСК из ЖТ от условно здоровых лиц получали при проведении процедуры липосакции. ЖТ подвергали ферментативной диссоциации с использованием 0,1 % раствора коллагеназы I типа (Sigma-Aldrich, США). Для получения ЖТ-ММСК клетки ЖТ инкубировали в пластиковых флаконах для культур тканей (TPP, Швейцария) в питательной среде αMEM (Биолот, СПб), дополненной 100 мкг/мл гентамицина сульфата (Дальхимфарм, Хабаровск), 2 ммоль L-глютамина (ICN, США) и 20 %FCS, при 37 °C в CO2-инкубаторе. В экспериментах использовали ЖТ-ММСК от 2–6 пассажа. Для адипогенной дифференцировки ЖТ-ММСК инкубировали в посадочной среде с добавлением 10–7 М дексаметазона и 0,5 мМ изобутилметилксантина. Для остеогенной дифференцировки КМ-ММСК инкубировали с добавлением к посадочной среде 10–9 М дексаметазона, 10 мМ β-глицерофосфата и 50 мкг/мл аскорбат-2-фосфотазы. Клетки культивировали 14 дней, замену среды осуществляли каждые 3–4 дня. Морфологическую картину КМ-ММСК оценивали под инвертированным микроскопом Olympus (Япония). Фенотип ЖТ-ММСК исследовали на проточном цитометре FACSCantoII (Becton Dickinson, США) с использованием моноклональных антител меченых FITC и PE к CD3, CD14, CD16, CD14, CD20, HLA-DR, (Сорбент, Россия), а также к CD34, CD45, CD73, CD90, CD105 (Becton Dickinson, США). Спонтанную и индуцированную (30 % кондиционной среды от клеток эндотелиальной линии человека EA.Hy926) пролиферацию ЖТ-ММСК исследовали по изменению клеточного импеданса на аппарате Real-Time Cell Analyzer single-plate Instrument xCELLigence System (Roche Applied Science, Германия) в режиме реального времени и выражали в клеточном индексе (КИ): КИ = (Rn – Rb)/t, где Rb – это исходное значение импеданса в лунке, содержащей только ростовую для клеток среду, а Rn – это значение импеданса в лунке в любое время (t), содержащей помимо ростовой среды и тестируемые клетки. Миграцию ЖТ-ММСК исследовали на аппарате Cell-IQ в режиме реального времени (CM Technologies, Финляндия). Для этого ЖТ-ММСК вносили в 96 луночные плоскодонные планшеты на 24 часа в культуральной среде для адгезии к пластику. Через 24 часа в центре лунки наносили кончиком наконечника на 200 мкл рану, слущенные клетки удалялись двукратным промыванием лунки забуференным физиологическим раствором, вносилась культуральная среда с минимальным содержанием сыворотки (1 %). В опыте вносили КС от клеток EA. Hy926 (30 или 50 %), рекормон – рекомбинантный человеческий эритропоэтин (30 Ед./мл; Хоффманн-Ля Рош Лтд., Швейцария) и VEGF – ростовой фактор эндотелия сосудов (10 нг/мл; BioVision, США). Планшет помещали в аппарат Cell-IQ, в котором подается газовая смесь (95 % кислорода и 5 % СО2), задавали условия съемки параметров в лунке (количество полей просмотра – 16, интервал между съемками – 15 минут), в результате чего аппарат в автоматическом режиме производил сканирование выбранных областей лунки и сохранял результаты в виде изображений. Оценка результатов исследований производилась с использованием пакета программ Cell-IQ analyzer. Для получения КС от клеток EA. Hy926, любезно предоставленных Dr. C.J. Edgel (Университет Каролины, США), клетки инкубировали в питательной среде DMEM/F12 с добавлением 10 % FCS (HyClone, США), 160 мкг/мл гентамицина сульфата (Дальхимфарм, Хабаровск), 2 ммоль L-глютамина (ICN, США) и HAT, добавку к среде, содержащую гипоксантин, аминоптерин и тимидин (ICN, США). Через 72 часа надосадочная жидкость снималась, разливалась по аликвотам и хранилась при –70 °С до момента использования в работе. Уровни TNF-α, IL-10, IL-18, IL-8, Epo, G-CSF, VEGF определяли с использованием коммерческого набора производства «Вектор-БЕСТ» (г. Новосибирск). Уровень продукции стойких метаболитов оксида азота (NO) в кондиционных средах EA.Hy926 исследовали с использованием реактива Грейсса. Статистическую обработку данных проводили с использованием программы Statistica 6.0, меры центральной тенденции и рассеяния описаны медианой (Ме), нижним (Lq) и верхним (Hq) квартилями; достоверность различий рассчитывалась по U-критерию Манна-Уитни и принималась при значениях p < 0,05.
Результаты исследования и их обсуждение
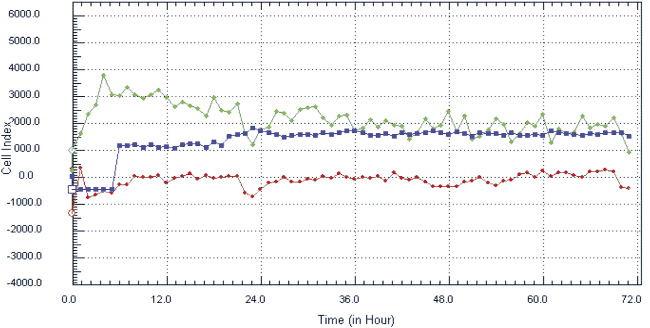
На ранних сроках культивирования ядросодержащие клетки из стромально-васкулярной фракции жировой ткани доноров были гетерогенными, а к 14 дню становились гомогенными, приобретали веретенообразную форму, характерную для клеток мезенхимальной принадлежности (рис. 1, а, б), обладали способностью к формированию колониеобразующих единиц, а также к цитодифференцировке в адипогенном (рис. 1, в) и остеогенном (рис. 1, г) направлении. Иммунофенотипический анализ ЖТ-ММСК выявил, что использованные в экспериментальном исследовании ММСК доноров были позитивны по экспрессии типичных для ММСК маркеров – CD73 (98,0; 97,0–99,0), CD90 (95,5; 89,0–99,0) и CD105 (96,0; 94,0–96,0) и негативны в отношении следующих кластеров дифференцировки – CD3, CD14, CD16, CD20, HLA-DR, CD34, CD45. Анализ изменения импеданса ЖТ-ММСК выявил зависимость пролиферации от наличия в питательной среде ростовых факторов, содержащихся в FCS и КС (рис. 2, а). Так, для ЖТ-ММСК показано статистически значимое подавление пролиферативного потенциала при 1 % FCS в питательной среде по сравнению с пролиферацией в присутствии 10 % FCS (p < 0,05)и 30 % КС от клеток EA. Hy926 (p < 0,05).
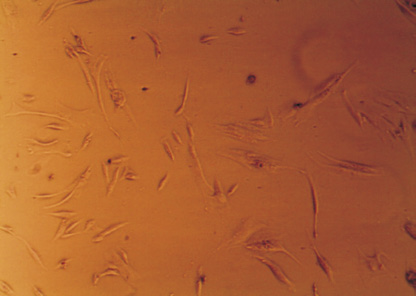
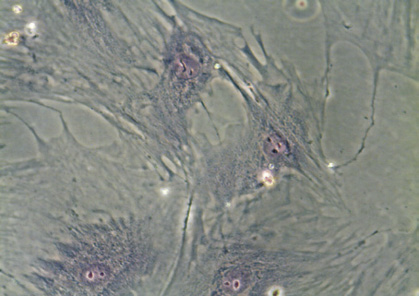
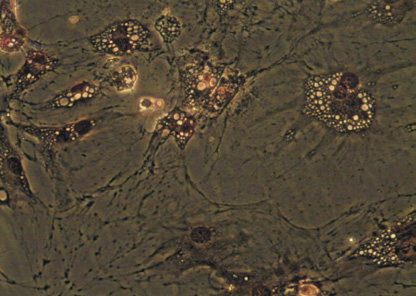
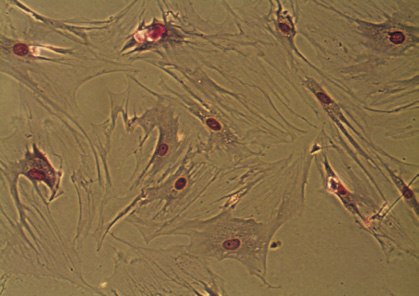
Рис. 1. Морфология ЖТ-ММСК: а – веретенообразная морфология ЖТ-ММСК (х40; нативный препарат); б – ЖТ-ММСК окраска по Романовскому-Гимзе (х400); в – адипогенная дифференцировка ЖТ-ММСК окраска Oil Red-O и докрашивание по Романовскому-Гимзе (х400); г – остеогенная дифференцировка ЖТ-ММСК окраска AgNO3 и докрашивание по Романовскому-Гимзе (х400).
а
б
в
г
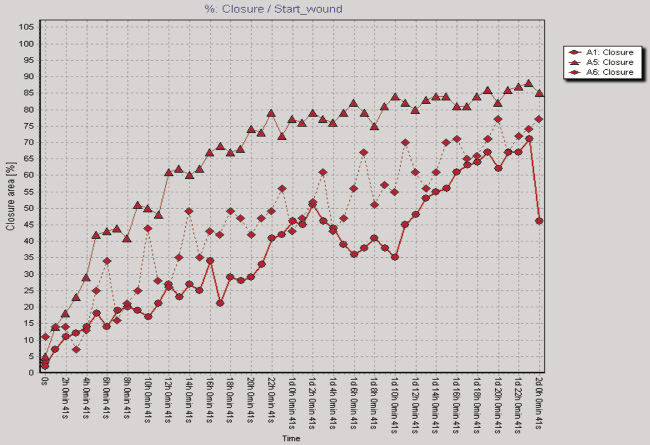
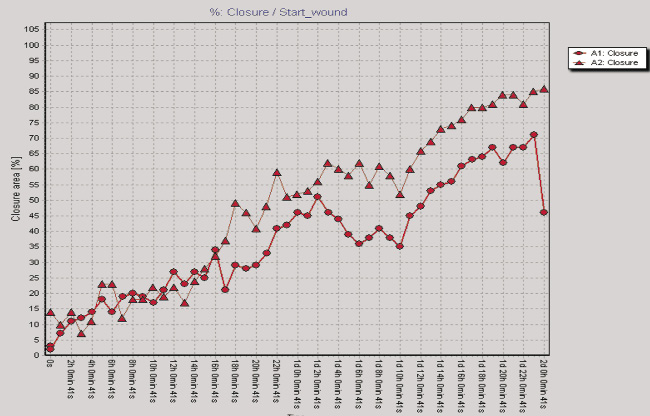
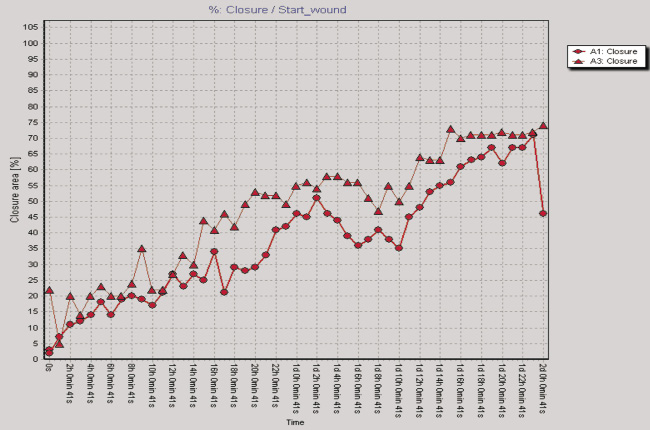
Рис. 2. Показатели изменения клеточного импеданса ЖТ-ММСК в режиме реального времени на аппарате xCELLigence System (а) и миграционная активность ЖТ-ММСК в режиме реального времени по данным аппарата Cell-IQ (б–г): а – красная линия – 1 % FCS, зеленая линия – 10 % FCS, синяя линия – 30 % КC; б – круг – 1 % FCS, треугольник – 30 % КС, ромб – 50 % КС; в – круг – 1 % FCS, треугольник – рекормона (30 ЕД/мл);г – круг – 1 % FCS, треугольник – VEGF (10 нг/мл)
Одним из параметров, характеризующих функциональную активность ЖТ-ММСК, является способность к миграции в направлении градиента концентрации хемотаксических веществ, в том числе и ростовых факторов [9]. Как видно из рис. 2, б, ЖТ-ММСК статистически значимо быстрее мигрируют в область «раневой поверхности» в присутствии 30 % КС от клеток EA.Hy926 (p < 0,05). В то же время наличие 50 % КС в питательной среде в меньшей степени активировало миграцию ЖТ-ММСК в область «раневой поверхности» по сравнению с контролем (рис. 2, б). Также показано статистически значимое увеличение пролиферативной и миграционной способности ЖТ-ММСК под влиянием рекормона (рис. 2, в) и VEGF (рис. 2, г). Известно, что функциональная активность ММСК зависит от цитокинов и ростовых факторов [4–5, 7]. Поэтому нами были оценены уровни продукции биологически активных веществ клетками EA.Hy926. Показано, что клетки EA.Hy926 продуцируют IL-8 (1870,75; 1405,0–3253,25 пг/мл), IL-10 (169,0; 80,0–244,0 пг/мл), IL-18 (223,0; 161,25–473,5 пг/мл), TNF-α (11,25; 10,0–13,75 пг/мл), G-CSF (31,0; 14,75–67,25 пг/мл), VEGF (75,0;25,0–197,5 пг/мл), Epo (300,0; 245,0–547,5 мМЕ/мл) и NO (3,55; 2,9–4,15 μM/мл), способные стимулировать процессы пролиферации и миграции в микроокружение. Полученные данные о морфофункциональных свойствах ЖТ-ММСК не противоречат имеющимся в литературе данным, в которых также указывается возможность получать ММСК из жировой ткани, напоминающих фибробласты, обладающие способностью к образованию колоний и дифференцировке в остеогенном и адипогенном направлении, а фенотипически такие клетки несли маркеры, характерные для ММСК [3]. Результаты анализа пролиферативной активности ЖТ-ММСК в присутствии КС, полученной от клеток человеческой эндотелиальной гибридомы EA.Hy926, морфологически имеющей черты эндотелиоцитов для средних и крупных сосудов, указывают на активацию пролиферативного потенциала по сравнению с таковым параметром для клеток, росших в обедненной сывороткой питательной среде. Также в присутствии КС от клеток EA.Hy926 нами отмечено увеличение миграционного потенциала ЖТ-ММСК в тесте «раневой поверхности». Активация пролиферации и миграции КС от клеток EA.Hy926 может быть обусловлена тем фактом, что многие клетки организма способны к продукции биологически активных веществ, в том числе и стволовые/прогениторные клетки. В подтверждение данной гипотезы нами был исследован спектр продукции биологически активных веществ клетками EA.Hy926. Нами показана продукция широкого спектра цитокинов и ростовых факторов EA.Hy926. Известно, что КС от ММСК подавляет процессы апоптоза печеночной ткани при ее повреждении CCl4 [8]. С учетом того факта, что в КС от клеток EA.Hy926 содержатся биологически активные вещества, то не исключено, что именно за счет их наличия (эритропоэтин, TNF-α, IL-8, G-CSF) и выявляется стимулирующее влияние на функциональную активность ЖТ-ММСК. Известно, что эритропоэтин оказывает протективный эффект и на клетки негемопоэтического ряда, обусловленный стимуляцией через экспрессируемые на поверхности клеток рецепторов к нему или же через активацию в них генов эритропоэтина и синтезом эритропоэтина в клетках, тем самым оказывая ауто- и паракринный характер регуляции функциональной активности этих тканей [1]. Под действием TNF-α активируется продукция IL-8 ММСК и дифференцировка их в направлении эпителиоцитов легких [7].
Заключение
Таким образом, при сокультивировании ЖТ-ММСК с кондиционной средой от клеток человеческой эндотелиальной гибридомы EA.Hy926 отмечается активация процессов пролиферации и миграции ЖТ-ММСК, что может быть использовано для предобработки ММСК с последующим их введением в организм пациента с целью улучшения приживления ММСК и проявления ими более выраженного позитивного терапевтического эффекта.
Рецензенты:Шурлыгина А.В., д.м.н., профессор лаборатории хронофизиологии, главный научный сотрудник, ФГБУ «НИИФФМ» СО РАМН, г. Новосибирск;
Бгатова Н.П., д.б.н., зав. лабораторией ультраструктурных исследований ФГБУ «НИИКЭЛ» СО РАМН, г. Новосибирск.
Работа поступила в редакцию 14.03.2014.
Библиографическая ссылка
Лыков А.П., Бондаренко Н.А., Сахно Л.В., Шевела Е.Я., Повещенко О.В., Ким И.И., Никонорова Ю.В., Коненков В.И. ВЛИЯНИЕ СЕКРЕТОРНЫХ ФАКТОРОВ ЭНДОТЕЛИАЛЬНЫХ КЛЕТОК НА ПРОЛИФЕРАТИВНУЮ И МИГРАЦИОННУЮ СПОСОБНОСТЬ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК ЧЕЛОВЕКА // Фундаментальные исследования. 2014. № 4-2. С. 296-301;URL: https://fundamental-research.ru/ru/article/view?id=33831 (дата обращения: 12.03.2026).



