В настоящее время получено большое количество фотохромных спиропиранов, поэтому важной задачей для исследователей стало выявление факторов, влияющих на стабильность и спектральные характеристики их спироциклических и мероцианиновых форм [4, 5]. Использование функциональных групп в структуре спироциклических соединений в ряде случаев позволяет им координироваться с катионами переходных металлов, что даёт возможность получать фотохромные спиропираны, обладающие прогнозируемыми магнитными свойствами [3]. Соли на основе индолиноспиропиранов вызывают особый интерес в связи с тем, что при наличии сложного хромоксалатного катиона образование их фотоиндуцированных форм при облучении активирующим излучением сопровождается изменением магнитного момента, то есть эти соединения являются своеобразными фотомагнетиками [1].
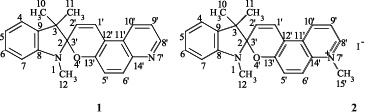
Цель исследования. Ранее нами было показано, что индолиновые спиропираны на основе 5-формил-6-гидроксихинолина типа 1 и их соли типа 2 проявляют фотохромные свойства в ацетонитрильных растворах при комнатной температуре (рис. 1).
Целью настоящего исследования является изучение строения полученных соединений методами многоядерной ЯМР спектроскопии, а также определение свободной энергии активации термоиндуцированного процесса конверсии закрытой формы спиропирана методом динамического ЯМР.
Результаты исследования и их обсуждение
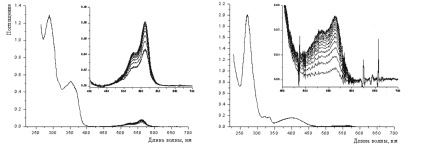
Строение полученного соединения 1 подтверждено данными элементного анализа, ИК, ЯМР 1Н, ЯМР 13С-спектроскопии. Для расшифровки спектров ЯМР 1Н и ЯМР 13С использовался ряд методик двумерной спектроскопии: COSY 1H–1H, HSQC 1Н–13C, HMBC 1Н–13С, HMBC 1H–15N. Корректное отнесение сигналов в спектрах ЯМР 1Н спиропиранов 1 и 2 подтверждают двумерные корреляционные спектры COSY 1H–1H (рис. 2).
а б
Рис. 1. Электронные спектры поглощения спиропирана 1 (а) и его соли 2 (б) (С = 5·10–5 моль⋅л–1, этанол, Т = 297 К) при облучении светом 365 нм (dt = 0,1 c). На вставке показан соответствующий рост длинноволновой полосы поглощения фотоиндуцированных мероцианиновых изомеров в увеличенном масштабе
а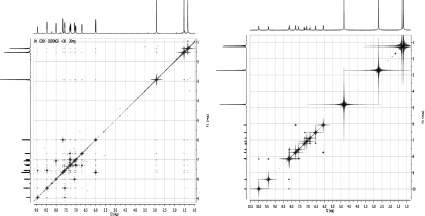 б
б
Рис. 2. Двумерные корреляционные спектры COSY 1H–1H соединения 1(а) и 2 (б)
Для идентификации спектров ЯМР 13С соединений 1 и 2 использовались одноквантовые гетероядерные корреляционные спектры HSQC 1Н–13C (рис. 3).
Для отнесения химических сдвигов атомов углерода, не связанных с атомами водорода, были применены методики гетероядерной корреляции по дальним связям: HMBC 1Н–13С (рис. 4) и HMBC 1H–15N. Корреляционные спектры по дальним связям, с помощью которых были однозначно определены все атомы углерода в молекуле, не связанные с атомами водорода, полностью подтвердили строение полученных соединений 1 и 2. Так, было установлено, что сигналы спиро-атома С-2,3′ при 105,13 и 106,36 м. д. для спиропиранов 1 и 2 полностью соответствует J-константам второго порядка, отображающих взаимодействие атома углерода С-2,3′ с протоном Н-2′, и третьего порядка, показывающих взаимодействие атома углерода С-2,3′ с протонами метильных групп в положении 3, метильной группы при атоме азота и протоном Н-1′.
а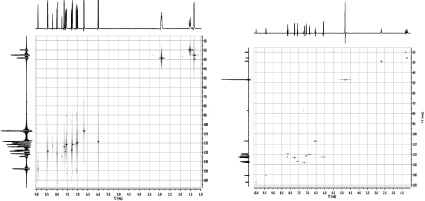 б
б
Рис. 3. Гетероядерные одноквантовые корреляционные спектры HSQC 1Н–13C соединения 1 (а) и 2 (б)
а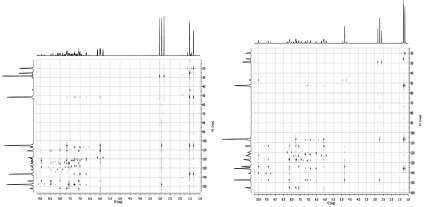 б
б
Рис. 4. Гетероядерные корреляционные спектры по дальним связям HMBC 1Н–13С соединения 1(а) и 2 (б)
Фото- и термохромные спиропираны, содержащие диастереотопные группы, могут быть объектом изучения процесса термоиндуцированной изомеризации методом динамического ЯМР. В спиропиранах 1 и 2 такими группами являются гем-диметильные в положении 3 индолинового фрагмента. Определение констант скоростей и активационных параметров осуществляется с использованием данных температурной зависимости спектров ЯМР обменивающихся диастереотопных групп. В отсутствие обмена в спектрах проявляются два синглетных сигнала неэквивалентных метильных групп, находящихся в положении 3, которые уширяются с увеличением температуры (растет скорость обмена), достигая точки коалесценции. Выражение 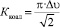 дает значения констант скоростей при температуре коалесценции для обмена между двумя положениями с равной заселенностью, а свободная энергия конверсии закрытой формы спиропиранов ΔG≠ рассчитана по уравнению Эйринга: ΔG≠ = 4,576T(10,32 + lgT – lgk).
дает значения констант скоростей при температуре коалесценции для обмена между двумя положениями с равной заселенностью, а свободная энергия конверсии закрытой формы спиропиранов ΔG≠ рассчитана по уравнению Эйринга: ΔG≠ = 4,576T(10,32 + lgT – lgk).
Динамика полученных соединений изучалась в растворе нитробензола-D5. Данные ЯМР 1Н-спектроскопии при 30 °С подтверждают, что изучаемое соединение 1 находится в спироциклической форме (рис. 5.а). Об этом свидетельствуют два синглетных сигнала от метильных групп в положении 3 индолинового фрагмента при 1,33 и 1,53 м. д. При нагревании пики сигналов протонов метильных групп, характеризующие спироциклическую форму 1 на спектре ЯМР 1Н, начинают «съезжаться», полная коалесценция наступает при 170 °С при 1,48 м. д., что говорит о полной идентичности метильных групп при этой температуре. Это позволяет сделать вывод о том, что при температуре 170 °С исследуемое соединение 1 находится только в мероцианиновой форме. При охлаждении спиропирана 1 до исходной температуры (30 °С) в спектре ЯМР 1Н присутствуют два синглетных сигнала от протонов метильных групп в третьем положении при 1,35 и 1,53 м. д.
В случае соединения 2 (два синглетных сигнала от метильных групп в положении 3 индолинового фрагмента при 1,35 и 1,54 м. д) наблюдается подобная картина (рис. 5, б). Отличие заключается в том, что точка коалесценции достигается при более высокой температуре (180 °С). Данные расчетов приведены в таблице.
а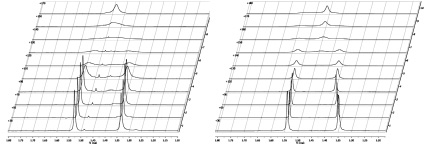 б
б
Рис. 5. Динамика сигналов метильных групп в спектрах ЯМР 1Н в положении 3 соединения 1 (а) и соединения 2 (б) при температурах 30-170 °С (а) и 30-180 °С (б).
Результаты исследования динамики ЯМР-соединений 1 и 2
|
Соединение |
Гем-диметильные группы |
Δν, Гц |
К, с–1 |
Ткоал |
ΔG≠, кДж/моль |
|
|
ν1 |
ν2 |
|||||
|
1 |
798 |
918 |
120 |
267 |
443 |
21,37 |
|
2 |
810 |
924 |
114 |
253 |
453 |
21,92 |
Таким образом, изучение поведения диастереотопных гем-диметильных групп в положении 3 индолинового фрагмента в спектрах ЯМР 1Н при нагревании показало, что в эксперименте достигается точка коалесценции этих сигналов, что дало возможность определить величину свободной энергии конверсии закрытой формы спиропиранов 1 и 2.
Как было нами ранее показано, спиропираны, содержащие π-донорные заместители в бензоядре 2Н-хроменового фрагмента и обладающие фотохромными свойствами в твердой фазе, характеризуются пониженной величиной свободной энергии конверсии закрытой формы спиропиранов, определяемой методом динамического ЯМР 1Н [2]. В связи с тем, что атом азота 2Н-хроменового фрагмента индолиноспирохинолинов может рассматриваться как своеобразный π-донорный заместитель, следует ожидать проявления индолиноспирохинолинами фотохромных свойств в твердой фазе.
Экспериментальная часть
ИК-спектры записаны на спектрометре Varian Excalibrum 3100 FT-IR (методом нарушенного полного внутреннего отражения). Спектры ЯМР 1H записаны на спектрометре Bruker Evance-600 (600 МГц) в импульсном Фурье-режиме в дейтерохлороформе (CDCl3).
Спиро[1,3,3-триметилиндолино-2,3’-[3Н]-пирано[3,2-f]хинолин] 1. К кипящей смеси 2,74 г (0,01 моль) перхлората 1,2,3,3-тетраметилиндоленилия и 1,90 г (0,011 моль) 6-гидроксихинолин-5-альдегида в 15 мл пропанола-2 прибавляют по каплям 1,1 мл (0,013 моль) пиперидина. Реакционную смесь кипятят 15 мин с обратным холодильником и оставляют на ночь при комнатной температуре. Выпавшие кристаллы отфильтровывают и перекристаллизовывают из н-гексана. Выход – 65 %, Tпл = 162 °С. Найдено, %: C 80,32; H 6,23; N 8,47. C22H20N2O. Вычислено, %: C 80,46; H 6,14; N 8,53. ИК спектр, ν, см–1: 1673, 1633, 1593 (С = С). Спектр ЯМР 1H: δ, м. д., (J, Гц): 1,33 (3 Н, с, гем. –СН3); 1,53 (3 Н, с, гем. –СН3); 2,92 (3 Н, с, N–СН3); 6,00 (1 Н, д, J = 10,4, Н-2’); 6,69 (1 Н, д, J = 7,6, Н-7); 7,01 (1 Н, т, J = 7,4, Н-5); 7,07 (1 Н, д, J = 9,0, Н-5’); 7,26 (1 Н, д, J = 7,1 Н-4); 7,30 (1 Н, т, J = 7,6, Н-6); 7,56 (1 Н, дд, JH-8’ = 4.1, JH-10’ = 8,4, Н-9’); 7,66 (1 Н, д, J = 10,4, Н-1’); 8,01 (1 Н, д, J = 9,0, Н-6’); 8,46 (1 Н, д, J = 8,4, Н-10’); 8,94 (1 Н, д, J = 2,9, Н-8’). Спектр ЯМР 13С, δ, м. д.: 19,91 (C-10); 25,40 (C-11); 28,53 (C-12); 51,68 (C-3); 105,13 (C-2,3’); 107,07 (C-7); 110,83 (C-12’); 118,52 (C-2’); 119,60 (C-5); 120,15 (C-5’); 121,61 (C-4); 121,68 (C-9’); 124,13 (C-1’); 124,88 (C-11’); 127,82 (C-6); 128,89 (C-10’); 131,61 (C-6’); 136,71 (C-9); 144,34 (C-14’); 147,82 (C-8’); 148,17 (C-8); 152,49 (C-13’).
Йодид cпиро[1,3,3,7’-тетраметилиндолино-2,3’-[3Н]-пирано[3,2-f]хинолиния] 2. В круглодонной колбе, снабжённой обратным холодильником и хлоркальциевой трубкой, кипятят в течение 3 часов 0,328 г (0,001 моль) спиро(1,3,3-триметилиндолино-2,3′-3Н-пирано[3,2-f]хинолина) и 0,09 мл (0,0015 моль) CH3I в 15 мл абсолютного ацетона. Реакционную смесь оставляют на 2 дня для выпадения осадка, который отфильтровывают и промывают абсолютным ацетоном. Выход – 80 %, Tпл > 250 °С. Найдено, %: C 58,61; H 5,05; N 6,03. C22H20N2O. Вычислено, %: C 58,73; H 4,93; N 5,96. ИК спектр, ν, см–1: 1640, 1605, 1580 (С = С). Спектр ЯМР 1H: δ, м. д., (J, Гц): 1,35 (3 Н, с, гем. –СН3); 1.54 (3 Н, с, гем. –СН3); 2,97 (3 Н, с, N(1)–СН3); 5,02 (3 Н, с, N(7’)–СН3); 6.27 (1 Н, д, J = 10,4, Н-2’); 6,74 (1 Н, д, J = 7,7, Н-7); 7,04 (1 Н, т, J = 7,4, Н-5); 7,29 (1 Н, д, J = 7,2, Н-4); 7,33 (1 Н, т, J = 7,7 Н-6); 7,48 (1 Н, д, J = 9,4, Н-5’); 7,97 (1 Н, д, J = 10,4, Н-1’); 8,36 (1 Н, дд, JH-8’ = 5,8, JH-10’ = 8,5, Н-9’); 8,41 (1 Н, д, J = 9,4, Н-6’); 9,56 (1 Н, д, J = 8,3, Н-10’); 9,77 (1 Н, д, J = 3,0, Н-8’). Спектр ЯМР 13С, δ, м. д.: 20,05 (C-10); 25,67 (C-11); 28,87 (C-12); 46,96 (C-15’); 52,39 (C-3); 106.36 (C-2,3’); 107,02 (C-7); 113.28 (C-12’); 119,43 (C-6’); 120,00 (C-5); 121,51 (C-4); 122,52 (C-9’); 122,59 (C-2’); 123,28 (C-1’); 126,85 (C-11’); 126,89 (C-5’); 127,89 (C-6); 133,82 (C-14’); 135,68 (C-9); 140,64 (C-10’); 147,19 (C- 8’); 147,30 (C-8); 154,93 (C-13’).
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований, грант 13-03-00631.
Рецензенты:
Дубоносов А.Д., д.х.н., ведущий научный сотрудник, ЮНЦ РАН, г. Ростов-на-Дону;
Черныш Ю.Е., д.х.н., профессор, НИИ ФОХ ЮФУ, г. Ростов-на-Дону.
Работа поступила в редакцию 16.12.2013.
Библиографическая ссылка
Халанский К.Н., Лукьянов Б.С., Бородкин Г.С., Ожогин И.В., Лукьянова М.Б. ИЗУЧЕНИЕ СТРОЕНИЯ ИНДОЛИНОСПИРОХИНОЛИНОВ МЕТОДАМИ МНОГОЯДЕРНОЙ И ДИНАМИЧЕСКОЙ СПЕКТРОСКОПИИ ЯМР // Фундаментальные исследования. 2013. № 11-3. С. 456-460;URL: https://fundamental-research.ru/ru/article/view?id=33142 (дата обращения: 02.02.2026).



