Для обеспечения требуемых потребительских свойств металлоизделий в промышленности используются различные виды поверхностных технологических обработок [10–12]. С целью их достижения на практике широко применяются различные способы никелевых покрытий [4, 8].
Нанесение никелевых покрытий химическим способом, как и гальваническое никелирование, сопровождается большими объемами жидких отходов в виде отработанных технологических и промывочных растворов. Ранее авторами [6, 7] был предложен комбинированный способ очистки промывных вод гальванического никелирования, включающий ионообменное извлечение катионов металла с последующим электролизом элюатов. Применение этого способа для обработки промывных вод после химического никелирования в щелочных цитратно-аммиачных растворах с гипофосфитным восстановителем малоэффективно, поскольку металл в них присутствует в виде сложных комплексных ионов неизвестного состава и типа.
Целью данной работы являлось определение состава комплексных ионов Ni (II) в щелочных цитратно-аммиачных растворах и прогнозирование путей повышения эффективности ионообменного и электрохимического их извлечения с повторным использованием металла.
Щелочной раствор химического никелирования имеет состав, г/л: сернокислый никель (NiSO4·7H2O) – 25, гипофосфит натрия (NaH2PO2·H2O) – 25, цитрат натрия (Na3C6H5O7·5,5H2O) – 50, хлорид аммония (NH4Cl) – 25 и гидроксид аммония (NH4OH в виде 25 %-ного водного раствора) до pH 8,5–9,0. Иногда в состав такого раствора вводят до 0,01 г/л стабилизатора (тиомочевины, ХНС-87 и других). В процессе эксплуатации в электролите никелирования накапливается фосфит натрия (NaH2PO3) до 400 г/л [5].
В промывных водах содержатся те же компоненты, но в значительно меньших количествах, а стабилизатор практически отсутствует. Кроме того, как показали предварительные исследования, фосфорсодержащие компоненты в процессах комплексообразования не участвуют, поэтому были исключены из рассмотрения.
Известно, что никель (II) способен образовывать в водных растворах комплексные соединения с солями лимонной кислоты и аммиаком. Наиболее устойчивой во всех случаях является октаэдрическая структура, то есть координационное число никеля (n) равно шести [4, 5]. Для определения состава комплексных соединений металла были рассмотрены системы, в которых Ni (II) присутствует сначала с одним или другим лигандом, а затем с обоими вместе. В качестве таких систем использовали растворы: Ni (II)–Na3Cit–H2O (I), Ni (II)–NH4OH–NH4Cl–H2O (II) и Ni (II)–Na3Cit–NH4OH–NH4Cl–H2O (III), где Cit3– – анион лимонной кислоты. Все измерения проводили на спектрофотометре СФ-26 в кварцевых кюветах с толщиной слоя жидкости 1 см. Измерялась оптическая плотность растворов (D) в зависимости от длины волны (λ) в диапазоне 340–800 нм.
Поскольку приготовление электролита никелирования начинают со смешивания растворов лимоннокислого натрия и сульфата никеля, то в начале анализировали систему (I).
Исследование комплексообразования никеля (II) проводили методом изомолярных серий [6] в растворах с различными суммарными мольными концентрациями Ni(II) и Na3Cit при pH 8,5 и постоянной ионной силе раствора 1,16, поддерживаемой добавлением 1 М раствора сульфата натрия.
На зависимостях D от λ для системы I при различных мольных отношениях Ni (II):Na3Cit (от 1:9 до 9:1) наблюдали по два четко разделенных спектра поглощения с максимумами при длинах волн 395 и 650 нм. Различие в положении максимумов на 260 нм дает основание рассматривать эти зависимости как два самостоятельных спектра, каждому из которых соответствует свое соединение.
Согласно теории метода изомолярных серий, количественный состав комплексных соединений определяли методом касательных [1] к графическим зависимостям D от состава раствора (мольной доли ионов никеля), называемым изомолярными диаграммами, при фиксированных длинах волн, соответствующих максимумам светопоглощения. Установлено, что в обоих случаях никель (II) образует с цитрат-анионами комплексные соединения, в которых мольные отношения Ni (II):Cit3– составляют 1:1. На изомолярных диаграммах, полученных при различных суммарных концентрациях ингредиентов, не наблюдалось смещение максимума. Это свидетельствует о том, что комплексообразование не сопровождается никакими побочными процессами (гидролизом, ассоциацией и другими), а также не происходит образование нескольких комплексных соединений при одной и той же длине волны.
Расчетами, основанными на ионных равновесиях и константах ступенчатой диссоциации лимонной кислоты [9], нами показано, что при pH 8,5 в водном растворе присутствуют только анионы HCit2– и Cit3–, которые способны образовывать комплексные соединения с никелем (II). Повышение pH до 10,0 ведет к снижению концентрации моногидроцитрата и возрастанию содержания цитрат-анионов. Это выражается уменьшением светопоглощения при длине волны 395 нм и его возрастанием при 650 нм. Таким образом был сделан вывод об одновременном присутствии в растворе ионов [Ni(HCit)]– и [NiCit]2– со значительным преобладанием последнего и его светопоглощением в более длинноволновой области. Кроме указанных анионов во внутреннюю координационную сферу комплексов входят молекулы воды (3 и 2 соответственно) для образования устойчивых конфигураций с n = 6 для никеля.
В системе II ионы никеля присутствуют в виде катионных комплексов. Известно [2, 3], что никель (II) способен образовывать с аммиаком шесть различных комплексов вида [Ni(NH3)n]2+ , где n = 1–6. Однако практически эти возможности не всегда реализуются полностью. Состав комплексных катионов зависит от соотношения металла и лиганда, их концентраций, от pH раствора и от наличия хлорида аммония, который ведет к образованию аммиачно-буферной смеси, что существенно ограничивает диапазон pH. Состав комплексных ионов в системе II определяли методом мольных отношений («насыщения») [1]. Постоянной в растворах поддерживалась концентрация никеля (II). Соотношение между металлом и лигандом изменялось от 1:1 до 1:9.
На спектрах поглощения аммиачных комплексов никеля присутствовали два максимума при длинах волн 370 и 580 нм, причем высота этих максимумов изменялась при изменении соотношения металла и лиганда. Построение зависимостей оптической плотности растворов от соотношения NH4OH:Ni (II) при длинах волн максимумов светопоглощения позволили установить, что в области ближнего ультрафиолета формируются комплексные катионы [Ni(NH3)2]2+, а в видимой области (500–700 нм) образуются ионы [Ni(NH3)4]2+.
По-видимому, как и в случае цитратных соединений, при формировании аммиачных комплексов в их внутреннюю координационную сферу включаются молекулы воды до образования наиболее устойчивых конфигураций.
Совместное присутствие в растворе обоих лигандов (система III) приводит также к появлению двух максимумов светопоглощения на спектрах, полученных методом молярных отношений. В качестве примера некоторые спектры представлены на рисунке, а. Они были получены для растворов, приготовленных путем предварительного формирования цитратных комплексов никеля (II) с последующим добавлением аммиака. Мольные отношения цитратных комплексов Ni (II) и аммиака в растворах изменялись от 1:1 до 1:7.
Значения D в максимумах светопоглощения зависели от мольного соотношения компонентов, а сами максимумы наблюдались при тех же длинах волн, что и в случае, когда металл образовывал монолигандные комплексы. Из кривых насыщения (рисунок, б и в) установлено, что в диапазоне длин волн 300–500 нм смешанно-лигандный комплекс имеет состав [Ni(HCit)(NH3)2]–, а в области 500–800 нм [Ni(Cit)(NH3)2]2–. Как и в случае монолигандных комплексов, во внутреннюю координационную сферу однозарядного комплекса для достижения устойчивой структуры входит молекула воды.
а 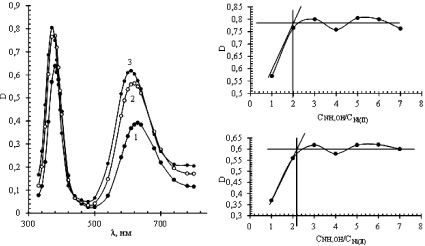 б в
б в
Спектры поглощения (а) и зависимости D от мольного отношения NH4OH:Ni (II) для системы III при длинах волн 370 (б) и 610 нм (в). Концентрации Ni (II), цитрата натрия NH4Cl составляют 0,04; 0,04 и 0,25 М. Мольные отношения Ni (II):NH4OH, М/М: 1 – 1:1; 2 – 1:2; 3 – 1:5
Таким образом, на основе полученных результатов можно сделать вывод о том, что в цитратно-аммиачных растворах никель (II) присутствует в виде смешанно-лигандных комплексов анионного типа [Ni(HCit)(NH3)2(H2O)]– и [Ni(Cit)(NH3)2]2– со значительным преобладанием последнего. Это позволяет дать предварительную оценку эффективности применения ионного обмена и электролиза для извлечения и переработки ионов металла, а также провести прогнозирование путей ее повышения.
Сложная пространственная структура комплексов металла вызывает трудности его ионообменного извлечения. Предварительные исследования авторов показали, что зернистый ионит АВ-17-8 практически не извлекает ионы никеля. Очистка раствора происходит от анионов Cl– , SO42-, и HPO2– , которые более подвижны и обладают более простой пространственной конфигурацией.
Электровосстановление комплексов никеля (II) из отработанных растворов химической металлизации будет сопровождаться повышенной катодной поляризацией (энергозатратами) по сравнению с электроосаждением металла из растворов, содержащих свободные гидратированные ионы Ni2+. Однако повышение энергозатрат не должно быть значительным, поскольку рассматриваемые комплексные соединения обладают низкой хелатностью, под которой понимают наличие в структуре пятичленных циклов, включающих катион металла. В щелочной среде цитратные комплексы никеля (II) содержат только один пятичленный цикл, формирующийся через гидроксидную группу. Добавление аммиака и переход цитратных комплексов в смешанно-лигандные не изменяет хелатности соединений и не повышает энергозатраты на электроосаждение металла. Кроме того, анионный тип комплексов металла будет облегчать их распад в прикатодном пространстве, поскольку поверхность электрода также имеет отрицательный заряд.
Следовательно, при создании технологии извлечения и переработки ионов никеля из жидких отходов щелочной химической металлизации требуется проводить раздельную обработку промывных вод и отработанных растворов. Промывные воды необходимо подвергать предварительной химической обработке растворами кислот для снижения значения pH, приводящего к разрушению комплексов металла с образованием гидратированных катионов никеля. В дальнейшем возможно ионообменное извлечение Ni2+ катионитом, например КУ-2-8 в Na+-форме, с высокими показателями процесса и с последующим электролизом элюатов (после регенерации ионита) с получением чистого металла.
Отработанный раствор, имеющий более высокую концентрацию никеля (II), можно подвергать прямому электролизу для получения чистого металла с последующим снижением pH и ионообменной доочисткой на катионите. Высокий выход по току металла и низкие затраты электроэнергии в ходе электролиза будут обеспечиваться тем, что совместно с электроосаждением при повышенной температуре будет протекать химическое восстановление ионов никеля.
Библиографическая ссылка
Ивашкин Е.Г., Михаленко М.Г., Плохов С.В., Трунова И.Г., Пачурин Г.В. КОМПЛЕКСООБРАЗОВАНИЕ NI (II) В ЩЕЛОЧНЫХ ЦИТРАТНО-АММИАЧНЫХ РАСТВОРАХ // Фундаментальные исследования. – 2016. – № 10-3. – С. 500-503;URL: https://fundamental-research.ru/ru/article/view?id=40884 (дата обращения: 19.04.2024).



