Последние годы характеризуются увеличением частоты встречаемости заболеваний молочных желёз у женщин в период менопаузы [1]. Наибольший удельный вес среди них приходится на гиперпластические процессы, объединённые общим термином «фиброзно-кистозная болезнь», или «мастопатия». В развитых странах каждая 3-я женщина страдает мастопатией [2]. Популяционная частота фиброзно-кистозной мастопатии среди женщин различных возрастных групп составляет 45–65 % [3, 5], а у женщин менопаузального возраста достигает 75 % [6].
По определению ВОЗ, мастопатия является дисгормональным гиперпластическим процессом в молочной железе, который характеризуется широким спектром пролиферативных и регрессивных изменений тканей с ненормальным соотношением эпителиального и соединительного компонентов [8]. Описание структурных изменений при мастопатии у женщин в менопаузе является в научной литературе редкостью, так как активное изучение вопросов этиологии и патогенеза заболевания у данной категории больных, по мнению ряда авторов [1, 6], достоверно не уменьшает заболеваемость раком молочной железы, хотя и является определяющим моментом качества жизни больных. Неоднозначно оценивается роль пролиферативной активности и апоптоза эпителиальных клеток в развитии гиперпластического процесса в молочных железах [9]. Помимо вышеописанного, важность изучения патоморфологических основ развития фиброзно-кистозной болезни также обусловлена тем, что у части пациенток развитие заболевания сопровождается выраженной клинической симптоматикой, снижающей качество жизни. Кроме этого, данная патология является фактором риска для развития злокачественных новообразований молочных желез [1].
Целью данной работы явилась оценка морфофункциональных показателей тканей молочной железы в норме и при наличии гиперпластических процессов доброкачественной природы.
Материалы и методы исследования
Объектом исследования послужили ткани, полученные при секторальной резекции молочных желез от 19 пациенток, оперированных по поводу доброкачественных узловых образований (фиброаденома – 6, пролиферативная форма фиброзно-кистозной болезни – 9, непролиферативная форма фиброзно-кистозной болезни – 4). Подавляющее большинство пациенток (68 %) были в возрасте от 55 до 65 лет. 21 % приходился на возрастную группу от 66 до 80 лет. 2 (11 %) пациентки были старше 80 лет. Критериями исключения из исследования были: прием гормональных средств в течение 6 месяцев и более до оперативного вмешательства, признаки злокачественного поражения железы, воспалительные заболевания молочной железы, сопутствующая патология гениталий. В качестве контроля использовали материал от 7 трупов женщин, по результатам аутопсии не имеющих патологии данного органа, репродуктивной и эндокринной систем. Для гистологических исследований материал подвергали стандартной обработке. Серийные парафиновые срезы окрашивали гематоксилином Майера и эозином. Морфометрический анализ производили с помощью окулярной сетки Автандилова и оценивали относительную площадь (%), занимаемую железистым компонентом, стромой, одиночными протоками, групповыми протоками. Полученные количественные данные обрабатывали статистически. Для обобщения числовых характеристик изучаемых признаков при нормальном распределении данных использовали среднюю арифметическую величину признака (М), стандартную ошибку средней (m). На основании этих показателей из числа наблюдений в группе (n) высчитывали t-коэффициент Стьюдента, а затем определяли p – достоверность различий между средними показателями сравниваемых вариационных рядов. Различия считали достоверными при уровне значимости p ≤ 0,01 [4].
Результаты исследования и их обсуждение
Одной из отличительных черт морфофункциональной характеристики молочной железы женщин менопаузального возраста в норме являлась инволюция железы, выражающаяся в атрофии железистого компонента и замене жировой тканью, на фоне которой встречались единичные дольки. Базальная мембрана выводных протоков в этих участках резко истончена. Эпителиальные клетки разобщены, лежат рыхло, местами не соприкасаясь друг с другом. В гистопрепаратах, полученных от женщин с диспластическими изменениями в молочных железах наблюдали явления атипичной дольковой гиперплазии (рис. 1). Просветы протоков были почти полностью облитерированы. Мелкие темно-окрашенные клетки внутреннего слоя эпителия и более крупные миоэпителиоциты располагались плотно друг к другу, как бы наслаиваясь. Соединительнотканная строма органа была представлена сетью коллагеновых и эластических волокон. В окружающей дольки соединительной ткани встречались опухолеподобные узлы, образованные бесклеточной гиалинизированной фиброзной тканью, что расценивали как очаговый фиброз (рис. 2). Застойных явлений в просвете сосудов (гемостаза, лимфостаза) отмечено не было. Значения морфофункциональных показателей молочных желёз при наличии гиперпластической трансформации и при нормальном строении ткани грудной железы представлены в таблице.
Морфофункциональные параметры молочных желез в норме и при фиброзно-кистозной болезни у женщин менопаузального возраста
|
№ п/п |
Показатель |
Норма М ± m |
Непролиферативная форма фиброзно-кистозной болезни М ± m |
Пролиферативная форма фиброзно-кистозной болезни |
|
1 |
Площадь одиночных протоков |
5,63 ± 0,5 |
4,73 ± 0,78** |
22,1 ± 1,8*,** |
|
2 |
Площадь групп протоков |
8,43 ± 0,87 |
15,7 ± 3,32 |
27,5 ± 5,33* |
|
3 |
Общая площадь протоков |
14 ± 1,06 |
20,4 ± 4,09*,** |
49,7 ± 6,67*,** |
|
4 |
Площадь железистого поля |
19,2 ± 1,53 |
10,5 ± 2,64*,** |
42,4 ± 8,12*,** |
|
5 |
Площадь стромы |
37,2 ± 1,3 |
13,7 ± 1,67*,** |
18,3 ± 3,58*,** |
|
6 |
Плотность сосудов |
3,03 ± 0,79 |
4,4 ± 0,7 |
5,7 ± 1,87 |
|
7 |
Содержание лимфоцитов |
0,61 ± 0,26 |
1,45 ± 0,36** |
6,83 ± 1,1*,** |
|
8 |
Содержание фибробластов |
19,0 ± 1,11* |
72,9 ± 4,48* |
82,9 ± 1,74* |
Примечания: М – средняя арифметическая; m – ошибка средней арифметической; * – различия достоверны (р ≤ 0,01) в сравнении с нормой; ** – различия достоверны (р ≤ 0,01) между двумя формами мастопатии.
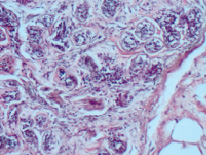
Рис. 1. Атипичная протоковая гиперплазия (×20)
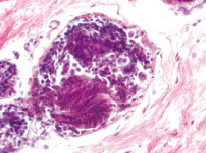
Рис. 2. Очаговый фиброз (×40)
Выводы
Площадь одиночных протоков и общая площадь протоков была достоверно больше (р ≤ 0,01) у женщин с пролиферативной формой фиброзно-кистозной мастопатии, чем в группах с нормальным строением железы и непролиферативной формой болезни. Кроме того, у женщин с пролиферативной формой фиброзной болезни отмечали достоверное увеличение площади железистого поля в 4 раза по сравнению с непролиферативной формой, в 2,2 раза в сопоставлении с нормой. Обращало на себя внимание уменьшение площади соединительнотканной стромы в группах патологии. Значительные изменения претерпевала популяция лимфоцитов. У женщин с явлениями пролиферативной мастопатии их процентное содержание было достоверно выше. Вышеуказанные изменения, вероятнее, свидетельствуют о возможной активации иммунной системы при изучаемых патологических процессах. Кроме того, известно, что по популяционному составу лимфоцитарного вала можно судить о риске злокачественной трансформации [9]. Достоверных различий микроциркуляторного компонента в норме и патологии не было выявлено. Количество фибробластов в группах патологии было значительно выше, чем в тканях интактной железы. Результаты многих исследований доказывают участие фибробластов в патогенезе мастопатии. Благодаря синтезу биологически активных веществ и содействию в сигнальных механизмах межклеточных взаимодействий, они регулируют пролиферативную активность клеток, поддерживают концентрацию гормонов в ткани, нарушение которой ведет к развитию новообразований и возникновению диспластических процессов [8].
Многокомпонентное строение молочной железы, сочетание структур самых разных функциональных направлений обусловливают широкий спектр патологических гистологических форм этого органа. Онкогенез в грудной железе представляет собой сложный многоступенчатый процесс. В результате воздействия физических факторов, химических агентов, эмоционального стресса, гормональной, а также вирусной экспансии в клетке происходят изменения, приводящие к перенапряжению различных биохимических систем. В результате срыва адаптивных механизмов в клетке могут происходить прямые поломки в геноме. Это в свою очередь инициирует процессы изоляции клетки, искажения ее сигнального и генетического аппарата и, как следствие, появляются трансформированные клетки вначале с признаками гиперплазии, а затем дисплазии различной степени тяжести, переходящей в рак in situ [14].
Анализ морфофункциональных особенностей тканей молочной железы у женщин в период менопаузы позволил получить новые данные об изменениях характерных для пролиферативной и непролиферативной форм мастопатии, а также сравнить их с гистологической структурой здоровой железы. Суммируя полученные данные по патоморфологическим изменениям грудной железы у женщин менопаузального возраста с явлениями доброкачественной гиперплазии и без нее, можно сказать, что преобразования на тканевом, клеточном и субклеточном уровнях носят однонаправленный характер и отражают дистрофические и гипертрофические перестройки, происходящие в органе.
Рецензенты:
Абрамзон О.М., д.м.н., профессор кафедры общей хирургии, ГБОУ ВПО «Оренбургский государственный медицинский университет» Минздрава России, г. Оренбург;
Валов С.Д., д.м.н., профессор кафедры гистологии, цитологии и эмбриологии, ГБОУ ВПО «Оренбургский государственный университет» Минздрава России, г. Оренбург.
Библиографическая ссылка
Жирнова А.С., Шевлюк Н.Н., Курлаев П.П. СРАВНИТЕЛЬНЫЙ АНАЛИЗ МОРФОФУНКЦИОНАЛЬНЫХ ХАРАКТЕРИСТИК ТКАНЕЙ МОЛОЧНОЙ ЖЕЛЕЗЫ У ЖЕНЩИН МЕНОПАУЗАЛЬНОГО ВОЗРАСТА В НОРМЕ И ПРИ ГИПЕРПЛАСТИЧЕСКИХ ПРОЦЕССАХ // Фундаментальные исследования. – 2015. – № 1-9. – С. 1827-1830;URL: https://fundamental-research.ru/ru/article/view?id=38434 (дата обращения: 20.04.2024).



