По данным эпидемиологического отчета ВОЗ 2014 г., проблема нарастающей устойчивости к противомикробным препаратам, распространения механизмов множественной резистентности бактерий, вызывающих в том числе инфекции мочевыводящих путей, создает глобальную угрозу для здоровья.
Быструю адаптацию бактерий к изменяющимся условиям внешней среды, возникновение новых патогенных штаммов у ранее непатогенных видов, быстрое распространение множественной устойчивости к антибактериальным препаратам среди клинических штаммов бактерий позволяет объяснить явление горизонтального переноса генов, которое стало известно при изучении геномов организмов с помощью технологии полногеномного секвенирования (WGS) [6; 15].
Значительную долю внутрибольничных инфекций, а также инфекций, ассоциированных с популяцией, вызывают штаммы Staphylococcus aureus, устойчивые к бета-лактамным антибиотикам, приводящие к длительному и тяжелому течению заболевания. Основы формирования бактериологической успешности метициллин-резистентными штаммами (MRSA) в присутствии антибактериального пресса на генетическом уровне активно изучаются. Золотистый стафилококк имеет способность быстро приобретать устойчивость к антибактериальным препаратам за счет приобретения детерминант резистентности, которые изменяют экспрессию или субстратную специфичность генов устойчивости [9; 11].
Колонизация MRSA половых путей беременных женщин, удельный вес которых среди инфицированных S. aureus составляет 24,3–50 %, может приводить к увеличению частоты развития инфекций во время беременности, послеродовых осложнений [1; 2; 10; 16], а также потенциально серьезных последствий для новорожденных [3; 4; 12]. Однако, исследований на уровне генома, оценивающих состав генов вирулентности клинических изолятов MRSA при воспалительных заболеваниях урогенитального тракта при полногеномном секвенировании, не достаточное количество.
Цель исследования – изучить профиль генов вирулентности при полногеномном секвенировании клинического урогенитального изолята MRSA в сравнительном исследовании.
Материалы и методы исследования
У пациентки К., 31 года, при прегравидарной подготовке, с диагнозом хронический цервицит, слизисто-гнойными выделениями из цервикального канала, эрозией шейки матки, с выраженной лейкоцитарной реакцией: 30–40 лейкоцитов / в поле зрения, выделен – метициллин-резистентный изолят S. aureus. Изоляту присвоено название К290-14U. Пациентка неоднократно принимала антибактериальные препараты. Оформление медицинской документации включало наличие информированного согласия пациентки на проведение диагностических и лечебных манипуляций. Отбор отделяемого цервикального канала проводили одноразовыми урогенитальными зондами. Для микробиологического исследования использовали транспортную среду «Amies» (Италия); для исключения облигатных патогенов методом ПЦР – транспортную среду ТСМ (ФБУН «ЦНИИ Эпидемиологии» Роспотребнадзора, Москва). Идентификацию S. aureus проводили методом времяпролетной масс-спектрометрии экстрагированных матриксом белков суточной культуры на анализаторе VITEK MS MALDI-TOF. Чувствительность к антимикробным препаратам (АМП) определяли по минимальной ингибирующей концентрации с использованием карт AST-GP67 и AST-P580, на автоматическом анализаторе VITEK 2 Сompact, согласно инструкции производителя. Для изолята S. аureus K290-14U получен положительный результат скрининга к цефокситину, данные резистентности к бензилпенициллину и оксациллину.
Для исключения облигатных патогенов использовали наборы реагентов с гибридизационно-флуоресцентной детекцией в режиме «реального времени» «АмплиСенс N. gonorrhoeae, C. trachomatis, M. genitalium, T. vaginalis Мультипрайм-FL», (ФБУН «ЦНИИ Эпидемиологии Роспотребнадзора», Москва), в соответствии с инструкцией производителя.
Cеквенирование полного генома клинического урогенитального изолята S. aureus проводили на приборе GS Junior/454 (Roche) с приготовлением библиотек фрагментов ДНК (ShotGun) по стандартному протоколу (Rapid Library) с применением наборов реагентов «GS Junior Titanium Series» (Roche). Средняя длина единичных прочтений высокопроизводительного секвенирования составила 486,6 нуклеотидов, модальная длина распределения ридов – 526 нуклеотидов.
Выбор ближайшего изолята S. aureus для сравнения проводили по гену 16S рибосомальной РНК среди нуклеотидных последовательностей ДНК S. aureus, представленных в базе данных BLAST (http://blast.ncbi.nlm.nih.gov/blast/treeview/tree). На рис. 1 и 2. представлены фрагменты дендрограмм, построенных попарным выравниванием нуклеотидных последовательностей в программе BLAST методами Niehgbor Joining и Мinimum Еvolution, по которым был выбран для сравнения изолят S. aureus XN108 [17].

Рис. 1. Фрагмент дендрограммы штаммов S. аureus, близких к нуклеотидной последовательности гена 16S рРНК исследуемого изолята K290-14U (BLAST/Niehgbor Joining)

Рис. 2. Фрагмент дендрограммы дендрограммы штаммов S. аureus, близких к нуклеотидной последовательности гена 16S рРНК исследуемого изолята K290-14U (BLAST/Мinimum Еvolution)
Характеристика изолятов MRSA в сравнительном исследовании
|
№ п/п |
Название штамма |
Характеристика штамма/заболевание |
Регион |
Размер генома, bp |
Кодирующие последовательности, SDC |
Доля генов, функциональной категории «вирулентность, болезнь и защита» |
Год коллекции/год представления GB |
|
1 |
K290-14U |
MRSA изолят при слизисто-гнойных выделениях из цервикального канала, эрозия шейки матки |
Россия |
2794 869 |
2648 |
3,2 % |
2014/2014 |
|
2 |
XN108 |
MRSA изолят ванкомицин промежуточный, при 90 % поражении кожи |
Китай |
3052 055 |
2981 |
3,5 % |
2004/2014 |
При сопоставлении полногеномной последовательности ДНК изолята K290-14U с базой данных BLAST показатели идентичности геномов с изолятом S. aureus XN108 составили 99 % (при максимальном 99 %), покрытие генома (query cover) – 93 %. Аннотацию геномов проводили с помощью компьютерной программы RAST (Rapid Annotation using Subsystem Technology) version 2,0 (Aziz R.K., 2008).
В урогенитальном изоляте MRSA выявлено 2648 кодирующих последовательностей, распределенных в 398 функциональных подсистемах генов. Полногеномная нуклеотидная последовательность клинического изолята K290-14U депонирована в базу данных GenBank: SUB759581, PRJNA268908, SAMN03246771. Характеристика сравниваемых штаммов S. aureus представлена в таблица.
Результаты исследования и их обсуждение
При клинико-лабораторном обследовании 4143 пациентов консультативного дерматовенерологического приема УрНИИДВиИ встречаемость культивируемых штаммов S. aureus в урогенитальном тракте составила 1,95 %. Фенотипические характеристики MRSA при скрининге с цефокситином проявили 13,3 % клинических изолятов. Отмечена резистентность к бензилпенициллину у 77,8 % штаммов S. aureus, к тетрациклину – 20,0 %, эритромицину – 13,3 %, клиндамицину – 11,1 %, фосфомицину – 8,9 %, рифампицину – 2,2 %. Все штаммы были чувствительны к фторхинолону, линезолиду, ванкомицину, фузидину, мупироцину.
В данной работе представлен анализ профиля генов, отвечающих за вирулентность и устойчивость к АМП урогенитального клинического изолята S. aureus с фенотипическими проявлениями резистентности к метициллину/оксациллину.
При реконструкции метаболической функции генома изолятов K290-14U и XN108 (The SEED Viewer, v. 2,0) у обоих изолятов MRSA совпали 73 аннотированных гена, отвечающих за вирулентность. Гены вирулентности подразделяются по функциям на пять подкатегорий: гены адгезии (n = 21), гены синтеза бактериоцинов (n = 12), гены, обеспечивающие инвазию, внутриклеточную устойчивость (n = 9), гены устойчивости к АМП и токсичным соединениям (n = 24), гены собственных токсинов и суперантигенов. Распределение генов категории вирулентности в пяти подкатегориях представлено на рис. 3.
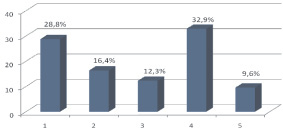
Рис. 3. Распределение генов функциональной категории вирулентности изолятов MRSA K290-14U и XN108: 1 – адгезины; 2 – бактериоцины; 3 – инвазия, внутриклеточная устойчивость; 4 – устойчивость к АМП, токсическим соединениям; 5 – собственные токсины и антигены
Прикрепление S. aureus к молекулам, находящимся на поверхности клеток или во внеклеточном матриксе, – важный этап бактериальной инфекции. Доля совпавших генов изолятов K290-14U и XN108, отвечающих за адгезию, составила 28,8 %. В этой подкатегории аннотировано 19 описанных для S. aureus генов, которые кодируют белки, участвующие в связывании: фибриногена Efb, ClfB (2 гена), фибронектина FnbA, FnbB (2 гена), эластина EbpS (1 ген), фактора Виллебранда VWbp (1 ген) – гликопротеина плазмы крови, обеспечивающего прикрепление рецептора тромбоцитов к субэндотелиальному коллагеновому матриксу поврежденного сосуда; поверхностно-ассоциированного белка А (Spa) (1 ген) – важного компонента клеточной стенки стафилококков, способного связываться с Fc областью иммуноглобулина IgG и фактором Виллебранда [13]; фермент стафилокоагулазу SC (1 ген), вызывающего свертывание крови путем прямой активации протромбина; известных последовательностей С-терминального конца поверхностных белков клеточной стенки бактерий (SasA, SasС, SasD, SasF, SasH) – общего для грамположительных бактерий механизма прикрепления, а также SasG – белка, ответственного за связывание с клетками плоского эпителия слизистой носа (6 генов). Кроме того, ген бифункционального аутолизина Atl (1 ген), который имеет две рамки считывания и участвует в продукции фермента эндогидролиза гликопротеидов и пептидогликана клеточной стенки, при разделении дочерних клеток в конце клеточного цикла и пенициллин-индуцированном аутолизе; белка внеклеточного матрикса Emp (1 ген), внеклеточного белка широкой специфичности связывания Eap/Map (1 ген), адгезина неизвестной специфичности SdrC (1 ген). Также присутствует ген с зоной межгеномной рекомбинации Streptococcus pyogenes, кодирующий белок теплового шока Hsp33, который играет важную роль при укладке в третичную пространственную структуру сложных белков, препятствует нежелательной агрегации, стабилизирует частично свернутые белки и облегчает их транспорт через мембраны внутри клетки, обладает высокой реакционной способностью на изменения окислительно-восстановительной реакции окружающей среды (1 ген). В подкатегории адгезии выявлено 2 гипотетических гена, сходных с фибриногенсвязывающим белком (Efb) и 1 ген с белком, связывающим фактор Виллебранда (VWbp), которые, вероятно, дублируют важные для прикрепления микроорганизма протеины.
Функциональная подкатегория бактериоцины, антибактериальные пептиды составила 16,4 % (12 генов), из них аннотировано 6 генов кластера производства бактериоцинов – специфических белков, подавляющих жизнедеятельность клеток штаммов близких видов бактерий, в том числе 1 ген производства колицина V, продуцируемого Escherichia сoli. Механизм действия бактериоцинов связан с повреждением цитоплазматических мембран только у бактерий, имеющих рецепторы для адсорбции белков, чем определяется узкий спектр активности бактериоцинов, в отличие от антибиотиков; 6 генов функционального кластера ответа на стресс, вызванного бацитрацином – антибиотиком по спектру антимикробной активности близким к пенициллину, который подавляет развитие грамположительных бактерий, включая стафилококки. Бацитрацин в настоящее время используется для наружного лечения заболеваний кожи.
Функциональная подкатегория инвазии и внутриклеточной устойчивости составила 12,3 % и представлена в виде оперона вирулентности Mycobacterium, состоящего из 9 генов, полученного S. aureus в результате горизонтального переноса: участвующих в транскрипции ДНК (2 гена), в синтезе белков L20p, L35p большой субъединицы рибосомы LSU – (3 гена) и белков S12p, S5p малой субъединицы рибосомы SSU – (4 гена). Включение в структуру рибосомы S. aureus белков большой и малой субъединиц от Mycobacterium, возможно, должно приводить к изменению мишени для бактериостатических препаратов, которые действуют на уровне трансляции, нарушают образование комплекса между транспортной РНК и малой субъединицей 30S (мишень для АМП тетрациклинового ряда) и большой субъединицей 50S рибосомы (мишень для макролидов), что способствует повышению эффективности запасного пути синтеза протеинов и выживанию в стрессовых ситуациях.
Подкатегория устойчивости к антибиотикам и токсичным соединениям представлена наибольшим количеством генов (32,9 %). У сравниваемых изолятов S. aureus совпали 24 гена: фермент ß-лактамаза, который путем гидролиза ß-лактамных колец отключает антибактериальные свойства молекулы препарата, обеспечивает устойчивость к антибиотикам (1 ген), угнетатель фермента ß-лактамазы: ß-lactamase repressor (BlaI) (1 ген).
Особое внимание среди механизмов лекарственной устойчивости бактерий заслуживают эффлюкс-системы (насосы) трансмембранного выброса токсичных соединений из клетки, посредством которых микроорганизмы способны уменьшать или подавлять восприимчивость к широкому спектру антимикробных препаратов. Системы экспорта токсичных соединений представлены транспортными белками, АТФ-зависимыми или использующими трансмембранный электрохимический градиент [14]. У изолятов S. aureus выявлены 3 гена множественной лекарственной устойчивости, описанные у грамположительных бактерий: EmrB, кодирующий мембранный белок транспортной системы протеинов семейства MFS (the major facilitator superfamily), полученную от грамотрицательной E. coli (1 ген), белка множественной лекарственной устойчивости, с неуточненной функцией (1 ген), белка TetR – репрессора кластера генов транспортеров тетрациклина из клетки (1 ген). А также гены множественной лекарственной устойчивости эффлюкс-системы: белка системы семейства MATE (the multidrug and toxic compound extrusion) активного выброса антибактериальных препаратов разных классов (аминогликозидов, фторхинолонов, катионных препаратов), основанной на градиенте ионов Na+ (1 ген), белка-транспортера через мембрану акрифлавина, антисептического вещества, используемого в наружных лекарственных средствах (1 ген).
Механизм действия фторхинолонов направлен на важные ферменты бактериальной клетки ДНК-гиразу и топоизомеразу IV. У изолятов S. aureus в подсистеме генов устойчивости к фторхинолонам (4 гена) аннотированы гены субъединиц ДНК-гиразы Gyr A, Gyr B (2 гена), субъединиц топоизомеразы Topo IV (2 гена), основная функция которых – раскручивать супервитки молекулы, разъединять цепи ДНК – подготавливать двухцепочечную молекулу ДНК к репликации и транскрипции. Заимствование у резистентных бактерий мутированных генов позволяет бактериям синтезировать ферменты, устойчивые к действию фторхинолонов. Выявлены гены мембранных белков TcaA, TcaB и регулятора транскрипции TcaR (3 гена), связанных с сопротивлением тейкопланину, антибактериальному гликопептидному препарату с бактерицидным действием одной группы с ванкомицином. Также выявлены гены устойчивости к тяжелым металлам: мышьяку (2 гена), кобальту, цинку, кадмию (3 гена), ртути (3 гена); кроме того, ген сholoylglycine hydrolase фермента гидролиза желчи (1 ген).
В подкатегории токсинов и суперантигенов расшифрованы 7 генов подсистемы двухкомпонентных и порообразующих цитолизинов, факторов вирулентности, позволяющих проникать бактериям в глубь ткани: предшественник α-гемолизина (1 ген), компоненты γ-гемолизина A, B, S (3 гена), IgG-связывающий белок SBI (1 ген), лейкотоксины LukD, LukЕ, приводящие к цитолизу полиморфноядерных лейкоцитов, моноцитов (2 гена).
В нуклеотидной последовательности изолята S. aureus K290-14U не выявлен ген МесА – маркер классической резистентности к метициллину/оксациллину. Фенотипическую резистентность к полусинтетическим ß-лактамным антибиотикам, цефалоспоринам второго поколения изолят S. aureus проявил, очевидно, за счет экспрессии генов мембранных транспортных систем разных семейств, обеспечивающих множественную лекарственную устойчивость.
Кроме описанных генов, для урогенитального изолята S. aureus K290-14U выявлено 3 индивидуальных кодирующих последовательности. В подкатегории устойчивости к антибиотикам и токсичным соединениям выявлен ген, контролирующий трансмембранную диффузию тяжелых металлов. В категории вирулентности аннотирован ген, отвечающий за функцию прикрепления, кодирующий белок SASK С-терминального конца поверхностных белков (1 ген) и ген Pls, с противоположной функцией, кодирующий антиадгезин – поверхностный белок некоторых метициллин-резистентных штаммов S. aureus. Pls может играть важную роль в регуляции адгезии на различных этапах инфекции. Антиадгезин Pls ассоциируется с пониженной бактериальной адгезией к твердой фазе, фибронектину, иммуноглобулину G, со снижением инвазии эпителиальных клеток в культуре. Снижение адгезионных свойств, которые обеспечивает Pls, может быть полезным бактериям для повышения способности распространения в стратегии колонизации новых ниш в пределах одного хозяина. Показано, что ген Pls является фактором вирулентности септического артрита и сепсиса [5; 7, 8].
Выводы
Анализ профиля генов вирулентности при полногеномном секвенировании S. aureus с фенотипической митициллин-резистентностью позволил получить комплексное представление о потенциалах проявления вирулентности клинического изолята, полученного при хроническом воспалительном заболевании урогенитального тракта пациентки репродуктивного возраста, показал наличие генов вирулентности, генов устойчивости к антибактериальным препаратам, а также генов, обеспечивающих механизмы проникновения вглубь тканей и распространения внутри организма – что может приводить не только к воспалительным заболеваниям урогенитального тракта, но иметь потенциальную опасность при течении беременности, родов для матери, серьезных последствий для новорожденного.
Рецензенты:
Глазкова Л.К., д.м.н., профессор кафедры дерматовенерологии, ГБОУ ВПО УГМУ Минздрава России, г. Екатеринбург;
Лысенко О.В., д.м.н., профессор кафедры дерматовенерологии, ГБОУ ВПО ЮУГМУ Минздрава России, г. Челябинск.
Библиографическая ссылка
Герасимова Н.А., Евстигнеева Н.П., Аминева П.Г., Никитина Е.В., Зильберберг Н.В., Кунгуров Н.В. ПРОФИЛЬ ГЕНОВ ВИРУЛЕНТНОСТИ ПРИ ПОЛНОГЕНОМНОМ СЕКВЕНИРОВАНИИ УРОГЕНИТАЛЬНОГО МЕТИЦИЛЛИН-РЕЗИСТЕНТНОГО ШТАММА Staphylococcus aureus // Фундаментальные исследования. – 2015. – № 1-9. – С. 1795-1800;URL: https://fundamental-research.ru/ru/article/view?id=38428 (дата обращения: 20.04.2024).



