Широкое распространение методов вспомогательных репродуктивных технологий и высокий уровень акушерско-гинекологической службы в России и в мире явились причиной того, что беременность и роды на сегодняшний день стали возможными для женщин с тяжелой сопутствующей патологией. Значительный процент беременностей протекает на фоне заболеваний, вызывающих иммунную недостаточность [6]. Ежегодно растет число лиц, инфицированных ВИЧ.
В последние годы, по данным многих исследователей, наблюдается резкое ухудшение состояния здоровья детей и подростков. В Российской Федерации численность абсолютно здоровых детей снизилась до 10 %; 75 % детской популяции относятся к категории часто болеющих детей; 15–20 % имеют хронические заболевания [4]. Несомненно, состояние здоровья матери во время беременности влияет на закладку и созревание органов иммунной системы плода [7, 9]. Однако в доступной нам литературе мы не встретили данных о последствиях патологии иммунного статуса матери для формирования иммунных органов потомства.
Важнейшую роль в обеспечении иммунного ответа играет тимус, функциональная активность которого обусловливает поддержание гомеостаза в организме и обеспечивает стабильность его антигенных структур [2]. В тимусе происходит антигеннезависимая дифференцировка костномозговых предшественников Т-лимфоцитов в иммунокомпетентные клетки [13]. Нарушение процессов позитивной и негативной селекции приводит к развитию Т-клеточного иммунодефицита. Поэтому изучение морфофункционального состояния тимуса у потомства самок с вторичным иммунодефицитом является актуальным и перспективным и в дальнейшем позволит разработать более эффективные методы прогнозирования и профилактики иммунодефицитных состояний у детей.
Цель исследования – оценить морфофункциональное состояние тимуса потомства крыс с вторичным иммунодефицитом через 3 и 6 месяцев после рождения.
Материал и методы исследования
Изучен тимус 70 белых нелинейных крыс-самцов. Животные были получены посредством спаривания 4-месячных крыс-самок с вторичным иммунодефицитом. В качестве модели вторичного иммунодефицита выбрана спленэктомия. Кормление, уход и выведение из эксперимента крыс проводились согласно правилам обращения с лабораторными животными. Животные были разделены на 2 группы. Первая (30 крыс) – потомство здоровых самок. Вторая (40 крыс) – потомство спленэктомированных самок. Тимус забирали через 3 и 6 месяцев после рождения, взвешивали, затем проводили парафиновую заливку и изготавливали срезы толщиной 4 мкм.
Методы исследования:
1. Окраска гематоксилином и эозином – для оценки общегистологической картины и проведения морфометрических измерений коркового и мозгового вещества долек тимуса.
2. Иммуногистохимический метод с использованием моноклональных (МКАТ) и поликлональных антител (ПКАТ) к антигенам крысы фирмы Santa Cruze (США):
а) МКАТ к кластеру дифференцировки 68 типа (CD68) – маркер макрофагов в структурах микроокружения долек тимуса;
б) ПКАТ к белку S-100 – маркер клеток нейроэктодермального происхождения и дендритных клеток;
в) ПКАТ к Synaptophysin – для идентификации клеток нейроэндокринного происхождения, к которым в тимусе относятся клетки APUD серии;
г) МКАТ к Pan-cytokeratin – для неселективной идентификации эпителиальных клеток дольки.
3. Морфометрический метод с использованием программы «Микро-Анализ» (Санкт-Петербург, 2010) для измерения толщины коркового и площади мозгового вещества тимуса, а также количественных характеристик иммуногистохимических реакций.
4. Статистическая обработка полученных цифровых данных с помощью пакета программ Microsoft office (Excel) на компьютере. В работе приводятся следующие показатели: M – средняя арифметическая величина; m – средняя ошибка средней арифметической величины. Статистическую достоверность определяли критерием Стьюдента (t) [5].
Результаты исследования и их обсуждение
При окраске препаратов тимуса интактных крысят в возрасте 3-х месяцев гематоксилином и эозином визуализируются дольки округлой или полигональной формы, разделенные между собой междольковыми перегородками (рис. 1).
Паренхима тимуса образована клетками небольшого размера с плотным округлым ядром, окруженным базофильной цитоплазмой в виде тонкого кольца, – лимфоцитами. В корковом веществе клетки расположены более скученно, что придает ему более темную окраску. Мозговое вещество заполнено тимоцитами в меньшей степени и окрашивается менее насыщенно. При проведении морфометрии установлено, что площадь мозгового вещества дольки составляет 0,43 ± 0,076 мм2, толщина коркового вещества равна 341,2 ± 14,7 мкм.
Дольки тимуса 6-месячных крысят уменьшаются в размерах преимущественно за счёт коркового вещества. Границы между дольками частично стираются. Дольки, расположенные в центре органа, вытягиваются в длину, и форма их приближается к овальной. Площадь мозгового вещества долек равна в среднем 0,59 ± 0,013 мм2, толщина коркового вещества 247,5 ± 19,0 мкм, что в 1,4 раза меньше соответствующих показателей у 3-месячных крысят (p < 0,001).
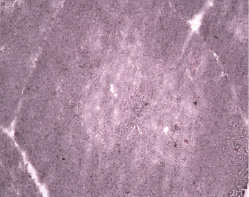
Рис. 1. Тимус. Потомство интактной крысы, 3 месяца. Дольки, разделенные междольковыми перегородками. Окраска гематоксилином и эозином. МИКРОМЕД 3 ЛЮМ. Ув. 100х
Иммуногистохимическая реакция к CD68 использована нами для обнаружения макрофагов. Выявлено, что данные клетки расположены в 1–2 ряда вокруг мозгового вещества дольки, а также встречаются в корковом и мозговом веществе. Число макрофагов увеличивается с возрастом крыс. Так, у 3-месячных крысят в поле зрения определяется 17,5 ± 1,4 клетки, а у 6-месячных крыс их число возрастает более чем в 2 раза и составляет 41,3 ± 5,3 клетки.
Проведение иммуногистохимической реакции к панцитокератину позволило выявить, что число ретикулоэпителиоцитов в тимусе с возрастом меняется незначительно. У потомства интактных крыс на обоих сроках в корковом веществе эпителиоциты занимают около 30 % площади, тогда как в мозговом веществе они расположены на 25 % площади. Однако меняется расположение медуллярных эпителиальных клеток. У интактных крысят в возрасте трех месяцев они равномерно распределены по всей площади мозгового вещества (рис. 2). В возрасте 6-месяцев эпителиоциты концентрируются на периферии ближе к кортико-медуллярной зоне, оставляя центральную часть свободной. Количество синаптофизин-положительных клеток с возрастом почти не изменяется и составляет 5,6 ± 1,2 клетки в поле зрения. Клетки APUD-серии расположены большей частью в кортико-медуллярной зоне, единичные клетки встречаются в корковом и мозговом веществе. S-100+-, дендритные клетки в тимусе 3-месячных крыс обнаруживаются большей частью в мозговом веществе и кортико-медуллярной зоне. Их количество составляет 24,4 ± 2,9 клетки в поле зрения. На сроке 6 месяцев численность дендритных клеток возрастает более чем в 2 раза и равна 53,2 ± 2,7 клетки (p < 0,001).
На основании полученных данных можно заключить, что в тимусе 6-месячных крыс наблюдаются явления возрастной инволюции, проявляющиеся уменьшением основных морфометрических показателей и увеличением численности клеток микроокружения. На наш взгляд, это увеличение является относительным и обусловлено недостаточным поступлением в тимус костномозговых предшественников Т-лимфоцитов и уменьшением размеров дольки.
При исследовании срезов тимуса потомства спленэктомированных крыс в возрасте трех месяцев, окрашенных гематоксилином и эозином, установлено, что большая часть долек имеет округлую или полигональную форму. Встречаются дольки продолговатой формы. Четко определяются границы между дольками. При морфометрии окрашенных срезов выявлено, что размер долек меньше по сравнению с группой потомства интактных крыс на данном сроке. Площадь мозгового вещества и толщина коркового вещества меньше в 1,7 и 1,17 раза соответственно. В возрасте 6 месяцев междольковые септы в тимусе почти не визуализируются. Площадь мозгового вещества увеличена на 32 % по сравнению с группой потомства интактных крыс. На границе коркового и мозгового вещества, в кортико-медуллярной зоне, отмечается повышенная васкуляризация.
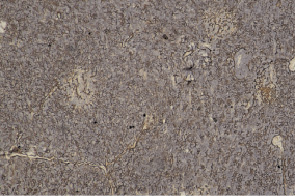
Рис. 2. Тимус. Потомство интактной крысы, 3 месяца. Сетевая организация ретикулоэпителиальных клеток. Иммуногистохимическая реакция к панцитокератину. МИКРОМЕД 3 ЛЮМ. Ув. 100х
Проведение иммуногистохимических реакций позволило выявить, что численность макрофагов и клеток APUD-серии в тимусе потомства самок с вторичным иммунодефицитом в возрасте трех месяцев возрастает и составляет 27,0 ± 7,4 и 15,0 ± 1,9 клетки в поле зрения соответственно (рис. 3).

Рис. 3. Тимус. Потомство спленэктомированной крысы, 3 месяца. Увеличение количества клеток APUD-серии. Иммуногистохимическая реакция к синаптофизину. МИКРОМЕД 3 ЛЮМ. Ув. 400х
Расположение ретикулоэпителиальных клеток в корковом веществе не подвергается изменениям. Однако меняется расположение медуллярных эпителиальных клеток. Они заселяют мозговое вещество не равномерно, а небольшими участками, между которыми находятся пространства, свободные от эпителиоцитов. Доля медуллярных эпителиоцитов снижается и составляет 23,5 ± 1,3 %. В корковом веществе доля эпителиальных клеток, напротив, возрастает на 8 % и равна 38,0 ± 3,2 %. Численность дендритных клеток несколько выше, чем в тимусе потомства интактных крыс, и составляет 29,2 ± 2,6 клеток в поле зрения, что больше на 19,7 % (p < 0,01).
Меньшие по сравнению с группой интактных крыс величины морфометрических показателей и увеличение численности клеток микроокружения свидетельствуют об инволютивных процессах, не столь выраженных у интактных крысят того же возраста.
У 6-месячных крыс этой группы данные о количестве и локализации клеток микроокружения принципиально не отличаются от данных, полученных нами при исследовании тимуса потомства интактных крыс. В поле зрения встречается 36,3 ± 3,4 макрофага, 6,2 ± 1,1 синаптофизин-положительные клетки. Панцитокератин-позитивные клетки визуализируются в корковом и мозговом веществе тимической дольки, однако распределение их неодинаково. Корковые эпителиоциты сохраняют сетевую структуру и занимают 28,7 ± 2,6 % всей площади. Медуллярные эпителиоциты смещаются на периферию мозгового вещества, их доля составляет 25,6 ± 1,2 %.
Заключение
Таким образом, наши исследования показали, что предшествующая беременности спленэктомия отрицательно сказывается на закладке органов иммунной системы плода. Мы полагаем, что в основе этого влияния лежит стойкое увеличение уровня кортизола в крови, выявляемое даже в отдаленные сроки после операции [8]. Доказано, что пренатальный стресс сильно влияет на гомеостаз развивающегося организма [15]. Выделяемые при активации гипоталамо-гипофизарно-надпочечниковой системы глюкокортикоиды, проникая через плаценту, угнетающе действуют на формирование эндокринной, иммунной и нервной систем плода [10, 12]. Аналогичным образом влияют глюкокортикоиды и в неонатальном периоде.
Еще одним немаловажным фактом является недостаточность как гуморального, так и клеточного звеньев иммунитета матери [1, 3]. Известно, что во внутриутробном и неонатальном периодах плод, а впоследствии – новорожденный приобретает пассивный иммунитет от матери. Через плаценту к плоду поступают антитела, продуцируемые В-лимфоцитами матери [14]. После рождения факторы иммунитета продолжают поступать в организм новорожденного вместе с материнским молоком [11]. Недостаточность пассивной иммунизации плода и новорожденного в период незрелости его собственной иммунной системы также, по нашему мнению, является причиной запуска в тимусе патологических процессов.
Рецензенты:
Гунин А.Г., д.м.н., профессор кафедры акушерства и гинекологии, ФГБОУ ВПО «Чувашский государственный университет им. И.Н. Ульянова», г. Чебоксары;
Смелов С.В., д.м.н., доцент кафедры нормальной и топографической анатомии с оперативной хирургией, ФГБОУ ВПО «Чувашский государственный университет им. И.Н. Ульянова», г. Чебоксары.
Библиографическая ссылка
Драндрова Е.Г. ИММУНОФЕНОТИПИРОВАНИЕ КЛЕТОК МИКРООКРУЖЕНИЯ ТИМУСА У ПОТОМСТВА САМОК С ВТОРИЧНЫМ ИММУНОДЕФИЦИТОМ // Фундаментальные исследования. – 2015. – № 1-8. – С. 1571-1575;URL: https://fundamental-research.ru/ru/article/view?id=38250 (дата обращения: 18.04.2024).



