Многие поверхностные и подземные водоисточники характеризуются повышенными концентрациями железа и марганца. Главными источниками появления соединений железа в природных водах являются процессы выветривания, эрозии почв и растворения горных пород. Значительные количества железа поступают с подземными водами, со сточными водами промышленных предприятий и сельскохозяйственных угодий. Глобальный характер приобретает закисление поверхностных и подземных вод из-за выпадения кислых дождей. В кислых водных средах на базе системы Fe2+ – Fe3+–SO42– образуется целый ряд соединений железа, характеризующихся различной растворимостью. В питьевой воде железо может присутствовать также вследствие использования на муниципальных станциях очистки воды железосодержащих коагулянтов, которые применяют для осветления поступающей воды, либо из-за коррозии водопроводных труб [10].
Соединения железа в природной воде могут находиться в растворенном, коллоидном и взвешенном состоянии в зависимости от валентности, а также в виде различных химических соединений. Двухвалентное железо почти всегда находится в воде в растворенном состоянии, трехвалентное – только в случае очень низкого значения pH [2, 8, 10]. В подземных грунтовых водах концентрация железа колеблется в пределах от 0,5 до 50 мг/л. В центральном российском регионе, включая Подмосковье, эта величина изменяется в диапазоне 0,3–10 мг/л, наиболее часто – 3–5 мг/л, в зависимости от географического местоположения и глубины источника [2]. При высоких концентрациях железо негативно влияет на здоровье человека, накапливаясь в печени, способствует разрушению ее клеток, а также вызывает аллергические реакции, которые могут привести к заболеваниям крови [10]. Согласно принятым санитарным нормам [11] концентрация общего железа в водопроводной воде не должна превышать 0,3 мг/л, марганца – 0,1 мг/л, поскольку это тяжелые металлы, и наряду с марганцем, никелем, хромом, мышьяком, кадмием, свинцом и медью относятся к высокотоксическим и долго сохраняющимся в природе веществам. Часто концентрация железа в водопроводной воде превышает норму в 5, 10 и более раз, поэтому проблема обезжелезивания воды стоит особенно остро [7, 10].
Традиционный подход к очистке подземных вод от растворенных форм железа и марганца предусматривает технологическое решение, реализуемое в две стадии: на первой ступени обработки – окисление двухвалентного железа до коллоидного состояния и извлечение его из системы; на второй ступени – последующее окисление в предварительно обезжелезенной воде растворенного марганца и его осаждение в фильтрующей загрузке фильтров. В данной технологии, нашедшей широкое распространение в практике очистки воды, существует необходимость применения реагентов (гипохлорита натрия, перекиси водорода, озона и др.) [1].
Наиболее сильным окислителем, широко используемым на практике, является озон, поскольку может быть использован для обеззараживания, обесцвечивания, дезодорации воды, для удаления соединений железа и марганца. Озон обладает высоким бактерицидным и вирулицидным действием, высокой степенью окисления органических веществ. Озон не придает воде запаха и привкуса. Окислительный потенциал озона – 1,95 В [2, 13, 14].
В технологии озонирования воды основным фактором, влияющим на уровень снижения концентрации тяжелых металлов, является доза озона [7, 8, 14].
Целью работы является установление закономерностей снижения концентрации железа и марганца в железосодержащих водах при окислении озоном для совершенствования технологий водоподготовки.
С помощью озона в сточных водах могут быть окислены неорганические анионы и катионы, среди которых цианиды, нитриты, сульфиды, сульфиты, тиосульфаты, катионы Mn (II), железа (II), Hg (I), мышьяк, алюминий, свинец, никель, хром, медь, кобальт, барий, цинк, кадмий и органические комплексы некоторых из этих металлов.
В процессе воздействия озона двухвалентное железо окисляется до трехвалентного. В трехвалентном состоянии ион железа гидролизует, образуя нерастворимый гидроксид железа [16, 18]:
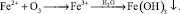
Процесс окисления двухвалентного железа может быть представлен схемой [7, 9]:
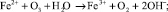
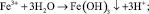
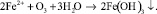
Окисление марганца более сложный процесс. Растворенный в воде двухвалентный марганец в результате контакта с кислородом при низком pH окисляется медленно. При окислении марганец остается в растворе в виде коллоидного гидроксида, который коагулирует в соответствующей среде.
Озонирование иона марганца приводит к образованию нерастворимого диоксида марганца, который осаждается гораздо быстрее гидроксида железа. При продолжении озонирования водных растворов марганца может образовываться ион перманганата, имеющий хорошую растворимость:
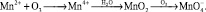
Марганец может также образовывать растворимые комплексы с бикарбонатами и сульфатами. В области pH = 5-7 при воздействии озона имеет место образование четырехвалентной окиси марганца [7, 9, 15, 17]:
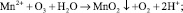
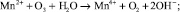
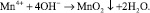
При использовании озона важно контролировать дозу окислителя. Чрезмерные дозы озона, особенно в кислых средах, могут привести к образованию перманганата 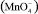 , в соответствии со следующей реакцией:
, в соответствии со следующей реакцией:
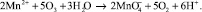
Перманганат – вещество, в котором марганец представлен в своей высшей степени окисления, Mn7+. Теоретическая стехиометрия для проведения реакции составляет 2,2 мг O3/мг Mn2+. Перманганат является нежелательным продуктом реакции в области очистки воды с использованием озонирования. Это вещество с относительно длительным периодом полураспада, определяющее цветность воды. Образовавшийся MnO2, как правило, гидратирует в водной среде в Mn(OH)2 [15, 17].
Стехиометрически доза озона на окисление двухвалентного железа определяется в соответствии с выражением [2]
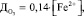
где 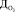 – доза озона, мг/л; [Fe2+] – концентрация двухвалентного железа в исходной воде, мг/л.
– доза озона, мг/л; [Fe2+] – концентрация двухвалентного железа в исходной воде, мг/л.
Согласно СНиП 2.04.02-84* [12] метод обезжелезивания, расчетные параметры и дозы реагентов надлежит принимать на основе результатов технологических изысканий, выполненных непосредственно у источника водоснабжения.
Применение озона позволяет вести процесс деманганации при значениях pH, равных 8,0–8,5. При обработке воды озоном процесс окисления марганца завершается в течение 10–15 минут при значении pH воды 6,5–7,0. Доза озона по стехиометрии составляет 1,45 мг О3 на 1 мг двухвалентного марганца [2]. Согласно исследованиям [7] при озонировании воды происходит практически полное окисление двухвалентного железа и марганца, при удельном расходе озона до 4 мг на 1 мг марганца и 0,12 мг/л на окисление 1 мг железа. Однако при озонировании воды озон подвержен каталитическому разложению оксидами марганца, поэтому доза озона должна быть увеличена. Указанные количества озона для окисления железа и марганца в воде – теоретические. Практически доза О3 зависит от значения pH, времени контакта окислителя с водой, от образующихся отложений, содержания органических веществ, конструкции аппаратов и могут составить увеличение по сравнению с теоретическими количествами озона в 1,5–5 раз [2]. Таким образом, учитывая эколого-экономический аспект озонирования, важной задачей в технологии очистки воды является определение необходимой дозы озона на основе моделирования процессов снижения концентраций железа и марганца.
Экспериментальные исследования по воздействию озона на снижение концентрации ионов железа и марганца для целей очистки подземных вод в городах Салехард, Краснодар, Кемерово, Мегион проводились исследователями под руководством д.т.н., проф. В.Л. Драгинского, д.т.н., проф. В.В. Дзюбо [5–8], а также рядом отечественных и зарубежных ученых [1, 3, 4, 13, 14–18]. Экспериментальные установки состояли из блоков окисления воды озоном и фильтровальных колонок с песчаной и угольной загрузкой. В процессе исследований изменяли дозы озона от 0 до 7 мг/л, pH воды, скорость фильтрования [7, 8]. При озонировании воды эффективность удаления железа зависит от дозы озона: чем выше доза озона, тем меньше остаточная концентрация железа в очищенной воде. При небольших концентрациях двухвалентного железа (до 7 мг/л) полное его окисление достигается при дозе озона 0,6 мг/л; при более высоких концентрациях (до 15 мг/л и более) необходимая доза озона составляла 1,7–2,5 мг/л. На глубину очистки воды от железа также влияет время контакта воды с озоном. При использовании озона и последующем фильтровании через песчаный фильтр в экспериментальных исследованиях [7] обеспечивалось снижение концентрации железа до 0,3 мг/л при дозе озона 1 мг/л. Результаты эксперимента представлены в таблице.
При построении математической модели, связывающей уровень снижения концентрации железа в воде с дозой озона по экспериментальным данным (таблица), воспользуемся экспоненциальным уравнением вида
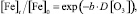 (1)
(1)
где [Fe]t – концентрация железа на момент окончания озонирования (остаточная концентрация), мг/л; [Fe]0 – начальная концентрация железа, мг/л; b – оцениваемый параметр модели; D[O3] – доза озона, мг/л.
Изменение концентрации железа и марганца при очистке воды [7]
|
Доза озона, мг/л |
Концентрация загрязнителей, мг/л |
|||
|
До фильтрования |
После фильтрования |
|||
|
Feобщ |
Mn |
Feобщ |
Mn |
|
|
0 |
1,2 |
0,3 |
1,2 |
0,3 |
|
0,9 |
1,2 |
0,27 |
0,32 |
0,29 |
|
1,8 |
1,15 |
0,29 |
0,26 |
0,23 |
|
3,0 |
1,07 |
0,23 |
0,12 |
0,04 |
|
4,0 |
1,08 |
0,19 |
0,07 |
0,04 |
|
5,0 |
1,06 |
0,17 |
0,06 |
0,02 |
|
6,0 |
1,0 |
0,15 |
0 |
0 |
В программной среде Statistica 6.1 алгоритмом Левенберга – Марквардта с использованием метода наименьших квадратов идентифицировано выражение вида (1), устанавливающее зависимость снижения концентрации железа в водной среде от дозы озона:
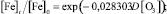 (2)
(2)
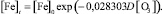
Статистическая значимость модели (2) подтверждается на уровне α = 0,01 высоким коэффициентом множественной корреляции R = 0,9618, уровень доли объясненной дисперсии 0,925. Расчетное значение критерия Фишера F(1,6) = 19821,65 превышающее критическое значение – Fкр(0,01; 1,6) = 13,745, подтверждает значимость коэффициента множественной корреляции R на уровне α = 0,01. Адекватность параметра модели b = 0,028303 проверялась с использованием t-критерия Стьюдента. Расчетное значение t-критерия для параметра b составляет t{b} = 13,47. Расчетное значение t-критерия Стьюдента превышает критическое значение tкр(0,01; 6) = 3,143, чем подтверждает значимость полученной оценки параметра b на уровне α = 0,01. Стандартная ошибка оценки составляет Sterr{b} = 0,002101, что также является показателем надежности рассчитанного параметра. Определен 99 %-й доверительный интервал для параметра b: (0,020513; 0,036094). Полученная оценка параметра b принадлежит 99 %-му доверительному интервалу, что отражает надежность и адекватность полученного значения 0,028303.
По аналогии с моделью (1) установлена зависимость снижения концентрации марганца от дозы озона:
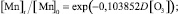 (3)
(3)
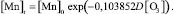
Статистическая значимость модели (3) подтверждается на уровне α = 0,01 высоким коэффициентом множественной корреляции R = 0,9512, уровень объясненной доли дисперсии 0,9048. Расчетное значение критерия Фишера F(1,6) = 1119,709, превышающее критическое значение – Fкр(0,01; 1,6) = 13,745, определяет значимость коэффициента множественной корреляции на уровне α = 0,01.
Адекватность параметра модели b = 0,103852 также проверялась с использованием t-критерия Стьюдента. Расчетное значение t-критерия t{b} = 9,778731 превышает критическое значение tкр(0,01; 6) = 3,143, чем подтверждает значимость полученной оценки параметра b на уровне α = 0,01. Стандартная ошибка оценки, определенная на уровне Sterr{b} = 0,01062, является показателем надежности рассчитанного параметра. Определен 99 %-й доверительный интервал для параметра b: (0,064479; 0,143226). Полученная оценка параметра b принадлежит 99 %-му доверительному интервалу, что отражает надежность и адекватность полученного значения 0,103852.
Зависимости снижения концентраций железа и марганца в соответствии с моделями (2, 3) приведены на рис. 1, 2.
Доза озона зависит от назначения озонированной воды. Если озон вводят только для обеззараживания в фильтрованную воду (после её предварительного коагулирования и осветления), то дозу озона принимают 1–3 мг/л, для подземной воды – 0,75–1 мг/л, при введении озона для обесцвечивания и обеззараживания загрязненной воды доза озона может доходить до 5 мг/л. Продолжительность контакта обеззараживаемой воды с озоном – 8–12 мин [2].
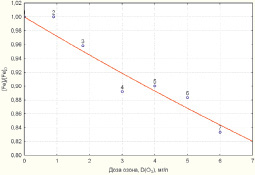
Рис. 1. Зависимость снижения уровня концентрации железа от дозы озона
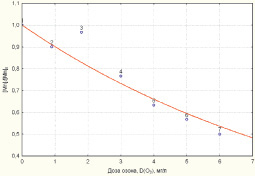
Рис. 2. Зависимость снижения уровня концентрации марганца от дозы озона
Полученные математические зависимости, отражающие связь дозы озона с уровнем снижения концентрации железа и марганца в обрабатываемой воде, направлены на определение дозы, необходимой для очистки железосодержащих вод, с различным содержанием тяжелых металлов. Установление дозы озона для снижения концентрации железа и марганца до требуемого уровня в воде с разным количественным составом загрязнителей позволит повысить эффективность процесса водоочистки и оптимизировать затраты на технологию озонирования.
Рецензенты:
Субботина Т.И., д.м.н., доцент, заведующая кафедрой «Общая патология», Медицинский институт, ФГБОУ ВО «Тульский государственный университет», г. Тула;
Радченко С.А., д.т.н., доцент, профессор кафедры технологии и сервиса, ФГБОУ ВПО «Тульский государственный педагогический университет им. Л.Н. Толстого», г. Тула.
Библиографическая ссылка
Шейнкман Л.Э., Дергунов Д.В., Савинова Л.Н., Четверикова А.Е. УСТАНОВЛЕНИЕ ЗАКОНОМЕРНОСТЕЙ СНИЖЕНИЯ КОНЦЕНТРАЦИИ ЖЕЛЕЗА И МАРГАНЦА В ЖЕЛЕЗОСОДЕРЖАЩИХ ВОДАХ ПРИ ОКИСЛЕНИИ ОЗОНОМ ДЛЯ СОВЕРШЕНСТВОВАНИЯ ТЕХНОЛОГИЙ ВОДОПОДГОТОВКИ // Фундаментальные исследования. – 2015. – № 5-2. – С. 345-350;URL: https://fundamental-research.ru/ru/article/view?id=38220 (дата обращения: 18.04.2024).



