Ожоговые раны в настоящее время являются проблемой здравоохранения как часто встречающиеся и имеющие отягчающий характер при комбинированной травме (Будкевич Л.И. и соавт., 2013). При лечении ожогов применяется комплексная терапия, включающая использование антибиотиков и местных перевязочных средств. Массированное применение антибиотиков привело к возникновению антибиотикорезистентной микрофлоры, что затрудняет лечение ран (Lansdown A.B.G., 2007). Побочным эффектом антибиотикотерапии является воздействие на иммунную систему, что приводит к хронизации инфекции или ее рецидивированию, в свою очередь это диктует необходимость использования средств иммуноориентированной терапии (Булыгин Г.В. и соавт., 2010). Для местного лечения ожоговых ран предложено множество раневых покрытий и различных препаратов, среди них хорошо зарекомендовал себя обогащенный цеолит в сочетании с иммунным препаратом ронколейкин (Паничев А.М. и соавт., 2004; Крюкова В.В., 2005). В настоящее время предпочтение в лечении ран различного генеза отдается биологическим покрытиям (Guthrie K.M., et al. 2012), среди которых в эксперименте и клинике успешно используется препарат Пепидол-ПЭГ, представляющий собой 3 %-й раствор пектина (Чумаков П.А., 2006).
Контроль за течением раневого процесса осуществляется исследованием раневого экссудата как одного из важных элементов течения раневого процесса и, по мнению авторов, являющегося недостаточно используемым ресурсом (Widgerow A.D. et al., 2014). Клеточный состав экссудата и цитохимическая характеристика его компонентов отражают интегральную динамику гнойного воспаления и могут быть использованы для контроля за его течением. Не менее важным критерием для оценки тяжести раневого процесса является состояние микробицидных систем периферической крови, в частности, ее неспецифического звена в виде системы нейтрофильных гранулоцитов, которые, мигрируя в ткани, принимают непосредственное участие в «килинге» бактерий, а также выполняют сложные регуляторные функции на клеточном и тканевом уровне. Значимость данной проблемы существенно возрастает в условиях лечения ожоговых ран.
Материалом для нашего исследования послужили мазки венозной крови и отпечатки раневого экссудата, полученные от 20 крыс-самцов линии «Вистар» весом 180–200 г, у которых в области мягких тканей спины создавалась модель ожоговой раны глубиной IIIА степени. Лечение ожоговой раны после отторжения ожогового струпа выполнялось 5 %-м гелем свекловичного пектина с аминофталгидразидом. Группу сравнения составили также 20 крыс-самцов линии «Вистар» весом 180–200 г, которым после отторжения струпа рану лечили мазью левомеколь. В цитоплазме нейтрофильных гранулоцитов определяли содержание катионного белка по В.М. Пигаревскому (1979) и активность миелопероксидазы по Sato и Sekla в модификации И.В. Нестеровой (1996). Учет результатов осуществляли полуколичественным методом Астальди и Верга (1957). Результаты обрабатывали методами вариационной статистики на ЭВМ с помощью программы «Статистика 6».
Исследование содержания катионного белка в цитоплазме нейтрофильных гранулоцитов периферической крови экспериментальных животных до создания модели ожоговой раны показало, что оно колеблется от 2,04 до 2,4 усл. ед., составляя в среднем 2,22 ± 0,18 усл. ед.
Содержание катионного белка в нейтрофильных гранулоцитах периферической крови животных с моделью ожоговой раны в первые сутки лечения было несколько снижено по сравнению с аналогичными данными, характерными для животных контрольной группы. При этом оно составило в группе сравнения 1,87 ± 0,13 усл. ед. и 1,78 ± 0,14 усл. ед. у животных, леченых с использованием 5 %-го геля пектина в комплексе с аминофталгидразидом. Следует отметить, что эти показатели не имели статистически значимых отличий, как между собой, так и по сравнению с нейтрофильными гранулоцитамии здоровых животных (P > 0,05).
Через трое суток после отторжения струпа и появления выраженных гнойно-воспалительных проявлений содержание катионного белка у контрольных животных составило 87 % от исходного уровня и 71 % от уровня контроля, при этом отличие от контроля являлось статистически значимым (P < 0,01).
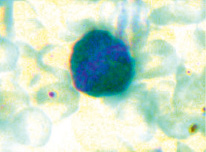
Рис. 1. Типичное распределение катионного белка в цитоплазме НГ (окраска по Пигаревскому. 100х10)
При использовании 5 %-го геля пектина в комплексе с аминофталгидразидом снижение содержания катионного белка было более существенным. Так, по сравнению с контролем его содержание составило 42 % (Р < 0,001), а по сравнению с исходным уровнем его количество снизилось до 72 % (P < 0,01).
На пятые сутки лечения содержание катионного белка нейтрофилов периферической крови в контрольной группе практически вернулось к исходному уровню и составило 1,79 ± 0,16 усл. ед. В условиях применения 5 %-го геля пектина в комплексе с аминофталгидразидом содержание катионного белка нейтрофилов продолжало оставаться пониженным, как относительно контроля, так и относительно исходного уровня, хотя и несколько возросло относительно предыдущего срока исследования.
На десятые сутки лечения наблюдался рост содержания катионного белка нейтрофильных гранулоцитов периферической крови, который в контрольной группе практически достиг уровня контроля, а при использовании 5 %-го геля пектина в комплексе с аминофталгидразидом оставалось лишь незначительно сниженным.
Аналогичное исследование, проведенное в отношении нейтрофильных гранулоцитов раневого экссудата, показало, что в первые сутки после отторжения ожогового струпа в экспериментальной ране лабораторных животных содержание катионного белка нейтрофильных лейкоцитов контрольной группы составило 1,66 ± 0,14 усл. ед., к концу третьих суток оно умеренно снизилось до уровня 1,41 ± 0,14 усл. ед., а к седьмым суткам оказалось на уровне 1,33 ± 0,13 усл. ед. Отсутствие достаточного числа нейтрофильных гранулоцитов в экссудате, полученном из раны на 10-е сутки, не позволило проследить дальнейшую динамику содержания катионного белка.
У животных, получавших лечение с использованием 5 %-го геля пектина в комплексе с аминофталгидразидом, содержание катионного белка нейтрофильных гранулоцитов раневого экссудата в первые сутки после начала лечения составило 1,46 ± 0,12 усл. ед., к третьим суткам оно достоверно снизилось до уровня 1,11 ± 0,12 усл. ед. (P < 0,05), а к седьмым суткам от начала эксперимента содержание катионного белка практически не изменилось.
Анализ уровня активности миелопероксидазы нейтрофильных гранулоцитов периферической крови экспериментальных животных до создания модели ожоговой раны показал, что она регистрируется в пределах от 1,9 усл. ед. до 2,26 усл. ед., составляя в среднем 2,03 ± 0,13 усл. ед. В цитоплазме нейтрофильных гранулоцитов животных контрольной группы с моделью ожоговой раны в первые сутки после отторжения струпа средняя активность миелопероксидазы составляла 2,45 ± 0,19 усл. ед., что на 21 % превышало аналогичные значения, характерные для контрольной группы животных. Следует отметить, что данное увеличение не являлось статистически значимым (P > 0,05). В группе лабораторных животных, получавших лечение с использованием 5 %-го геля пектина в комплексе с аминофталгидразидом, уровень активности миелопероксидазы нейтрофильных гранулоцитов в первые сутки после отторжения ожогового струпа практически не отличался от зарегистрированного для животных контрольной группы и равнялся в среднем 2,22 ± 0,15 усл. ед. (P > 0,05).
Через трое суток после отторжения ожогового струпа у животных контрольной группы активность миелопероксидазы снизилась на 18 % по отношению к уровню активности данного фермента, характерного для здоровых животных, и на 31 % по отношению к исходному уровню. В обоих случаях данное снижение являлось статистически значимым (Р < 0,05 и P < 0,001 соответственно). Животные, леченые с использованием 5 %-го геля пектина в комплексе с аминофталгидразидом, обнаружили аналогичную динамику активности миелопероксидазы нейтрофильных гранулоцитов. Ее уровень снизился на 24 % по отношению к контролю и на 31 % – по отношению к исходному уровню (P < 0,01 и P < 0,001 соответственно). В дальнейшем в обеих группах обследованных животных наблюдался постепенный рост активности миелопероксидазы нейтрофильных лейкоцитов, который к седьмым суткам лечения достиг значений, практически не отличающихся от значений, характерных для здоровых животных.
Нейтрофильные гранулоциты экссудата в обеих группах лабораторных животных обнаружили динамику активности миелопероксидазы, характеризующуюся тенденцией к постепенному снижению при весьма низком ее исходном уровне. Следует отметить, что статистически значимых различий в активности миелопероксидазы нейтрофильных гранулоцитов экссудата как между группами лабораторных животных, так и между сроками исследования, зарегистрировано не было (P > 0,05).
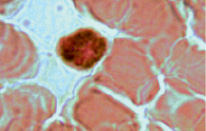
Рис. 2. Типичное распределение миелопероксидазы в цитоплазме НГ (окраска по Сато 100х10)
Таким образом, цитохимические исследования кислородзависимой и кислороднезависимой микробицидных систем нейтрофильных гранулоцитов периферической крови и раневого экссудата экспериментальных ожоговых ран позволяют строго количественно оценить биологическую активность этих клеток и послужить основой для разработки методов диагностики и контроля за течением раневого процесса. Применение 5 %-го геля пектина в комплексе с аминофталгидразидом при лечении экспериментальной ожоговой раны создает условия для активации неспецифического звена иммунной системы и оказывает благоприятное влияние на течение раневого процесса.
Рецензенты:
Курзанов А.Н., д.м.н., профессор, ГБОУ ВПО «Кубанский государственный медицинский университет» Минздрава России, г. Краснодар;
Артюшкова Е.Б., д.б.н., директор НИИ экологической медицины, ГБОУ ВПО «Курский государственный медицинский университет» Минздрава России, г. Краснодар.
Библиографическая ссылка
Хуранов А.А., Евглевский А.А., Павленко С.Г. ОСОБЕННОСТИ МИКРОБИЦИДНЫХ СИСТЕМ НЕЙТРОФИЛЬНЫХ ГРАНУЛОЦИТОВ В УСЛОВИЯХ ЛЕЧЕНИЯ ЭКСПЕРИМЕНТАЛЬНЫХ ОЖОГОВЫХ РАН С ИСПОЛЬЗОВАНИЕМ 5 % ГЕЛЯ ПЕКТИНА В КОМПЛЕКСЕ С АМИНОФТАЛГИДРАЗИДОМ // Фундаментальные исследования. – 2015. – № 1-7. – С. 1472-1475;URL: https://fundamental-research.ru/ru/article/view?id=37994 (дата обращения: 18.04.2024).



