Адаптация как медицинский термин, характеризующий функциональное состояние организма, используется с начала ХХ века. Длительное время изучение адаптации осуществлялось в рамках фундаментальных научных исследований [1, 2]. В клиническую практику теория адаптации пришла в связи с развитием в 70-е годы прошлого века научного направления – космической медицины [3, 4, 5]. Именно в этой области, когда по условиям эксперимента требовалось оценить не только текущее состояние организма, но и представить – как поведут себя основные регулирующие системы в меняющихся условиях внешней среды, зародились основы современного научного прогнозирования.
Адаптация – такая же функция живого организма, как дыхание, пищеварение, кровообращение и др., однако в течение многих лет оценка состояния индивидуальных резервов адаптации не находила применения в клинических исследованиях. Причин для этого несколько, но основная – в том, что в практике клинических научных исследований традиционно принято оценивать показатели, характеризующие степень нарушения или утраты функции органа или системы, а не сохранности их. Принципиальное изменение подхода отличает новое (экспертно-реабилитационное) направление в современной медицине, получившее на сегодняшний день гораздо большее развитие за рубежом, чем в России [6].
С появлением реабилитационного направления появилось и сближение позиций западной (системно-диагностической) и восточной медицины, отличительной особенностью которой является диагностический подход с восприятием организма как единого целого. Как представителям отечественной научной школы нам ближе традиционный подход с клинико-морфологической и функциональной оценкой состояния отдельных систем организма, но также прогрессивным представляется и отношение к человеку как к сложной многоуровневой, но единой системе, традиционно принятое последователями восточной медицины. Адаптация как физиологическая функция, наиболее полно позволяет оценить состояние системных механизмов регуляции и обеспечить так называемый надсистемный и вненозологический подход к исследованию человека.
Еще одна важная проблема для изучения резервов адаптации в клинических исследованиях – отсутствие до недавнего времени количественных критериев оценки, удовлетворяющих условиям доказательной медицины. Оценка резервов адаптации – базовая основа для определения сохранности реабилитационных механизмов. Внедрение в практику таких категорий оценки состояния организма, как реабилитационный потенциал (РП) и реабилитационный прогноз (РПр), – основных показателей экспертно-реабилитационной диагностики – сдерживается недостаточно объективным подходом к их определению (уровень экспертных оценок) [7]. Научное направление, получившее название экспертно-реабилитационная диагностика, в разработке которого и мы принимали участие в последние годы, на сегодняшний день уже располагает объективными количественными методами оценки реабилитационных резервов организма, которые и были положены в основу настоящего исследования.
Цель работы – клинико-функциональная оценка резервов адаптации, состояния регуляторных механизмов и реабилитационных возможностей организма в прогнозировании риска развития сердечно-сосудистой патологии у больных с метаболическими нарушениями.
Материал и методы исследования
Обследовано 143 человека. На начало исследования у всех пациентов, несмотря на то, что 100 % пациентов получали гипотензивную терапию, уровень нормального артериального давления (нормодипия) достигнут не был.
Были сформированы две группы наблюдения и 1 группа сравнения. Группа наблюдения «1» – пациенты с артериальной гипертонией (АГ) и нормальной массой тела (индекс массы тела – ИМТ < 25), средний возраст – 49 ± 1,9 лет (19 чел.). Группа наблюдения «2» – пациенты с метаболическим синдромом (ИМТ > 25; индекс инсулинорезистентности HOMA > 2,5), средний возраст – 50 ± 1,7 (35 чел.). Группа сравнения (группа 3) – 66 пациентов с диагностированным сахарным диабетом – СД 2 типа, условно распределенных в три подгруппы: «3а» – пациенты с СД 2 типа с АГ c ИМТ < 25; индекс HOMA < 2,5 (15 чел.), средний возраст – 54 ± 1,3 лет; «3б» – пациенты с СД 2 типа с АГ c ИМТ > 25; индекс HOMA > 2,5 (44 чел.), средний возраст – 52 ± 0,6 лет; «3в» – пациенты с СД 2 типа без сердечно-сосудистой патологии c ИМТ > 25; индекс HOMA > 2,5 (7 чел.), средний возраст – 51 ± 1,8 лет. Дислипидемия на начало исследования была отмечена у всех больных с метаболическим синдромом и сахарным диабетом 2 типа.
Основная концептуальная идея исследования заключалась в том, чтобы проследить состояние адаптации у пациентов на этапах нарушений углеводного обмена, начиная с группы пациентов, которые не имели метаболических нарушений в качестве первопричины заболевания (группа 1). Далее, на доклиническом этапе первичной инсулинорезистентности (пациенты, имеющие абдоминальное ожирение, АГ, дислипидемию, что в современной литературе чаще называют термином «метаболический синдром» (МС) – группа 2 и, наконец, на стадии клинически выраженных нарушений – манифестном сахарном диабете (группы 3б и 3в) (рис. 1). Группа 3а включала пациентов с СД и АГ, но с нормальной массой тела без явлений инсулинорезистентности на момент взятия под наблюдение (инсулин эндогенный на нижней границе нормы или ниже), т.о. служила группой сравнения для группы 1. Именно такой подход позволил нам оценить влияние метаболических нарушений непосредственно на состояние адаптационных механизмов и состояние резервов адаптации.
Критерии компенсации диабета и риск развития поздних осложнений сахарного диабета типа 2 определяли по критериям European Diabetes Policy Group. Оценка состояния вегетативной регуляции производилась методами суточного мониторинга ЭКГ и АД. Ведущим методом была оценка суточной вариабельности сердечного ритма на системе «Валента», оснащенной программой для компьютерной обработки показателей спектрального анализа: TF, HF, LF, VLF, ULF, LF/HF, HF (%), LF (%), VLF(%), ULF(%), ИЦ и показателей временного анализа: SDNN, SDANN, pNN50. Суточный мониторинг артериального давления (СМАД) проводился на системе «BР LAB»
(Н. Новгород). Методика суточного мониторирования АД (СМАД) включала определение основных индексов: средние значения АД; оценка среднеинтегральных показателей; вариабельности, индексов нагрузки давлением – индекс времени и индекс площади, степень ночного снижения АД (СНСАД) для систолического и диастолического АД. Оценка показателей СМАД производилась по общепринятой методике – по усредненным величинам систолического, диастолического, среднего, пульсового АД и ЧСС за сутки, день и ночь, согласно классификации уровня гипертонии при проведении СМАД (по данным программы DABL®).
Диагноз автономной кардиальной нейропатии устанавливался с участием диабетолога и невролога на основании клинических проявлений (нарушение в работе сердечно-сосудистой системы – постоянная тахикардия – слабая реакция на лекарственные препараты; снижение вариации R-R интервалов; ортостатическая гипотония), кардиоваскулярных тестов (ортопроба, проба с изометрической нагрузкой, по показаниям велоэргометрия).
Оценка реабилитационного потенциала (РП) и реабилитационного прогноза (РПр) производились методами определения: показателя адаптационного соответствия (ПАС) (патент на изобретение № 2342900 «Способ оценки функциональных резервов организма»). Пациентам с СД 2 типа и кардиальной автономной нейропатией вычислялся морфофункциональный индекс (МФИ) (патент на изобретение № 2344751 «Способ определения биологической составляющей реабилитационного потенциала больных сахарным диабетом») с помощью автоматизированной оценки (свидетельства об официальной регистрации № 2007614560 и 2007613898).Статистическая обработка полученных данных была проведена с использованием пакета прикладных программ statistica (StatSoft Inc. версия 6.0, USA).
Результаты исследования
и их обсуждение
В представленных группах были выявлены значительные изменения вариабельности сердечного ритма у пациентов на разных этапах нарушений углеводного обмена. Достоверные изменения показателей выявлены в параметрах минимальной ЧСС днем и максимальной ЧСС ночью (табл. 1).
Таблица 1
Показатели динамики ЧСС в клинических группах
|
Показатель |
Группа наблюдения |
Группа сравнения |
|||
|
1 |
2 |
3а |
3б |
3в |
|
|
ЧСС д/мин |
53,52 ± 2,94 |
62,95 ± 3,99 |
65,84 ± 3,30 |
68,02 ± 1,60 |
66,81 ± 3,65 |
|
Р |
р1 < 0,001; р2 < 0,001; р3 < 0,05; р4 < 0,001 |
||||
|
ЧСС н/макс |
105,19 ± 9,34 |
122,01 ± 6,95 |
94,87 ± 7,12 |
99,55 ± 3,02 |
115,83 ± 9,58 |
|
Р |
р1 < 0,05; р2 < 0,001; р3 = 0,056; р4 < 0,001 |
||||
Примечания: р1 – достоверность разницы в группах 1 и 3а; р2 – достоверность разницы в группах 2 и 3б; р3 – достоверность разницы в группах 2 и 3в; р4 – достоверность разницы в группах 1 и 2.
Наиболее низкие значения минимальной ЧСС днем (53,52 ± 2,94) и ночью (46,93 ± 1,84) наблюдались у пациентов 1 группы и позволяли характеризовать изменения у большинства наблюдаемых как синусовую брадикардию. Однако мы принимаем во внимание, что почти 70 % пациентов этой группы получали β-блокаторы. Однако и пациенты с СД 2 типа препараты из группы β-блокаторов также принимали (метопролол), возможно, более высокий показатель ЧСС у пациентов с АГ на фоне сахарного диабета 2 типа обусловлен вегетативной автономной нейропатией, которая была выявлена у 69 % пациентов. При анализе максимальных значений ЧСС ночью повышение показателя выявлено в группе 2. Достоверная разница максимальной ЧСС ночью у больных в группах 2 и 3б (р < 0,001) свидетельствует о большем напряжении регуляторных механизмов именно у больных с МС, т.е. на фоне инсулинорезистентности, но до манифестации СД 2 типа. У больных группы 3б наблюдался переход от краткосрочной адаптации к долговременной, и напряжение снижалось (ЧСС макс. ↓). По этому показателю разница была достоверна для групп 1 и 2 (р < 0,05), 1 и 3а (р < 0,001) (табл. 1).
Из показателей временного спектра отмечено снижение SDNN (день, ночь, сутки) ниже нормальных значений в группе 2 и значительное снижение в группах – 3а, 3б, 3в (ниже 50 мс), что свидетельствует о повышении риска сердечно-сосудистых осложнений (рис. 1).
Значения SDANN у больных с метаболическим синдромом были достоверно ниже (р < 0,001) нормативных показателей, но менее значительно, чем у пациентов с СД 2 типа (3а, 3б, 3в). Это свидетельствует о постепенном снижении ВСР на этапах нарушений углеводного обмена. Показатель рNN50 был низким во всех исследуемых группах, подтверждая гиперсимпатикотонию, в том числе и у пациентов, не имеющих повышения АД (группа 3в) (рис. 1).
Анализ среднесуточных значений спектрального анализа выявил значительное повышение мощности волн ULF % у больных СД 2 типа: 3а – 41,5 ± 6,8 %, 3б – 39,3 ± 4,2 %, 3в – 49,2 ± 11,1 %. Для сравнения – 1 группа – 22,3 ± 2,9 %, 2 группа – 19,8 ± 3,1 %, что свидетельствует о срыве адаптации и нарушении вегетативной регуляции сердечного ритма у пациентов СД 2 типа (р < 0,05). Однако мощность волн VLF (%), характеризующая активность высших вегетативных
центров и состояние нейрогуморального и метаболического уровней регуляции, достоверно повышена в группах наблюдения 1 и 2 (1 группа – 57,7 ± 1,9 %, 2 группа – 50,6 ± 4,6 %) с артериальной гипертонией, а не избыточной массой тела. Очевидно, что цена такой адаптации для организма очень высока и сопровождается активацией центральных механизмов регуляции и напряжением адаптационных резервов у пациентов этой группы. Однако, как показывают наши исследования, у пациентов, получающих терапию, уже нет гиперсимпатикотонии (группы 1 и 2 – LF↓). Поэтому любое достаточно интенсивное воздействие (физического или психического плана) на организм пациентов 2 группы (метаболический синдром), находящихся в таком состоянии, может привести к срыву адаптации и манифестации СД 2 типа. Отмечена тенденция к снижению мощности LF % в сравнении с нормой в группах наблюдения (1 группа – 8,5 ± 3,4 %, 2 группа – 11,9 ± 4,7 %) (рис. 2).
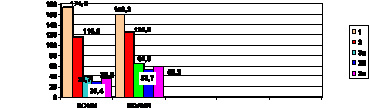
Рис. 1. Показатели временного спектра в клинических группах (сутки).
Примечания: р1 – достоверность разницы в группах 1 и 3а; р2 – достоверность разницы в группах 2 и 3б; р3 – достоверность разницы в группах 2 и 3в; р4 – достоверность разницы в группах 1 и 2.
SDNN: р1 < 0,001; р2 < 0,001; р3 < 0,001; р4 < 0,001; SDАNN: р1 < 0,001;
р2 < 0,001; р3 < 0,001; р4 < 0,001
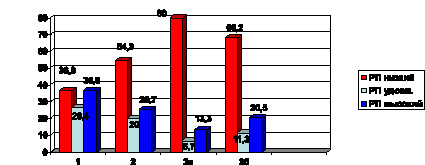
Рис. 2. Структура реабилитационных возможностей организма у больных с метаболическими нарушениями и сердечно-сосудистой патологией: РП (реабилитационный потенциал)
для пациентов 1 и 2 групп определялся по ПАС; для 3 а, 3б – по МФИ
В 1 группе наблюдения выявлено снижение мощности HF %, дисбаланс волн LF и HF, что характерно для заболеваний сердечно-сосудистой системы (р < 0,05). Уменьшение коэффициента вагосимпатического баланса LF/HF наблюдалось у больных с метаболическим синдромом (0,6 ± 0,1). Индекс централизации (ИЦ) оказался во всех группах выше нормальных значений. При этом выявлена достоверная разница в группах 2 и 3б (р < 0,05), подчеркивающая значение этапов нарушений углеводного обмена. ИЦ был также различным у больных АГ с нормальной массой тела (группа наблюдения 1) и с метаболическим синдромом (группа наблюдения 2) (р < 0,001). Изменение ИЦ в сторону увеличения на этапах прогрессирования нарушений углеводного обмена свидетельствует об активации центрального контура регуляции и постепенном переходе системной вегетативной регуляции с уровня контроля на уровень управления. Полученные данные позволяют считать этот механизм достаточным для повышения риска сердечно-сосудистых осложнений и поражения органов-мишеней у пациентов с МС и СД 2 типа с ожирением и АГ.
Стратификация рисков
сердечно-сосудистых осложнений в зависимости от состояния
механизмов адаптации
В оценке относительного риска и отношения шансов в группе пациентов с АГ без ожирения отмечено, что низкий реабилитационный потенциал не оказывает влияния на относительный риск тяжелого течения АГ (RR = 1,05) и ИБС (RR = 0,57), т.к. степень тяжести заболевания уже достаточно высока. Наблюдается повышение относительного риска развития инфаркта миокарда и инсульта у пациентов этой группы (RR = 1,71), а относительный риск вероятности ХСН еще выше (RR = 2,67) (табл. 2).
У пациентов с метаболическим синдромом и низким реабилитационным потенциалом замечен высокий относительный риск возникновения ОНМК (RR = 2,36) (табл. 3). В ретроспективном аспекте низкий РП, казалось бы, оказывает не очень значительное влияние на риск развития ХСН (RR = 1,26), а в проспективном аспекте отмечен высокий показатель отношения шансов развития ХСН (OR = 6,0).
Таблица 2
Низкий РП и риск развития сердечно-сосудистой патологии (группа 1)
|
RR |
CI 95 % |
OR |
CI 95 % |
|
|
АГ 3 степени |
1,05 |
0,23–0,78 |
1,07 |
0,13–8,79 |
|
ИБС |
0,57 |
0,07–4,49 |
0,50 |
0,04–6,01 |
|
ОИМ |
1,71 |
0,12–23,32 |
1,83 |
0,09–34,85 |
|
ОНМК |
1,71 |
0,12–23,32 |
1,83 |
0,09–34,85 |
|
ХСН |
2,67 |
1,09–6,04 |
12,0 |
1,05–136,79 |
Таблица 3
Низкий РП и риск развития сердечно-сосудистой патологии (группа 2)
|
RR |
CI 95 % |
OR |
CI 95 % |
|
|
АГ 3 степени |
0,42 |
0,18–0,98 |
0,21 |
0,05–0,90 |
|
ИБС |
0,84 |
0,41–1,73 |
0,73 |
0,19–2,77 |
|
ОИМ |
0,84 |
0,13–5,32 |
0,82 |
0,10–6,62 |
|
ОНМК |
2,36 |
0,27–20,53 |
2,62 |
0,24–28,19 |
|
ХСН |
1,26 |
0,93–1,71 |
6,0 |
0,59–60,44 |
В группе пациентов с СД 2 типа и нормальной массой тела с наличием АГ (группа 3а) и группе пациентов с ожирением с наличием АГ (группа 3б) наблюдалось преобладание низкого реабилитационного потенциала, поэтому вычислять риск на этой стадии патологии было некорректно.
У пациентов с артериальной гипертонией выявлена связь, предполагающая повышение степени тяжести АГ при низком реабилитационном потенциале. На этапах нарушений углеводного обмена выявлена связь снижения реабилитационного потенциала при повышении уровня глюкозы, триглицеридов и ИЦ.
Оценка состояния адаптационных механизмов у больных с метаболическими нарушениями и сердечно-сосудистой патологией
У больных, страдающих АГ (группа 1), низкий и высокий реабилитационный потенциал наблюдался в одинаковой степени – у 36,8 %. Однако наличие МС у пациентов меняло структуру – низкий РП отмечен более чем у половины больных (54,3 %), а хорошая адаптация толь-
ко у 25,7 %.
В группах сравнения у пациентов с СД 2 типа (группы 3а, 3б) отмечено пре-
обладание низкого реабилитационного потенциала с наибольшим значением
в группе 3а (80 %). В этой же группе 86,6 % пациентов находились на инсулинотерапии, что подтверждает тяжесть течения заболевания и объясняет низкий уровень реабилитационных возмож-
ностей (рис. 2).
Была рассмотрена связь между качественным показателем – степенью тяжести артериальной гипертонии и количественными показателями – реабилитационным потенциалом, числовым значением которого является ПАС или МФИ, циркадным индексом (ЦИ) как индикатором повышенной чувствительности сердечного ритма к симпатической стимуляции и коэффициентом вагосимпатического баланса LF/HF, увеличивающемся при гиперсимпатикотонии.
Связь степени тяжести АГ, МФИ и ЦИ в 1 группе наблюдения показала, что у больных с более тяжелым течением АГ отмечены значения МФИ более 1 и ЦИ более 125 % (рис. 3). Для пациентов 2 группы наблюдения в прогностической оценке тяжести АГ имели значение МФИ и ЦИ, степень которой усиливалась при МФИ выше 0,3 и показателях ЦИ ниже 92 % и выше 140 %.
Оценка состояния адаптационных механизмов у больных на этапах нарушений углеводного обмена
В исследуемых нами группах мы расценили 2 группу наблюдения, включающую пациентов c метаболическим синдромом, как начальный этап углеводных нарушений, СД 2 типа с ожирением как следующий этап (группы 3б и 3в с ИМТ > 25). И далее пациенты группы 3а с СД 2 типа (ИМТ < 25) на этапе формирования абсолютной инсулиновой недостаточности (рис. 3). По результатам исследования наименьшее число пациентов с низким реабилитационным потенциалом выявлено во 2 группе (54,3 %), далее в 3в (57,1 %) и 3б (68,2 %).
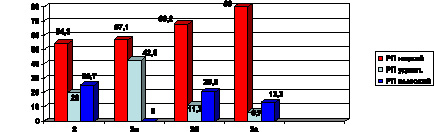
Рис. 3. Структура реабилитационных возможностей организма
на этапах нарушений углеводного обмена.
Примечания: РП (реабилитационный потенциал) для пациентов
2 группы определялся по ПАС; для 3 а, 3б, 3в – по МФИ
Наибольшее число пациентов, имеющих низкий реабилитационный потенциал, отмечено в группе 3а (80 %), что подтверждает прогрессирующее снижение адаптационных возможностей организма на этапах нарушений углеводного обмена, что и проявляется снижением РП (рис. 3). Причем в этой же группе и в группе 3в наблюдался наименьший процент пациентов с высоким реабилитационным потенциалом, а наибольший процент – в группе 2 у пациентов с метаболическим синдромом (25,7 %). Ожирение оказалось настолько значимым фактором для адаптации, что у пациентов 3в группы даже при отсутствии АГ не оказалось ни одного пациента с высоким реабилитационным потенциалом.
Заключение
1. К разряду значимых показателей, свидетельствующих о повышении риска формирования артериальной гипертонии и сердечно-сосудистых осложнений, относятся: уровень показателя адаптационного соответствия более 0,3, снижение SDNN (день, ночь, сутки) ниже нормальных значений, повышение ULF % более 20 % и VLF % более 35 %, увеличение индекса централизации более 3,3, скорости утреннего подъема АД более 10 мм рт.ст./ч.
2. Наименьшее число пациентов с низким реабилитационным потенциалом выявлено во 2 группе (54,3 %), наибольшее – в группе 3а (80 %), что свидетельствует о прогрессирующем снижении адаптационных возможностей организма на этапах нарушений углеводного обмена и проявляется снижением РП. При низком уровне реабилитационного потенциала увеличиваются прогностические риски: у пациентов с метаболическим синдромом: ОR по ОНМК – 2,62 (р < 0,05); ОR по ХСН – 6,02 (р < 0,001).
3. У больных с метаболическими нарушениями признаки вегетативной дисфункции наблюдаются с дебюта заболевания и сопровождают развитие процесса постоянно, а у пациентов с низкими реабилитационными возможностями организма гиперсимпатикотония проявляется как резервный адаптационный механизм. Пациентов с низким уровнем реабилитационного потенциала (ПАС > 0,3 и МФИ ≥ 1,0) желательно включать в группу риска раннего развития и ускоренного прогрессирования сердечно-сосудистых
осложнений.
Моргунов Л.Ю., д.м.н., профессор кафедры терапии, клинической фармакологии и скорой медицинской помощи, Московский государственный медико-стоматологический университет им. А.И. Евдокимова, г. Москва;
Князева Т.А., д.м.н., профессор, зав. отделом кардиологии, ФГБУ «РНЦ Медицинской реабилитации и курортологии» Министерства здравоохранения РФ, г. Москва.
Работа поступила в редакцию 31.10.2014.
Библиографическая ссылка
¹,³Курникова И.А., ²Кузнецова И.А., ³Сулейменов Е.А. РЕЗЕРВЫ АДАПТАЦИИ В ПРОГНОЗИРОВАНИИ РИСКА СЕРДЕЧНО-СОСУДИСТОЙ ПАТОЛОГИИ // Фундаментальные исследования. – 2014. – № 10-5. – С. 913-919;URL: https://fundamental-research.ru/ru/article/view?id=35764 (дата обращения: 16.04.2024).



