Способность патогенных микроорганизмов к образованию биопленок является важнейшей составляющей не только их выживаемости в различных экологических нишах, но также механизмов передачи инфекции и колонизации организма хозяина [11, 2]. Способность факультативно патогенных для людей бактерий Vibrio cholerae формировать биопленки является ключевым фактором персистенции вибрионов в водных экосистемах; биопленки могут становиться источником новых вспышек холеры [7, 8] По этой причине более глубокое понимание процесса формирования биопленок имеет большое значение для борьбы с холерой. На сегодняшний день предложено несколько способов изучения биопленок in vitro. Самым распространенным является метод, основанный на использовании полистироловых планшетов с последующей окраской генцианвиолетом адгезированных к полистиролу сформировавших биопленку бактерий [4]. Количественный учет способности микроорганизмов к образованию биопленки проводят по фотометрическим показателям.
Другой подход состоит в применении пробирок из стекла или пластика (типа эппендорф) также с использованием для визуализации спиртового раствора генциан- либо кристалвиолета [4, 1]. Метод позволяет визуально (качественно) оценить образование биопленки по наличию ободка на стенках пробирок.
В обоих случаях полученные биопленки практически не поддаются исследованию под микроскопом. Микроскопическое изучение биопленок, образовавшихся на других биотических (хитин, раковины моллюсков, натуральные почечные камни) и абиотических (камни, песок) поверхностях, возможно, но сопряжено с риском повреждения нативной структуры при искусственном отслаивании и приготовлении препаратов.
Наконец, предложено использовать в качестве подложки покровные стекла, расположенные на дне чашек Петри или флаконов, где в результате естественной адгезии клеток к стеклянной поверхности происходит формирование биопленок [10]. Анализ проводят с последующим извлечением стекол, отмывкой, фиксацией и окрашиванием генциан/кристалвиолетом [6, 4]. О формировании биопленок судят по пятнам на покровных стеклах и чашках Петри, а также по результатам их изучения под микроскопом. Этот способ показал хорошие результаты при изучении Pseudomonas spp., Burkholderia spp. (cepacia), Stenotrophomonas, Staphylococcus aureus, Candida albicans и др., т.е. микроорганизмов, относящихся к III–IV группам патогенности. Применение его к таким возбудителям II группы патогенности, как холерные вибрионы, крайне затруднено, поскольку при работе с ними необходимо соблюдать особые режимные условия согласно СП 1.3.3118-13 «Безопасность работы с микроорганизмами I–II группы патогенности (опасности)». На этапах внесения культуры микроорганизмов в лунки полистироловых планшетов, снятия фотометрических результатов, извлечения стекол со дна флаконов повышается вероятность аварий с разбрызгиванием заразного материала.
В связи с этим целью настоящей работы явилась разработка оптимального способа получения биопленок микроорганизмов II группы патогенности (холерных вибрионов) на стекле в условиях эксперимента для последующих морфофункциональных исследований.
Материалы и методы исследования
В ходе отработки метода моделирования образования биопленок использовали два нехолерогенных (не содержащих генов холерного токсина ctx AB) штамма: V. choleraе Еl Тor Р-5392 и V. choleraе O139 17918. В дальнейшем, после завершения создания протокола, исследовали предлагаемым методом по 13 ctx+ штаммов V. choleraе Еl Тor (5 штаммов водного происхождения и 8 – выделены от человека) и О 139 серогруппы. Все штаммы получены из музея живых культур ФКУЗ «Ростовский-на-Дону противочумный институт» Роспотребнадзора, где они хранились в ампулах в лиофилизированном состоянии.
В качестве твердого субстрата использовали покровные стекла (20×20), средой инкубации служила стерильная водопроводная либо речная вода. Эксперименты проводили при комнатной температуре в 100 мл флаконах.
Для исследования в динамике адгезии клеток холерных вибрионов к покровным стеклам в динамике нами было сконструировано специальное устройство, в которое помещали до 9 покровных стекол в вертикальном положении (рис. 1). Устройство со стеклами устанавливали на дне флакона, затем наливали экспериментальные среды в объеме 30–40 мл до полного погружения покровных стекол. В каждую емкость вносили суспензии клеток холерных вибрионов, приготовленные из 18-часовых агаровых культур, до конечной концентрации от 101 до 108 мк/мл. В качестве контроля использовали те же суспензии, но без покровных стекол.
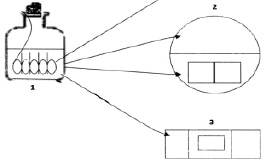
Рис. 1. Экспериментальная модель для изучения биопленок холерных вибрионов в динамике: 1 – стеклянная емкость, внутри которой размещено специальное устройство с покровными стеклами; 2 – чашка Петри с агаром для отпечатков на покровных стеклах и для высева планктонной культуры; 3 – предметное стекло, на которое помещены покровные стекла с биопленкой и накрыты покровным стеклом, большего размера (препарат раздавленная капля)
Для исследования динамики процесса адгезии клеток на поверхности покровных стекол, через определенные промежутки времени вынимали пинцетом по 2 стекла из каждой пробы, трехкратно промывали их в забуференном фосфатами физиологическом растворе (PBS) и в вертикальном положении помещали на листы фильтровальной бумаги для стекания с их поверхности оставшейся жидкости. После этого одно из стекол накладывали на поверхность агара Мартена и через 15 минут переворачивали на другую сторону, чашки с агаром помещали в термостат при 37 °С и на следующие сутки регистрировали наличие роста колоний холерных вибрионов в местах отпечатков. Второе стекло помещали на предметное стекло, добавляли раствор акридинового оранжевого (АО) в концентрации 20 мкг/мл (прижизненное флуорохромирование), накрывали покровным стеклом большего размера и исследовали методом люминесцентной микроскопии. Число адгезированных клеток определяли прямым подсчетом в ЛЮМ-микроскопе (МЛД-1) при увеличении 90×7.
Параллельно из опытных и контрольных образцов отбирали аликвоты суспензии («планктонная проба») и определяли в них концентрацию холерных вибрионов высевом десятикратных разведений на пластины агара Мартена с последующим подсчетом колониеобразующих единиц (КОЕ).
Все способы моделирования проводились согласно СП 1.3.3118-13 «Безопасность работы с микроорганизмами I–II группы патогенности (опасности)».
Результаты исследования и их обсуждение
На первом этапе работы были использованы взвеси холерных вибрионов в концентрации 101–102 м.к./мл. Рис. 2 визуально иллюстрирует прямо пропорциональную зависимость между экспозицией нахождения покровных стекол (4, 10, 20 ч) в опытных пробах, концентрацией холерных вибрионов в образовавшихся биопленках (отпечатки) и в планктонной части проб (изолированные колонии и сливной рост).
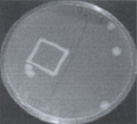
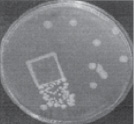
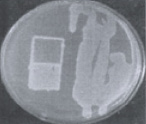
через 4 часа через 10 часов через 20 часов
Рис. 2. Результаты отпечаток на агаре Мартена покровных стекол и высевов планктонной части культуры холерных вибрионов (V. choleraе Еl Тor Р-5392)
С первого дня эксперимента холерные вибрионы адгезировались на поверхности покровных стекол в виде отдельных клеток, цепочек и небольших скоплений. Возможно, эта стадия соответствует стадии 1, описанной в литературе, когда твердая поверхность покрывается первичной пленкой, или как стадия 2 – собственно микробная адгезия, когда микроорганизмы обратимо прикрепляются к твердой поверхности (рис. 3, а, б). Взаимодействие структур на поверхности микроорганизмов и твердого субстрата обусловлено, по-видимому, неспецифическими физико-химическими силами [13, 3]. Нельзя исключить и определенной роли двигательной активности холерных вибрионов, поскольку подвижные клетки активно перемещаются по направлению к поверхностям и окончательно удерживаются притягивающими силами, действующими вблизи поверхности [9].
Исследования в динамике показали, что к четвертым суткам на покровных стеклах скопления состояли из клеток с сохраненной подвижностью, а также скоплений из слипшихся друг с другом клеток, между которыми находилось аморфное вещество, по-видимому, это экзополисахарид, такие структуры занимали всю площадь покровных стекол (рис. 3, в). Описанная картина, согласно литературным данным, характеризует третью стадию, в свою очередь, состоящую из нескольких этапов и по времени занимающую от нескольких часов до четырех суток [12, 14]. Клетки сохраняют способность к передвижению по поверхности стекла и формируют внеклеточный матрикс. Затем клетки холерных вибрионов склеиваются друг с другом, образуя скопления разных размеров, расположенные в один слой. В этот период обратной адгезии клеток не происходит, об этом свидетельствует уменьшение свободных мест на покровных стеклах. Образование матрикса – между клетками способствует их склеиванию друг с другом и образованию слоев, из которых формируются объемные фигуры.
 а
а  б
б 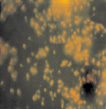 в
в 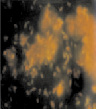 г
г
Рис. 3. Оценка формирования на покровных стеклах биопленок холерных вибрионов на разных стадиях V. choleraе Еl Тor Р-5392 (увеличение 7×90, окраска АО 20 мкг/мл): а – 1 стадия; б – 2 стадия; в – 3 стадия; г – 4 стадия
Начиная с пятых суток исследования процесс образования многослойной/многомерной структуры продолжался. Четкие очертания клеток были видны в каждом отдельном слое, а в случае многослойности они выглядели «размытыми». Клетки были окружены аморфным веществом, представляющим, вероятно, матрикс, состоящий из полисахаридов, белков, липополисахаридов, гликопротеинов или полипептидов, которыми обеспечивается прочность связи бактериальных клеток с поверхностями, благодаря увеличению числа точек контакта [5]. Между скоплениями просматривались пустые места в виде дорожек (рис. 3, г).
Аналогичное описание приводится в литературе, как 4 стадия – вторичных колонизаторов. Микроорганизмы прикрепляются к тем, которые уже сформировали биопленку, на этой же стадии формируются полости, каналы, выросты, поры [15].
Продолжение исследований позволило установить, что в течение следующих двух месяцев микроскопические препараты отличались количеством скоплений клеток и их ростом, как в ширину, так и в высоту, между скоплениями образовывались свободные места в виде дорожек. В планктонной части опытных и контрольных проб концентрация холерных вибрионов через два месяца от начала эксперимента снизилась на два порядка и составляла 104 КОЕ/мл.
Экспериментальные данные свидетельствовали, что все токсигенные штаммы холерных вибрионов образовывали биопленки поэтапно. Адгезия к покровным стеклам (1–2 стадия) проходила в течение первых трех суток. Однако дальнейшие стадии биопленок проходили с разной скоростью. Формирование скоплений и вещества между клетками (третья стадия), с последующим формированием дорожек и многослойности (4 стадия) в основном (у 14 штаммов из них 8 – V. choleraе Еl Тor и 6 – V. choleraе O139) наблюдалось на 4–7 сутки. Исключение составили штаммы, сформировавшие биопленку четвертой стадии к третьим суткам (V. choleraе Еl Тor 18210 и V. choleraе O139 17259). Штаммы, не сформировавшие к 21 дню (срок наблюдения) четвертую стадию биопленки, V. choleraе Еl Тor 18336 и V. choleraе O139 16064, 16486, 16070. У штамма V. choleraе Еl Тor 18337 произошла только стадия адгезии. Ряд штаммов образовал четвертую стадию биопленки на второй неделе: V. choleraе Еl Тor 18335, 18338 и V. choleraе O139 16485, 16073 и один штамм на третьей неделе V. choleraе O139 16075. В течение срока наблюдения пятой стадии (регрессии биопленки) не наблюдалось.
На втором этапе мы увеличили концентрацию холерных вибрионов до 106–108 м·кл./мл.
Для исследования динамики процессов не только адгезии холерных вибрионов к поверхности покровных стекол, но и их размножения в планктонной пробе, через 6, 9, 24, 48 часов, далее 1 раз в неделю, 1 раз в месяц исследовали покровные стекла, как описано выше, и делали высевы по 0,1 мл на пластины с агаром Мартена.
Начиная с 6 часов (начальный срок наблюдения) покровные стекла, извлеченные из всех проб, были покрыты налетом и выглядели мутными. Эти данные позволили предположить, что первая стадия образования биопленки происходит сразу после внесения культуры микроорганизмов. В микроскопических препаратах присутствовали подвижные и неподвижные палочковидные клетки зеленого и оранжевого цветов, цепочки клеток и скопления из 4–10 клеток. Как было отмечено выше, это вторая стадия – собственно микробная адгезия, когда микроорганизмы обратимо прикрепляются к твердой поверхности. В конце первой недели во всех экспериментальных пробах биопленки соответствовали 3–4 стадиям, в течение второй недели во всех исследуемых пробах – четвертой стадии.
В «планктонных» пробах с начальной концентрацией 108 КОЕ/мл количество холерных вибрионов через две недели от начала эксперимента снизилось на два порядка, с начальной концентрацией 107 КОЕ/мл – на один порядок и осталось без изменений в пробах с начальной концентрацией 106 КОЕ/мл, снижение КОЕ произошло через три недели на порядок. Соотношение КОЕ в экспериментальных и контрольных пробах без покровных стекол было в пределах одного порядка.
В течение второго и к концу третьего месяцев (срок наблюдения) концентрация холерных вибрионов в планктонных пробах, как в экспериментальных, так и в контрольных, оставалась в пределах 2•105–4•106 КОЕ/мл. На покровных стеклах в этот же период биопленки сохраняли свою многомерную/многослойную структуру с пустыми местами в виде дорожек.
Концентрация клеток холерных вибрионов в биопленках, формирующихся на покровных стеклах во всех экспериментальных пробах, не поддавалась подсчету, так как в отпечатках покровных стекол на пластинах агара Мартена наблюдался сливной рост.
Таким образом, при использовании разработанного нами способа во всех экспериментальных системах регистрировались одни и те же стадии формирования холерными вибрионами биопленок на твердых субстратах:
- Адгезия клеток холерных вибрионов на поверхности покровных стекол.
- Последовательное формирование скоплений клеток.
- Изменение соотношения между единично адгезированными клетками и скоплениями клеток в сторону последних.
- Формирование матрикса клетками холерных вибрионов в скоплениях.
- Увеличение скоплений в ширину и в высоту и формирование пустых мест в виде дорожек.
Необходимо также отметить, что, чем выше исходная концентрация холерных вибрионов в «планктоне», в нашем примере это 106 КОЕ/мл и выше, тем меньше вероятность микроскопически проследить за формированием 1–2 стадии адгезии. Так как размножение холерных вибрионов, если и происходит, то из-за отсутствия свободного объема в планктонной части, возможно, происходит вынужденная адгезия к поверхностям.
Заключение
Итогом проведенных исследований является разработка способа для изучения способности к формированию биопленок холерными вибрионами как III, так и II группы патогенности. Предлагаемая схема исследования соответствует режимным требованиям и сводит к минимуму риск контаминации возбудителем окружающего пространства. Кроме того, использование сконструированного нами специального устройства позволяет проследить динамику образования биопленок в одной пробе, а также одновременно проводить микроскопию и получать рост культуры либо непосредственно из отпечатков на агаре, либо после обогащения в пептонной воде, что значительно повышает достоверность получаемых результатов.
Рецензенты:
Алексеева Л.П., д.б.н., профессор, руководитель группы гибридов, ФКУЗ «Ростовский-на-Дону противочумный институт» Роспотребнадзора, г. Ростов-на-Дону;
Водопьянов С.О., д.м.н., заведующий лабораторией биохимии микробов, ФКУЗ «Ростовский-на-Дону противочумный институт» Роспотребнадзора, г. Ростов-на-Дону.
Работа поступила в редакцию 16.09.2014.
Библиографическая ссылка
Титова С.В., Кушнарева Е.В. ОЦЕНКА СПОСОБНОСТИ ХОЛЕРНЫХ ВИБРИОНОВ К ОБРАЗОВАНИЮ БИОПЛЕНОК in vitro С ПОМОЩЬЮ НОВОГО МЕТОДИЧЕСКОГО ПОДХОДА // Фундаментальные исследования. – 2014. – № 10-2. – С. 375-379;URL: https://fundamental-research.ru/ru/article/view?id=35351 (дата обращения: 18.04.2024).



