К настоящему времени воспалительная природа атеросклероза является общепризнанной. Воспалительный процесс присутствует на всех этапах развития этой болезни. Прогрессирование атеросклероза связано с асептическим воспалением эндотелия кровеносных сосудов. Установлено, что в основе патогенеза этого заболевания лежат два взаимосвязанных процесса – дислипидемия (ДЛП) и длительное вялотекущее хроническое воспаление сосудистой стенки с периодами стабильного течения и обострения процесса [3]. В связи с этим купирование воспалительного процесса для предотвращения риска развития острых сердечных событий у больных с ДЛП является актуальной задачей современной медицины.
Для оценки степени воспалительных изменений сосудистой стенки используют маркеры воспаления, повышенный уровень которых имеет место как у больных с острыми процессами в сердечно-сосудистой системе, так и у лиц с хроническим воспалительным процессом как, например, у пациентов со стабильной стенокардией напряжения [3]. К числу таких факторов, признанных в качестве маркеров воспаления, относятся С реактивный белок (СРБ), IL-1, IL-6, IL-8, TNFα, IFNγ, фибриноген, СОЭ, количество лейкоцитов крови и др. [5]. По уровню маркеров воспаления можно проследить также эффективность применяемых противовоспалительных средств, выявить предвестники острых повреждений в сердечно-сосудистой системе.
В настоящее время в качестве гиполипидемических препаратов широко используют статины – ингибиторы ключевого фермента биосинтеза холестерина – ГМГ-КоА-редуктазы. Однако при всех положительных эффектах этих лекарственных средств иногда они в ряде случаев могут оказывать побочное действие. Применение их в больших дозах может привести к нарушениям со стороны желудочно-кишечного тракта, печени, значительному повышению уровня трансаминаз, рабдомиолизу, миопатии негативными изменениями со стороны нервной системы, в ряде случаев они несовместимы с другими лекарственными средствами и некоторыми компонентами пищи и пр.).
Как можно заметить, осложнения, возможные при приеме статинов, являются достаточно серьезными. В свете этого актуальным является поиск новых методов гиполипидемической терапии для пациентов с дислипидемией.
В последние десятилетия для лечения и профилактики атеросклероза нормализации липидного обмена наряду с лекарственными средствами все чаще применяют природные биологически активные вещества (БАВ), в том числе, и из объектов морской флоры и фауны, отличающиеся безвредностью, высокой эффективностью и невысокой стоимостью. Как правило, это биологически активные добавки к пище (БАД). Значительный интерес в этом плане представляют сульфатированные полисахариды (СПС) бурых, красных и зеленых водорослей, характеризующиеся отсутствием токсичности и обладающие широким спектром биологической активности, включая антидислипидемическое и антиоксидантное действие, в связи с чем их предлагают для коррекции дислипидемий [8]. К сожалению, пока еще нет лекарственных препаратов на основе этих перспективных соединений в связи с трудностями, связанными с получением стандартных образцов [1]. Однако за рубежом достаточно давно активно используют экстракты водорослей, содержащих БАВ (полисахариды, пектины, альгинаты и др.) и их очищенные полисахаридные фракции, не называя эти биопрепараты лекарствами. Такие экстракты и полисахариды оказывают многостороннее действие на организм человека: нормализуют липидный профиль крови, препятствуют развитию ожирения, улучшают состояние сердечно-сосудистой системы, обладают противовоспалительным, антигипертензивным, гепатопротекторным, антикоагулянтным, сахароснижающим и спазмолитическим действием [10].
В литературе, касающейся влияния СПС на липидный обмен и уровень маркеров воспаления, очень мало работ, выполненных в клинических условиях. В основном эти вопросы изложены с использованием материалов, полученных в экспериментальных исследованиях. В связи с этим целью настоящей работы является оценка действия БАД Фуколам совместно с аторвастатином, а также per se на липидный обмен и уровень маркеров воспаления в крови пациентов с дислипидемией.
Материалы и методы исследования
Фуколам. В состав БАД Фуколам, которая была использована в комплексе с базисной терапией у пациентов с дислипидемией, входит фукоидан – сульфатированный полисахарид из бурой водоросли Fucus evanescens, имеющий небольшую молекулярную массу (20–40 кДа), что обусловливает его хорошую растворимость в воде и кислых растворах (100 мг), и альгинат кальция (400 мг). Следует отметить отсутствие токсических свойств у этого биополимера (по данным определения острой и хронической токсичности). Научно-техническая документация на БАД Фуколам представлена следующими документами: ТИ и ТУ 9284-065-02698170-2005, инструкция по применению БАД Фуколам, заключение ГУ НИИ питания РАМН 72/Э-6736/б-05 от 20.10.05, санитарно-эпидемиологическое заключение 77.99.23.3.У.739.1.06 от 30.01.06., свидетельство Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека о государственной регистрации (77.99.23.3.У.739.1.06 от 30.01.06). В настоящее время эта БАД выпускается на экспериментальном производстве Тихоокеанского института биоорганической химии ДВО РАН.
В рандомизированное исследование, обеспечивающее случайное распределение пациентов на 5 групп, включено 250 пациентов с синдромом дислипидемии в возрасте от 45 до 70 лет, прошедших стационарное лечение в терапевтическом отделении МО ДВО РАН и находившихся затем на амбулаторном лечении в поликлиническом отделении этого медицинского учреждения.
В исследование включали пациентов с дислипидемией, не получавших статинотерапию ранее; получавшие статинотерапию более 1 месяца до участия в исследовании; принимающие статины нерегулярно в малых дозах (5мг); получающие по показаниям базисную терапию (антитромбоцитарные препараты, метаболически нейтральные β-адреноблокаторы, ингибиторы ренин-ангиотензин-альдостероновой системы (РААС) – ингибиторы ангиотензинпревращающего фермента (АПФ) и блокаторы рецепторов ангиотензина II (БРА) и антагонисты кальция и нитраты по «требованию»). Пациенты участвовали в исследовании после подписания на добровольной основе письменного информированного согласия.
Критериями исключения пациентов из исследования являлось наличие первичной дислипидемии (гетеро- или гомозиготная семейная гиперхолестеринемия по данным анамнеза; хронических заболеваний сердечно-сосудистой, бронхолегочной, мочевыделительной, пищеварительной системы в фазе обострения; заболеваний щитовидной железы (гипотиреоз); сахарного диабета 1 или 2 типа; заболеваний печени (вирусный гепатит, токсический гепатит, лекарственный гепатит); заболеваний билиарного тракта (калькулезный холецистит); хронической почечной недостаточности (уровень креатинина более 220 мкмоль/л); нестабильной стенокардии напряжения (депрессия сегмента ST, подъем сегмента ST выше 1 мм, повышение уровня КФК не более чем в 3 раза выше верхнего предела нормативного значения, лейкоцитоз); инфаркта миокарда, перенесеннего менее чем за 3 месяца до начала исследования; хронической сердечной недостаточности III – IV ФК; артериальной гипертензии 3 ст. (АД выше 180/110 мм рт. ст.); индивидуальной непереносимости ингибиторов ГМГ-КоА-редуктазы; наличие противопоказаний, нежелательных реакций, побочных эффектов и возможных взаимодействий гиполипидемических средств (БАВ, лекарственных средств) с другими медикаментами, указанные в инструкциях препаратов и по данным литературы
Были сформированы следующие группы по 20 человек в каждой: 1 группа – условно здоровые лица (контроль), пациенты 2-й группы (сравнения) получали дополнительно к базисной терапии 10 мг аторвастатина («Pfize») в сутки, 3-я группа получала базисную терапию и 20 мг/сутки аторвастатина; 4-я группа – 1 капсулу Фуколама на фоне базисной терапии, 5-я группа (основная) – базисную терапию, 10 мг аторвастатина («Pfizer») и 1 капсулу Фуколама. Базисная терапия включала в себя препараты калия, антитромбоцитарные препараты селективные метаболически нейтральные β-блокаторы; ситуационно – антагонисты кальция, ингибиторы ренин-ангиотензин-альдостероновой системы – ингибиторы ангиотензинпревращающего фермента и блокаторы рецепторов ангиотензина II (БРА), и нитраты. Лечение сердечной недостаточности проводили традиционным методом без каких-либо ограничений.
Терапия с включением в комплекс лечения Фуколама продолжалась в течение 6 месяцев с ежедневным приемом БАД. Клинико-лабораторное обследование пациентов проводили до и через 1, 3, 6 месяцев после начала лечения.
В сыворотке крови пациентов биохимическим методом с помощью наборов реактивов фирмы «Biocon» (Германия), «Вектор-Бест» (Россия) определяли содержание общего холестерина (ХС), ХС липопротеидов низкой, очень низкой и высокой плотности (ЛПНП, ЛПОНП и ЛПВП), триглицеридов (ТГ). Коэффициент атерогенности рассчитывали по формуле КА = (ХС-ХС ЛПВП) / ХС ЛПВП. У пациентов исследовали также уровни аполипопротеинов: А (апо А), В (апо В) иммунотурбидиметрическим методом с использованием наборов реактивов фирмы «DiaSys» (Германия), липопротеина а (ЛПа) – латексным турбидиметрическим методом с помощью наборов «Human» (Германия).
Уровень С-реактивного белка (СРБ) в сыворотке крови проводили иммуноферментным методом с использованием набора фирмы «Вектор-бест». Содержание фибриногена в крови определяли весовым методом по Рутбергу, цитокины – иммуноферментным методом с использованием наборов «Цитокин» (Россия).
Статистическую обработку полученных данных проводили с помощью пакета программы «Statistica-7» и представляли в виде средней арифметической и ее ошибки (М ± m), критическое значение уровня значимости принималось равным 5% (р < 0,05).
Результаты исследования и их обсуждение
В таблице представлены показатели липидного обмена у всей группы пациентов с дислипидемией (250 человек) и у 20 человек, составивших контрольную группу. Как следует из материалов таблицы, средние значения ТГ и ХС ЛПВП достоверно отличались от показателей лиц контрольной группы, но находились в границах нормальных значений.
Показатели липидного обмена сыворотки крови у обследованных пациентов, M±m
|
Показатели |
Контрольная группа, n = 20 |
Пациенты с ДЛП, n = 250 |
|
ХС, ммоль/л |
4,44 ± 0,10 |
***6,36 ± 0,08 |
|
ТГ, ммоль/л |
1,16 ± 0,07 |
**1,29 ± 0,06 |
|
ХС ЛПОНП, ммоль/л |
0,53 ± 0,03 |
0,58 ± 0,03 |
|
ХСЛПНП, ммоль/л |
2,65 ± 0,06 |
***4,35 ± 0,08 |
|
ХСЛПВП, ммоль/л |
1,23 ± 0,04 |
***1,39 ± 0,04 |
|
Окисленные ЛПНП, мкг/мл |
1,52 ± 0,13 |
**1,89 ± 0,19 |
|
КА (коэф атероген), ед |
2,67 ± 0,12 |
***3,80 ± 0,13 |
|
ХС ЛПВП-отношение |
0,38 ± 0,01 |
***0,29 ± 0,01 |
|
ХС не-ЛПВП, |
3,08 ± 0,15 |
***4,97 ± 0,08 |
|
апоА1, мг/дл |
141,8 ± 3,75 |
142,26 ± 2,53 |
|
апоВ, мг/дл |
119,59 ± 3,34 |
***149,79 ± 2,99 |
|
апоВ/апоА1, ед. |
0,84 ± 0,02 |
**1,07 ± 0,02 |
|
Липопротеин (а), мг/дл |
23,33 ± 1,75 |
***65,20 ± 5,91 |
Примечание: * показана достоверность различий показателей в сравнении с контрольной группой: *** – р < 0,001; ** – р < 0,01; * р < 0,05.
В 20 % случаев определялась гипертриглицеридемия (2,1 ± 0,05 ммоль/л) и в 26,7 % случаев – гипоальфахолестеринемия (1,0 ± 0,01 ммоль/л). В основном, это были лица с метаболическим синдромом. Повышенными по сравнению с контролем были показатели общего холестерина (на 30,2 %), ХС ЛПНП (на 39,1 %), окисленных ЛПНП (на 19,65), АпоВ (на 20,2 %). Нарушения в липидтранспортной системе характеризовались увеличением коэффициента апоВ/апоА1 на 22 % (р < 0,01) относительно контрольных значений.
В последние годы в качестве дополнительных маркеров сердечно-сосудистого риска определяют липопротеин (а). У пациентов с дислипидемией содержание его было в 2,8 раза (р < 0,001) выше по сравнению с показателями здоровых лиц. О выраженном атерогенном сдвиге в крови свидетельствовало увеличение КА в 1,4 раза (р < 0,001), соотношения ХС /не-ЛПВП в 1,6 раза (р < 0,001) и снижение ХС /ЛПВП-отношения в 1,3 раза (р < 0,001) относительно показателей контрольной группы. Типирование выявленных изменений липидного спектра крови в соответствии с рекомендациями ВОЗ показало, что у пациентов, находившихся под нашим наблюдением, чаще определялась ДЛП IIa типа (75,5 %), проявляющаяся ГХС легкой или умеренной степени при нормальном содержании в крови ТГ. У остальных больных отмечена ДЛП IIб типа.
Наряду с этими типами ДЛП у пациентов в 31 % случаев определялась гипохолестеринемия ЛПВП, не предусмотренная рекомендациями ВОЗ при типировании ДЛП, но являющаяся фактором высокого риска при ИБС.
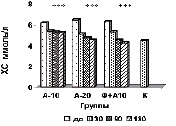
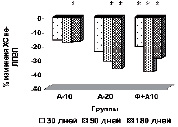
На рисунке (а-е) представлена динамика показателей липидного спектра сыворотки крови у пациентов с дислипидемией на фоне длительного приема аторвастатина в дозе 10 мг/сутки в комплексе с Фуколамом в сравнении с показателями у пациентов, получавших аторвастатин в дозе 10 и 20 мг/сутки на фоне базисной терапии. На протяжении 180 дней (срок наблюдения) у пациентов, получавших Фуколам, уровень ХС (рис. а) снижался, наиболее интенсивно у пациентов, получавших комплексную терапию – Фуколам и 10 мг аторвастатина.
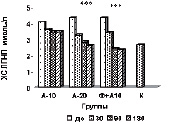
Такие же результаты получены со стороны ХС ЛПНП (рис. б), при этом уровень их снижался до более низких цифр, чем в контрольной группе. Обращает на себя внимание тот факт, что на протяжении всего срока наблюдения гипохолестеринемическое действие комбинированной терапии превосходило эффективность монотерапии аторвастатином в дозе 20 мг/сутки.
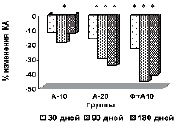
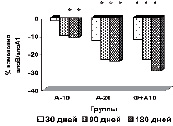
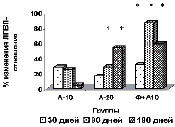
У пациентов основной группы к 90-му дню имела место положительная динамика показателей липидтранспортных аполипопротеидов и коэффициента атерогенности (рис. в), свидетельствующая об уменьшении атерогенных свойств крови. Через 3 месяца наблюдается стабилизация АпоВ/АпоА1 (рис. г), ХС не-ЛПВП (рис. д) или резкое уменьшение прироста (ХС /ЛПВП-отношение) (рис. е) коэффициентов, отражающих атерогенные свойства крови.
Наиболее выраженное влияние на атерогенный потенциал крови оказывала комбинированная терапия аторвастатином в дозе 10 мг с БАД Фуколам (основная группа пациентов). Согласно рекомендациям Европейского общества атеросклероза для оценки атерогенного сдвига рекомендуется использовать показатель ХС /ЛПВП-отношение. По результатам наших исследований, в опытной группе степень изменения ХС ЛПВП-отношения у пациентов основной группы наиболее выражена к 90 дню. К концу срока наблюдения этот показатель возрастает менее интенсивно, но превышает таковой у пациентов, получавших 20 мг аторвастатина.
Таким образом, комбинированное использование Фуколама с аторвастатином в дозе 10 мг/сут усиливает гиполипидемическое действие последнего. Следует обратить внимание и на тот факт, что в этом случае пациент получает только половинную дозу статина и нетоксичный, лишенный нежелательных эффектов, дешевый биопрепарат, обладающий рядом других полезных свойств (противовоспалительное, антиоксидантное, иммуномодулирующее и пр.). Такая схема лечения пациентов с дислипидемией позволяет снизить побочные эффекты статинов и затраты на их приобретение. Месячный курс лечения пациентов, получавших только БАД в комплексе с базисной терапией (5 группа), также приводил к отчетливой антиатерогенной динамике показателей. Так, на фоне снижения уровня общего ХС (р < 0,01) наблюдалось значимое снижение ХС ЛПНП (р < 0,01) и КА (р < 0,05). Продолжительный (в течение 6 месяцев) курс терапии больных с включением БАД способствовал нормализации общего ХС, ХС ЛПНП, КА (р < 0,01) и соотношения апо В/апо А1 (р < 0,01). Все это позволяет рекомендовать включение полисахаридов бурой водоросли в комплекс лечения пациентов с дислипидемией.
Повышенный уровень фибриногена является диагностически и прогностически значимым маркером атеросклероза и ассоциируется, как правило, с его осложнениями и смертностью [4]. Нарушения гемостаза в процессе атерогенеза приводят к снижению тромборезистентности эндотелия, повышению агрегационной функции тромбоцитов и активности факторов свертывания, а также к угнетению фибринолитических функций эндотелия, что способствует развитию атеросклероза.
При исследовании влияния включения полисахаридов морских водорослей в курс лечения больных с дислипидемией было установлено, что во все сроки наблюдения показатели фибриногена изменялись в границах нормальных значений. При этом изменения, в основном, были недостоверны и носили характер тенденции. Статистически достоверными были только результаты, полученные через 3 месяца после начала лечения в основной группе пациентов, получавших комбинированное лечение (снижение: до лечения – 4,09 ± 0,20 г/л; после лечения 3,43 ± 0,10, р < 0,01) и группе больных, получавших только Фуколам на фоне базисной терапии (снижение: до лечения – 3,65 ± 0,08 г/л; после лечения – 3,32 ± 0,07, р < 0,05).
Таким образом, полисахариды морских водорослей обладают способностью снижать уровень фибриногена в плазме крови пациентов с дислипидемией. В комбинации с аторвастатином в дозе 10 мг/сутки они снижают показатели фибриногена через 3 месяца после начала лечения. Через 6 месяцев снижение носило характер тенденции.
С-реактивный белок (СРБ) определяется в крови при различных воспалительных и некротических процессах и считается показательным маркером воспаления. К настоящему времени установлена тесная связь между уровнем СРБ и риском возникновения наиболее серьезных сердечно-сосудистых заболеваний, в частности, инфаркта миокарда, инсульта и др. Показано, что чем выше уровень СРБ в плазме крови, тем выше вероятность осложнений атеросклероза и смертность от них или шанс их возникновения у здоровых людей. Это объясняется тем, что высокий уровень СРБ обусловливает существенное повышение содержания цитокинов в эндотелиальных клетках и усиливает адгезивность ряда молекул, находящихся на их поверхности. В норме СРБ присутствует в крови в небольших количествах. Однако при острых процессах его уровень многократно возрастает. При стенокардии уровень СРБ остается в пределах нормы. У пациентов с нестабильной стенокардией повышенные значения СРБ являются показателем активного атероматоза и тромботических осложнений. Небольшое увеличение уровня СРБ может отражать хроническое субклиническое воспаление сосудистой стенки, связанное с атеросклерозом, и является проспективным фактором риска.
У наблюдавшихся нами пациентов величины СРБ не выходили за пределы нормальных значений, но были достоверно выше, чем у здоровых лиц контрольной группы (контроль – 2,14 ± 0,34; у пациентов с дислипидемией – 3,77 ± 0,30, р < 0,001).
Наиболее значимое достоверное снижение показателя СРБ наблюдалось в группе пациентов, получавших аторвастатин в дозе 20 мг в сутки (через 3 месяца после начала лечения, например, показатель снизился на 32 % (до лечения – 3,60 ± 0,42; после лечения – 2,45 ± 0,32, р < 0,01). Близкие результаты получены у этой группы пациентов через 6 месяцев после начала лечения (снижение составило 30,6 %).
Сопоставимыми с этими результатами являются показатели у пациентов, получавших фуколам и аторвастатин в дозе 10 мг/сутки. Так, через 3 месяца после начала лечения снижение показателя составило 36,7 % (до лечения – 46,6 ± 0,76; после лечения – 3,62 ± 0,71, р < 0,05). У пациентов, получавших аторвастатин в дозе 10 мг/сутки, и у пациентов, получавших только фуколам, снижение показателей также имело место, однако оно носило характер тенденции.
Таким образом, исследования показали, что для достижения эффекта вместо аторвастина в дозе 20 мг/ сутки можно использовать его половинную дозу в комбинации с фуколамом.
Значительная роль в развитии и поддержании системного воспалительного процесса при атеросклерозе принадлежит системе цитокинов, которые являются одними из основных регуляторов воспалительного процесса на молекулярном и клеточном уровнях. Изучение цитокинового профиля у пациентов с дислипидемией актуально для выяснения ранних маркеров кардиоваскулярного риска до субклинических и клинических проявлений атеросклероза и своевременной коррекции данных нарушений. До включения в курс терапии Фуколама и аторвастатина у пациентов с дислипидемией наблюдалось статистически значимое увеличение трех провоспалительных цитокинов – TNFα, IFNγ и IL-8 по сравнению с показателями у здоровых доноров.
Известно, что провоспалительные цитокины IL-1, IL-2, IL-6, IL-8, IL-12, IL-18, TNFα, IFNγ способствуют развитию атеросклероза, инфаркта миокарда, атеротромбоза [2]. При этом повышение уровня TNFα и IL-1β имеет место, в основном при острых процессах (инфаркт миокарда, инсульт и пр.). Это позволяет использовать их как маркеры тяжести течения атеросклеротического процесса.
IFNγ является ключевой провоспалительной молекулой в атерогенезе. Роль его при атеросклерозе была доказана в экспериментах на IFNγ – дефицитных мышах [11]. Действие этого цитокина реализуется через стимуляцию антигенпредставляющих функций эндотелия и макрофагов, выработку провоспалительных цитокинов, повышенную экспрессию эндотелием молекул адгезии, усиление продукции активных форм кислорода в макрофагах и ингибирования выхода холестерина из пенистых клеток. Кроме того, IFNγ блокирует синтез коллагена и стимулирует продукцию матриксной металлопротеиназы, способствуя тем самым дестабилизации зрелых атеросклеротических поражений.
Проатерогенным фактором является и IL-8. Этот цитокин продуцируется в моноцитах и макрофагах после добавления окисленного ЛПНП, вызывает экспрессию молекул межклеточной адгезии и усиливает прилипание нейтрофилов к эпителиальным клеткам и субэндотелиальным матричным белкам. Все это свидетельствует о существенной роли IL-8 в опосредовании воспалительного ответа. Кроме того было установлено, что повышение уровня IL-8 ассоциируется с риском развития нестабильной стенокардии и инфаркта миокарда, что указывает на потенциальную клиническую значимость IL-8 при атеросклерозе [12].
Повышенный уровень провоспалительных цитокинов у находившихся под нашим наблюдением пациентов основной группы свидетельствовал о наличии у них хронического воспаления. Одним из плейотропных эффектов полисахаридов бурых водорослей является противовоспалительный, в связи с чем мы ожидали снижения уровня провоспалительных цитокинов при их использовании в сочетании с базисной терапией и аторвастатином.
|
|
|
|
а) |
б) |
|
|
|
|
в) |
г) |
|
|
|
|
д) |
е) |
Изменение липидного профиля сыворотки крови пациентов с дислипидемией под действием полисахаридов морских водорослей и аторвастатина: а) динамика уровня общего холестерина; б) динамика уровня ХС ЛПНП; в) % изменения КА от исходного уровня; г) % изменения апоВ/апоА1 от исходного уровня; д) % изменения ХС не ЛПВП от исходного уровня; е) % изменения ЛПВП-отношения от исходного уровня
Было показано, что Фуколам в сочетании с базисной терапией и 10 мг аторвастатина снижал уровень IFNγ на 66,9 % (с 30,31 пкг/мл до 10,25 пкг/мл; p = 0,021; у лиц контрольной группы – 5,7 ± 1,3). Однако, как видно из приведенных данных, показатели пациентов основной группы не достигали уровня контроля, хотя снижение и было значительным. На 65,1 % снизились показатели TNFα (с 8,78 пкг/мл до 3,05 пкг/ мл; p = 0,011; у лиц контрольной группы – 3,2 ± 1,1) и на 44,34 % – IL-8 (c 12,19 пкг/мл до 7,18 пкг/мл; p = 0,017; у лиц контрольной группы – 6,6 ± 1,05). Показатели снижения уровня провоспалительных цитокинов под действием Фуколама и аторвастатина в дозе 10 мг были сопоставимы с таковыми при использовании базисной терапии и 20 мг аторвастатина в сутки.
К настоящему времени сведения о состоянии цитокинового статуса, в том числе провоспалительных цитокинов под действием полисахаридов морских водорослей у больных с дислипидемией немногочисленны. Основное внимание направлено на антидислипидемическое действие этих соединений, поскольку оно выражено достаточно значительно. Однако результаты наших исследований подтверждают тот факт, что полисахариды обладают кроме того противовоспалительным действием, которое вносит свой вклад в купирование негативных процессов, происходящих при атеросклерозе.
Было показано также, что действие на воспалительный процесс у пациентов основной группы сочетанного применения Фуколама и аторвастатина в дозе 10 мг в сутки сопоставимо с таковым аторвастатина в дозе 20 мг в сутки, т.е. можно уменьшать дозу статина вдвое и тем самым снижать риск побочных реакций, а также уменьшать стоимость лечения пациентов.
Несмотря на то, что изменение уровня СРБ и фибриногена происходили в пределах референсных значений популяции здоровых лиц, у пациентов основной группы наблюдалось достоверное снижение этих показателей. Этот факт, а также литературные данные [7, 9] дают возможность предполагать, что и при значимо повышенных уровнях этих маркеров такое снижение будет иметь место, поскольку СПС морских водорослей, как было сказано выше, обладают выраженными противовоспалительными свойствами.
В настоящем исследовании проведена сравнительная оценка эффективности гиполипидемического и противовоспалительного действия Фуколама и аторвастатина (последний в наиболее часто используемых в медицинской практике дозах – 10–20 мг/сутки).
Заключение
Один из возможных аспектов гиполипидемического действия Фуколама может быть связан с тем, что фукоидан обладает способностью индуцировать секрецию липопротеидлипазы и аполипопротеина С-II, обусловливающего регуляцию ХС и ТГ в адипоцитах, повышать активность других метаболических ферментов (печеночного липопротеина и лецитин-холестерол-ацилтрансферазы), что приводит к ограничению абсорбции липидов (ХС и желчных кислот) [13]. Показана способность фукоидана при пероральном введении снижать абсорбцию пищевых жиров в кишечнике, что объясняется ингибированием их гидролиза липазой поджелудочной железы, а также снижением уровня печеночной триацилглицерол-липазы в плазме крови [6]. Кроме того, в состав Фуколама в качестве пищевых волокон входит альгинат, который тоже играет немаловажную роль в липидном обмене.
Фукоидан по эффективности воздействия на разные фракции липидов сыворотки и плазмы крови сопоставим как с действием аторвастатина в дозе 20 мг (ХС, ХС ЛПНП, апоВ и пр.), так и с действием аторвастатина в дозе 10 мг (окисленные ЛПНП, плазменные ТГ и ХС). Все эти материалы позволяют рекомендовать Фуколам как средство сопровождения базисной терапии у пациентов с дислипидемией с применением статинов или per se c целью коррекции липидного обмена и снижения интенсивности хронического системного воспаления.
Рецензенты:
Кузнецова Т.А., д.м.н., заведующая лабораторией иммунологии, ФГБУ «Научно-исследовательский институт эпидемиологии и микробиологии им. Г.П. Сомова» СО РАМН, г. Владивосток;
Маркелова Е.В., д.м.н., профессор, заведующая кафедрой физиологии человека, ГБОУ ВПО «Тихоокеанский Государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Владивосток.
Работа поступила в редакцию 05.08.2014.
Библиографическая ссылка
Крыжановский С.П., Богданович Л.Н., Беседнова Н.Н., Иванушко Л.А., Головачева В.Д. ГИПОЛИПИДЕМИЧЕСКИЕ И ПРОТИВОВОСПАЛИТЕЛЬНЫЕ ЭФФЕКТЫ ПОЛИСАХАРИДОВ МОРСКИХ БУРЫХ ВОДОРОСЛЕЙ У ПАЦИЕНТОВ С ДИСЛИПИДЕМИЕЙ // Фундаментальные исследования. – 2014. – № 10-1. – С. 93-100;URL: https://fundamental-research.ru/ru/article/view?id=35221 (дата обращения: 19.04.2024).