В 90-е годы снова началась эпидемия туберкулеза, и в настоящее время туберкулез представляет угрозу населению планеты не меньше, чем другие инфекционные заболевания. По данным Всемирной организации здравоохранения, жертвами туберкулеза ежегодно становятся около 1,7 миллионов. Происходит быстрое распространение его лекарственно-устойчивой формы [8, 9]. Процент больных туберкулезом детей составляет 12–35 % от общего числа. В Казахстане наиболее неблагополучна в этом отношении Павлодарская область, где отмечается самый высокий уровень заболеваемости детей [3].
Отсутствие детских противотуберкулезных лекарственных средств является глобальной проблемой, которая наиболее остро стоит в развивающихся станах. Во всем мире многие лекарственные средства для детей используются без соответствующих данных об их воздействии на организм ребенка и специального разрешения. Мировой фармацевтический рынок остро нуждается и в качественных, эффективных и безопасных противотуберкулезных лекарственных препаратах в специальных детских лекарственных формах [2].
В рамках решения этой проблемы на базе ООО «РОМАТ», Казахстан, разработан состав и технология детской лекарственной формы противотуберкулезного лекарственного средства РИЗЭФ-Д рифампицин/изониазид 60/30 мг, диспергируемые таблетки на основе молекулярно инкапсулированных действующих веществ с β-циклодекстрином. Очевидным преимуществом этой композиции стала установленная на этапе доклинических исследований уменьшенная более чем в 20 раз в сравнении с аналогами острая токсичность [3].
Создание любых дженериков предполагает проведение фармакокинетических исследований и оценку биоэквивалентности, являющуюся основным видом медико-биологического контроля дженериков [5].
Поэтому целью настоящего исследования явилось изучение фармакокинетики и относительной биодоступности лекарственного препарата РИЗЭФ-Д 60/30, таблетки диспергируемые (ТОО «Павлодарский фармацевтический завод», Республика Казахстан) в сравнении с препаратом рифампицин 60/изониазид 30 таблетки диспергируемые (Маклеодс Фармасьютикалс Лтд, Индия).
Материалы и методы исследования
Тестируемый лекарственный препарат производства ТОО «Павлодарский фармацевтический завод», Республика Казахстан, содержит комбинацию двух противотуберкулезных средств – рифампицина 60 мг и изониазида 30 мг.
В качестве препарата сравнения выбран аналог, не зарегистрированный в Республике Казахстан – таблетки рифампицин 60/изониазид 30, производства Маклеодс Фармасьютикалс Лтд, Индия, так как на фармацевтическом рынке Казахстана отсутствует аналог тестируемому лекарственному препарату по лекарственной форме и дозировке.
Исследования проводились на кроликах-самцах породы Шиншилла массой тела – 3,23 ± 0,39 кг, полученных из питомника ТОО НПП «Антиген» (г. Алматы).
Животным с помощью зонда внутрь вводили 1 таблетку лекарственного препарата РИЗЭФ-Д 60/30 таблетки диспергируемые или 1 таблетку лекарственного препарата рифампицин 60/изониазид 30 таблетки диспергируемые. Промежуточный период составил 7 дней, по истечении которого указанные лекарственные препараты вводили в обратном порядке.
Образцы крови (около 1,0 мл) отбирали из краевой ушной вены с помощью игл и переносили в центрифужные пробирки, предварительно обработанные гепарином. Взятие образцов крови для последующего определения содержания препарата в плазме крови осуществлялось в дискретные интервалы времени: через 0; 0,5; 1,0; 2,0; 3,0; 4,0; 6,0; 8,0; 12,0 и 24,0 часа после перорального введения препаратов. Образцы крови отстаивались в течение 15 минут в условиях комнатной температуры. После центрифугирования (3000 об/мин в течение 10 минут) отбирали плазму крови, которая хранилась при температуре –30° С в морозильной камере «Premium».
Для количественного определения рифампицина в плазме крови использовали хроматографический метод [4]. Анализ проводили на жидкостном хроматографе «Agilent 1100» с УФ-детектором и компьютером с соответствующим пакетом программ для обсчета хроматограмм. Условия хроматографирования: аналитическая колонка – «Zorbax Bonus-RP», Agilent (150´4,6 мм; 5 мкм); подвижная фаза 0,01 М раствор аммония фосфата двузамещенного – ацетонитрил (50:50), профильтрованная через мембранный фильтр с размером пор 0,45 мкм и дегазированная на ультразвуковой бане; скорость потока элюента – 1,0 мл/мин; детектирование при длине волны 215 нм; температура колонки + 35 °С.
Для экстракции рифампицина из плазмы крови в экстракционную пробирку, содержащую 1 мл плазмы крови, добавляли 5,0 мл смеси пентан:дихлорметан (1:1), встряхивали на шейкере и центрифугировали при 4000 об/мин в течение 10 минут. Супернатант переносили в выпарительную колбу. Органическую фракцию выпаривали досуха на роторном испарителе в токе азота. Сухой остаток растворяли в 250 мкл подвижной фазы и по 50 мкл аликвоты вводили в петлю инжектора.
Процент извлечения рифампицина из плазмы крови составил в среднем 83,9 ± 7,5 %. Количественное определение рифампицина проводили методом абсолютной калибровки. Установлено, что в диапазоне концентраций 5–40 мкг/мл калибровочная кривая линейна. Стандартная кривая рифампицина описывалась уравнением y = 34,033x – 85,17 (R2 = 0,9997), где y – площадь хроматографического пика рифампицина; х – концентрация в мкг/мл (рис. 1–3). Минимальная обнаруживаемая концентрация составила 25 нг/мл. Относительная ошибка метода для концентрации 5 мкг/мл не превышала 29,76 %.
Рис. 1. Хроматограмма стандартного раствора рифампицина 20 мкг/мл
Рис. 2. Хроматограмма стандартного раствора рифампицина в плазме крови in vitro
Рис. 3. Хроматограмма плазмы крови кролика через 0,5 ч после введения препарата РИЗЭФ-Д 60/30
Полученные данные предварительно были подвергнуты математической статистической обработке с помощью программы «Excel». Расчет фармакокинетических параметров анализируемых препаратов был проведен с использованием программы «ANOVA».
Результаты исследования и их обсуждение
На рис. 1 представлена хроматограмма стандартного раствора рифампицина с концентрацией 20 мкг/мл, на рис. 2 – хроматограмма плазмы крови кролика in vitro с концентрацией 40 мкг/мл, на рис. 3 – хроматограмма плазмы кролика через 0,5 часа после введения препарата РИЗЭФ-Д 60/30. Из хроматограмм видно, что время удерживания пика рифампицина лежит в пределах от 5,8 до 7,4 мин.
С целью оценки биологической доступности исследуемых лекарственных форм были определены концентрации рифампицина в сыворотке крови кроликов при применении препаратов, рассчитаны основные фармакокинетические параметры, позволяющие количественно охарактеризовать относительную биодоступность (f), величины площадей под фармакокинетическими кривыми зависимости «концентрация ‒ время» (AUC0-360), время достижения максимальной концентрации (Тmax) и значения максимальных концентраций (Сmax) [1, 6, 7].
На рис. 4 представлен усредненный фармакокинетический профиль рифампицина после введения тестируемого и референс-препаратов.
Профили концентраций рифампицина тестируемого и референс-препаратов схожи. Фармакокинетические кривые рифампицина показывают, что исследуемое соединение определяется на протяжении 12 часов после однократного введения животным и испытуемого лекарственного препарата, и препарата сравнения.
В табл. 1 представлены фармакокинетические параметры рифампицина у кроликов после введения исследуемых лекарственных препаратов.
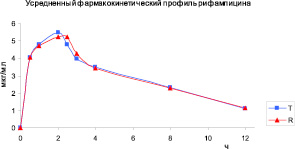
Рис. 4. Усредненный фармакокинетический профиль рифампицина в плазме крови кроликов после однократного перорального введения лекарственных препаратов
Таблица 1
Индивидуальные и средние значения фармакокинетических параметров рифампицина тестируемого (Т) и референс-препаратов (R)
|
№ п/п |
tmax, ч |
Cmax, мкг/мл |
AUC0→t, мкг/мл·ч |
Cmax/AUC 0→t, ч–1 |
||||
|
T |
R |
T |
R |
T |
R |
T |
R |
|
|
1 |
2,50 |
2,50 |
5,94 |
5,69 |
36,31 |
35,16 |
0,14 |
0,16 |
|
2 |
2,00 |
2,00 |
6,06 |
5,79 |
36,06 |
34,13 |
0,17 |
0,17 |
|
3 |
2,00 |
1,00 |
5,19 |
5,36 |
35,11 |
33,54 |
0,15 |
0,16 |
|
4 |
2,00 |
2,50 |
5,79 |
6,17 |
36,82 |
35,90 |
0,16 |
0,17 |
|
5 |
2,50 |
2,50 |
5,84 |
5,65 |
33,66 |
38,13 |
0,17 |
0,15 |
|
6 |
2,00 |
2,00 |
5,74 |
5,88 |
33,68 |
34,82 |
0,17 |
0,17 |
|
x |
2,17 |
2,08 |
5,76 |
5,76 |
35,27 |
35,28 |
0,16 |
0,16 |
|
SD |
0,24 |
0,53 |
0,28 |
0,25 |
1,24 |
1,48 |
0,01 |
0,01 |
|
|
0,10 |
0,22 |
0,11 |
0,10 |
0,51 |
0,60 |
0,00 |
0,00 |
|
C.V. % |
10,88 |
25,61 |
4,78 |
4,26 |
3,52 |
4,19 |
7,22 |
4,56 |
Сравнительный анализ основных фармакокинетических параметров (табл. 2) рифампицина показал, что изучаемый лекарственный препарат быстро поступает в системный кровоток из желудочно-кишечного тракта. Значения скорости всасывания (Cmax/AUC0→t) для лекарственных препаратов РИЗЭФ-Д 60/30 (T) и рифампицин 60/изониазид 30 (R) статистически достоверно не различаются и составляют в среднем 0,16 ± 0,01 ч–1, а индивидуальный разброс значений незначительный – C.V. составил 4,56–7,22 %. Время достижения максимальной концентрации (Тmax) составило в среднем для Т – 2,17 ± 0,24 и для R – 2,08 ± 0,53 ч. Разность между значениями Тmax для тестируемого и референс-препаратов в среднем составляет 0,09 ч. Приведенные данные свидетельствуют, что по времени достижения максимальной концентрации (Тmax) между изучаемыми лекарственными препаратами достоверных различий также не обнаружено.
Средняя максимальная концентрация рифампицина, определяемая в плазме крови кроликов (Сmax), практически не отличается и для тестируемого препарата составила 5,76 ± 0,28 мкг/мл и для препарата сравнения – 5,76 ± 0,25 мкг/мл. Затем рифампицин медленно выводится из организма и через 12 часов после введения препаратов еще обнаруживается в плазме крови кроликов – 1,11 ± 0,25 мкг/мл (для T) и 1,14 ± 0,32 мкг/мл (для R).
Индивидуальный анализ основного параметра, характеризующего степень всасывания действующего вещества из лекарственной формы – площадь под фармакокинетической кривой (AUC0→t) указывает, что между изучаемыми препаратами статистически достоверных различий не обнаружено. Среднее значение AUC0→t для препарата Т составило 35,27 ± 1,24 и для R – 35,28 ± 1,48 мкг/мл·ч.
При анализе индивидуальных фармакокинетических кривых, было установлено, что у кролика № 3 наблюдалась небольшая разница в фармакокинетических профилях для T и R препаратов – пик концентрации у тестируемого препарата 2 ч, а у препарата сравнения – 1 ч. По-видимому, эти отклонения от общей картины обусловлены индивидуальными физиологическими особенностями животного.
Доверительные интервалы для логарифмически преобразованных значений AUC составляют от 3,52 до 3,61, а для логарифмически преобразованных значений Cmax – от 1,60 до 1,80 и не выходят за допустимые границы [5, 7].
Относительная биологическая доступность (f) рифампицина (табл. 2), определяемая отношением индивидуальных значений AUC0-t тестируемого препарата по отношению к референс-препарату, у всех животных находится в диапазоне 88,38–105,65 %, среднее значение составляет – 100,3 ± 6,04 %. Следует отметить, что имел место незначительный разброс индивидуальных значений относительной биодоступности, коэффициент вариации (C.V.) составил 6,03 %.
Таблица 2
Индивидуальные значения относительной биодоступности (AUCT/AUCR) рифампицина тестируемого (Т) и референс-препаратов (R)
|
№ п/п |
Рифампицин |
|
AUCT/ AUCR |
|
|
1 |
103,27 |
|
2 |
105,65 |
|
3 |
104,78 |
|
4 |
102,56 |
|
5 |
88,38 |
|
6 |
96,73 |
|
x |
100,30 |
|
SD |
6,04 |
|
|
2,47 |
|
C.V. % |
6,03 |
Заключение
Установлено, что после однократного введения лекарственного препарата РИЗЭФ-Д 60/30 таблетки диспергируемые (ТОО «Павлодарский фармацевтический завод», Республика Казахстан) кроликам препарат быстро достигает системного кровотока. Уровни максимальных концентраций рифампицина в плазме крови животных после перорального введения лекарственных препаратов РИЗЭФ-Д 60/30 и рифампицин 60/изониазид 30 сопоставимы.
Достоверных различий в скорости всасывания (Cmax/AUC) рифампицина после введения исследуемых препаратов экспериментальным животным не выявлено.
Время наступления максимальной концентрации рифампицина в плазме крови составило для препарата РИЗЭФ-Д 60/30 2,17 ± 0,24 ч и для препарата рифампицин 60/изониазид 30 – 2,08 ± 0,53 ч.
Относительная биодоступность препарата РИЗЭФ-Д 60/30 таблетки диспергируемые (ТОО «Павлодарский фармацевтический завод», Республика Казахстан) по отношению к препарату рифампицин 60/изониазид 30 таблетки диспергируемые (Маклеодс Фармасьютикалс Лтд, Индия) в среднем составила 100,3 %, что свидетельствует об очевидной перспективности использования данной лекарственной композиции в разработанной лекарственной форме.
Рецензенты:
Степанова Э.Ф., д.фарм.н., профессор кафедры технологии лекарств, Пятигорский медико-фармацевтический институт, филиал ГБОУ ВПО ВолгГМУ, г. Пятигорск;
Компанцев Д.В., д.фарм.н., доцент, зав. кафедрой технологии лекарств, Пятигорский медико-фармацевтический институт, филиал ГБОУ ВПО ВолгГМУ, г. Пятигорск.
Работа поступила в редакцию 30.06.2014.
Библиографическая ссылка
Ким М.Е., Мурзагулова К.Б. ИССЛЕДОВАНИЕ ФАРМАКОКИНЕТИКИ И ОТНОСИТЕЛЬНОЙ БИОДОСТУПНОСТИ ПРЕПАРАТА РИЗЭФ-Д 60/30 ТАБЛЕТКИ ДИСПЕРГИРУЕМЫЕ // Фундаментальные исследования. – 2014. – № 9-4. – С. 794-798;URL: https://fundamental-research.ru/ru/article/view?id=34929 (дата обращения: 20.04.2024).





