На сегодняшний день рожа продолжает оставаться актуальной проблемой инфектологии, сопровождаясь высокой заболеваемостью без тенденции к снижению (1,4–2,2 на 1000 человек взрослого населения) и частым развитием рецидивов [1, 2, 3]. Современная терапия, включающая антибактериальные, сосудистые, метаболические препараты изменила клиническую картину рожи, но радикально не повлияла на частоту рецидивов, которая колеблется на сегодняшний день в пределах 20–50 % [4].
В патогенезе рожи значительная роль отводится активации протеолитических процессов, при этом проведенные в прежние годы исследования касались в основном изолированного изменения активности некоторых протеолитических систем. Следует отметить, что их функционирование тесно взаимосвязано, регулируется общими механизмами и в совокупности может влиять на развитие той или иной формы заболевания. Лишь единичные исследования отражают изменения в антипротеолитической системе при этой патологии [5]. Не изучен также и вопрос прогностического значения изменения протеолитических процессов для возникновения рецидивов рожи. В связи с этим достаточно интересной и актуальной представляется возможность изучения общей трипсиноподобной активности плазмы крови (ОТПА) как интегративного параметра, отражающего степень активации протеолитических процессов у больных рожей, активности плазмина как компонента системы фибринолиза, вероятно, ответственной за развитие осложненных геморрагических форм болезни, влияние ингибиторов протеолиза на течение и прогноз заболевания.
Известно, что имеющиеся в арсенале врачей препараты системной энзимотерапии (СЭТ) предположительно реализуют свой фармакологический эффект посредством влияния на протеолитические процессы. На протяжении последних 10–15 лет имеются многочисленные данные об эффективности применения данной группы препаратов в акушерско-гинекологической практике [6, 7], лечении аллергических, иммуноопосредованных и воспалительных заболеваний, в том числе и в сочетании с антибактериальными препаратами [8]. В связи с этим представлялось интересным оценить эффективность препаратов СЭТ и при роже.
Таким образом, целью настоящего исследования явился сравнительный анализ нарушений систем протеолиза у больных рожей нижних конечностей, леченных с применением и без применения СЭТ, а также клиническая оценка ближайших и отдаленных результатов проводимой терапии.
Задачи исследования:
1. Сравнить длительность местных и общих проявлений заболевания у пациентов на фоне стандартной терапии и у больных, дополнительно получающих СЭТ.
2. Определить активность компонентов протеолитической (ОТПА, плазмин) и антипротеолитической (активность α1-антитрипсина, α2-макроглобулина) систем плазмы крови в динамике заболевания в анализируемых группах больных.
3. Провести мониторинг частоты рецидивов рожи спустя 6 месяцев от момента заболевания у пациентов, получавших общепринятую терапию и лечение, дополненное препаратами СЭТ.
4. Оценить целесообразность использования препаратов группы СЭТ в комплексной терапии рожи.
Материалы и методы исследования
В исследование вошли 126 больных первичной и рецидивирующей рожей обоего пола в возрасте от 30 до 65 лет с локализацией процесса на нижних конечностях, госпитализированных в профильное отделение МБУЗ «Городская больница № 1 им. Н.А. Семашко г. Ростова-на-Дону» в течение 2012–2013 гг.. Методом случайной выборки больные были сформированы в 2 группы. В 1-ю группу (группа сравнения) вошли 64 пациента, которым назначалась стандартная терапия (антибактериальные, нестероидные противовоспалительные препараты, местно-фурациллиновые обертывания), 53,2 % (34/64) имели эритематозные (в том числе эритематозно-буллезную) формы заболевания, 46,8 % (30/64) геморрагические (в том числе буллезно-геморрагическую). Во 2-ю (группа, получавшая СЭТ) были включены 62 больных, которым в дополнение к стандартной терапии был назначен препарат СЭТ (Вобэнзим®) в рекомендуемой дозировке 15 таб. в сутки. У 48,4 % (30/62) заболевание протекало в эритематозной форме, у 51,6 % (32/62) – в геморрагической. Половой состав групп не различался между собой, соотношение женщин и мужчин в обеих группах было 3:1. Средний возраст в группах существенных различий не имел (р = 0,28) и составил в группе сравнения 63,0 ± 1,93 года, в группе, получавших препараты СЭТ – 60,3 ± 1,22 года. Вес больных также достоверно не различался (р = 0,742) и составил в 1-й 90,6 ± 3,06 кг, во 2-й – 91,9 ± 3,34 кг. Все больные были госпитализированы в течение первых 3-х суток от момента начала заболевания.
В ходе лечения оценивалась длительность лихорадочного периода и местных проявлений воспалительного процесса (отечность пораженной конечности, гиперемия, буллы, геморрагии). Анализ проводился раздельно для пациентов с эритематозными (эритематозной и эритематозно-буллезной) и геморрагическими (геморрагической и буллезно-геморрагической) формами рожи в каждой из исследуемых групп.
Биохимическими методами в плазме крови больных обеих групп определялись общая трипсиноподобная активность (ОТПА) плазмы крови, активность плазмина (П), α1-антитрипсина (α1-АТ) и α2-макроглобулина (α2-МГ) в первые сутки нахождения в стационаре (до начала антибактериальной терапии) и на 8–10 день стационарного лечения. Активность ОТПА и плазмина определяли по методу Л.П. Алексеенко (1977) и реакции Сакагуши, в современной модификации с использованием в качестве белкового субстрата протаминсульфата, для определения активности плазмина из плазмы крови был получен эуглобулиновый остаток с использованием раствора каолина. Активность α1-АТ и α2-МГ определяли унифицированным методом В.Ф. Нартиковой и Т.С. Пасхиной (1979). За норму были приняты референтные значения исследуемых показателей 25 практически здоровых лиц в возрасте 25–60 лет.
Статистическая обработка результатов проводилась с помощью программы SPSS Statistics V. 20, данные представлены в виде М(SD).
Результаты исследования и их обсуждение
Сравнительный анализ общих и местных проявлений заболевания выявил следующие изменения. У больных с эритематозными (в т.ч. эритематозно-буллезными) формами заболевания в 1-й группе продолжительность местного отека на пораженной конечности составила 9,5 (4,07) дней, что было достоверно выше (р = 0,028), чем во 2-й группе (7,4 (2,47) дней). При геморрагических (в т.ч. буллезно-геморрагических) формах рожи в группе больных, получающих общепринятую терапию отечность конечности наблюдалась в течение 12,5 (3,42) дней, что оказалось существенно длиннее (р = 0,015), чем в группе, получающей СЭТ – 8,2 (2,38) дней.
Продолжительность периода гиперемии при эритематозных формах заболевания в обеих группах достоверно не отличалась между собой (р = 0,39). Однако при геморрагических формах было замечено значительное снижение этого показателя (р = 0,006) во 2-й группе. В 1-й группе гиперемия сохранялась в течение 13,5 (3,42) дней, в то время как во 2-й в течение 8,9 (2,03) дней.
Буллы в 1-й группе при эритематозно-буллезных формах наблюдались в среднем 11,5 (3,96) дней, в то время как во 2-й порядка 8,0(1,85) дней, что было существенно короче (р = 0,05). Наиболее удивительным оказалось сокращение длительности булл более чем в 4 раза при геморрагических формах заболевания с 16,2 (4,71) суток в 1-й группе до 4,0 (1,69) суток во 2-й (р = 0,004). Длительность геморрагических проявлений в группе сравнения и группе с использованием СЭТ также достоверно отличалась более чем в 2 раза (р = 0,001). В 1-й группе она составила 9,6 (2,76) дней, а во 2-й – 4,5 (0,92) дня.
Длительность лихорадочного периода при эритематозных формах существенно не отличалась в обеих исследуемых группах (р = 0,164), в то время как при геморрагических значительно сокращалась в группе с применением СЭТ с 7,1 (4,12) до 3,0 (0,75) дней (р = 0,037).
Таким образом, оптимизация терапии рожи посредством добавления к общепринятым схемам терапии препарата СЭТ, привела к значительному сокращению длительности основных клинических проявлений заболевания у больных с геморрагическими формами рожи и к существенному сокращению длительности местного отека на пораженной конечности и булл при эритематозных формах заболевания.
Выявленные изменения проиллюстрированы на рис. 1 и 2.
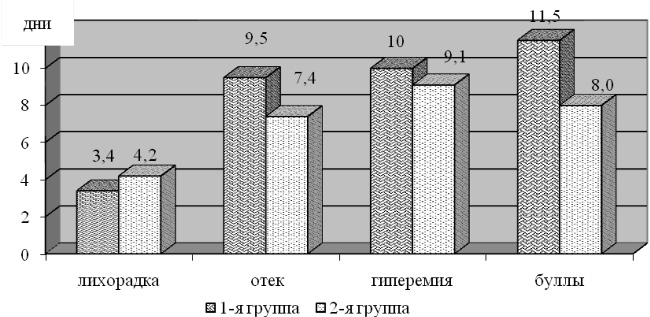
Рис. 1. Длительность местных проявлений (дни) при эритематозных формах рожи
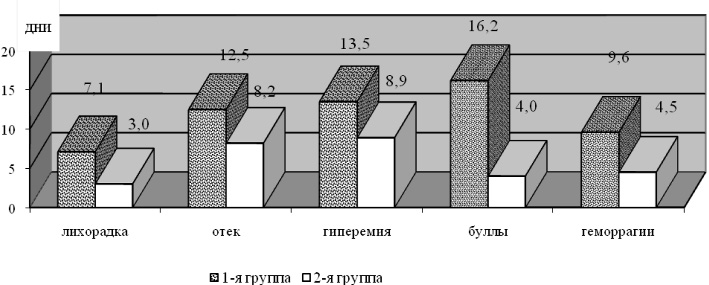
Рис. 2. Длительность местных проявление (дни) при геморрагических формах рожи
В исследуемых биохимических показателях были обнаружены следующие изменения. В острый период заболевания все исследуемые параметры (ОТПА, активность плазмина, α1-антитрипсина, α2-макроглобулина) в обеих группах значительно отличались относительно здоровых (р < 0,0001). При эритематозных формах рожи ОТПА активность плазмина и α1-антитрипсина во 2-й группе оказалась достоверно выше, чем в 1-й (р = 0,011, р = 0,04, р = 0,001 соответственно), что можно объяснить изначально более тяжелым течением заболевания у пациентов, получавших препараты СЭТ. Активность α2-макроглобулина при данной форме достоверно не отличалась в обеих группах (р = 0,069) и была значительно ниже нормы. У больных с геморрагическими формами рожи достоверного различия между указанными параметрами в исследуемых группах выявлено не было. Значения показателей в острый период заболевания приведены в табл. 1.
Таблица 1
Изменение отдельных компонентов протеолитической активности в острый период заболевании М(SD)
|
Группы больных и формы рожи |
Биохимические показатели M(SD) |
р |
|||||||
|
ОТПА мкМ/мл/мин (1) |
Плазмин мкМ/мл/мин (2) |
α1-АТ ИЕ/мл (3) |
α2-МГ ИЕ/мл (4) |
1–9 |
2–9 |
3–9 |
4–9 |
||
|
1-я |
ЭФ (5) |
9,1 (2,09) |
10,7 (1,17)) |
52,0 (7,87) |
3,34 (0,22) |
< 0,0001 |
< 0,0001 |
< 0,0001 |
< 0,0001 |
|
ГФ (6) |
9,9 (1,89) |
13,2 (1,48) |
60,4 (11,2) |
3,0 (0,61) |
|||||
|
2-я |
ЭФ (7) |
10,9 (2,85) |
12,0 (1,29) |
58,6 (9,6) |
3,2 (0,30) |
||||
|
ГФ (8) |
10,0 (1,91) |
13,5 (1,45) |
58,7 (7,63) |
3,23 (0,42) |
|||||
|
Здоровые лица (9) |
5,76 (0,69) |
8,1 (1,23) |
29,5 (5,72) |
4,83 (0,42) |
|||||
|
р |
5–7 |
0,011 |
0,040 |
0,001 |
0,069 |
||||
|
6–8 |
0,745 |
0,408 |
0,564 |
0,387 |
|||||
Примечания: ЭФ – эритематозные формы рожи; ГФ – геморрагические формы рожи.
На фоне проводимой терапии в обеих группах в динамике заболевания происходила нормализация указанных параметров, проявляющаяся существенным снижением ОТПА, активности плазмина, α1-антитрипсина и увеличением активности α2-макроглобулина.
У пациентов с эритематозными формами заболевания, получающих препарат СЭТ Вобэнзим®, было отмечено достоверно более выраженная тенденция к нормализации значений в сторону снижения ОТПА (р = 0,0012) и активности α1-антитрипсина (р = 0,0001), и в сторону повышения активности α2-макроглобулина (р = 0,0001) по сравнению с лицами, получающими общепринятую терапию. Активность плазмина во 2-й группе оказалась несколько ниже, чем в 1-й, но статистически различие между группами оказалось недостоверным. Интересным представляется то, что при сравнении с уровнем здоровых лиц активность плазмина во 2-й группе достоверно от него не отличалась (р = 0,157), в то время как в 1-й группе оказалась существенно выше (p = 0,028). ОТПА и активность α1-антитрипсина в группе, получающей стандартную терапию, на 8–10 день заболевания оставалась достоверно выше уровня здоровых лиц (р = 0,0006, р = 0,001 соответственно), а активность α2-макроглобулина значительно ниже такового (р = 0,001). В противоположность этому во 2-й группе достоверное отклонение от нормы (в сторону повышения) было отмечено лишь при изучения активности α1-антитрипсина (р = 0,0013).
У пациентов с геморрагическими формами рожи также наблюдалось значительное снижение активности плазмина, α1-антитрипсина и ОТПА во 2-й группе относительно 1-й (р1 = р2 = р3 = 0,001) в сторону нормализации. Существенно увеличилась на фоне приема препарата Вобэнзим® активность α2-макроглобулина (р = 0,0001), по сравнению с уровнем его в 1-й группе.
При сравнении показателей с уровнем здоровых лиц было выявлено, что в 1-й группе больных ни один из изучаемых параметров систем протеолиза не достиг нормальных величин. Значения ОТПА, активности плазмина и α1-антитрипсина хотя и снизилось на фоне лечения, но осталось значительно выше нормы (р1 = р2 = 0,0001, р3 = 0,001 соответственно). Активность α2-макроглобулина несколько увеличилась относительно острого периода, но осталась достоверно ниже нормальных значений (р = 0,0001). Во 2-й группе произошло более заметное снижение ОТПА, при этом уровень ее после лечения был статистически не отличим от уровня здоровых лиц (р = 0,211). Активность плазмина также снизилась до уровня, неотличимого от нормы (р = 0,040). Значительно выше первоначального уровня на фоне усиленной терапии оказалась активность α2-макроглобулина, ее значение в отличие от 1-й группы во 2-й не отличалось от нормы (р = 0,358). При этом между увеличением его активности и снижением активности плазмина во 2-й группе отмечена сильная обратная коррелятивная связь (r = 0,755). В группе сравнения (1-я) между активностью плазмина и α2-макроглобулина также отмечалась обратная корреляционная зависимость, но степень ее была меньше (r = 0,460). В динамике заболевания активность α1-антитрипсина на 8–10 день во 2-й группе снизилась в большей степени, чем в 1-й (р1 = 0,0011, р2 = 0,0001), но все равно осталась на более высоком по сравнению с нормой уровне (р = 0,001). Значения всех исследуемых показателей приведены в табл. 2.
Таблица 2
Изменение отдельных компонентов протеолитической активности в динамике заболеваний в зависимости от проводимого лечения М(SD)
|
Группы больных и формы рожи |
Биохимические показатели M(SD) |
р |
||||||||
|
ОТПА мкМ/мл/мин (1) |
Плазмин мкМ/мл/мин (2) |
α1-АТ ИЕ/мл (3) |
α2-МГ ИЕ/мл (4) |
1–9 |
2–9 |
3–9 |
4–9 |
|||
|
1-я |
ЭФ (5) |
6,95 (0,94) |
9,2 (1,40) |
42,6 (4,67) |
3,8 (0,34) |
0,0006 |
0,028 |
0,001 |
0,001 |
|
|
ГФ (6) |
7,82 (1,51) |
11,2 (1,36) |
47,3 (6,98) |
3,6 (0,43) |
0,0001 |
0,0001 |
0,001 |
0,0001 |
||
|
2-я |
ЭФ (7) |
6,0 (0,71) |
8,6 (1,11) |
38,4 (5,06) |
4,9 (0,53) |
0,157 |
0,219 |
0,0013 |
0,487 |
|
|
ГФ (8) |
6,1 (0,57) |
9,4 (1,43) |
39,3 (3,1) |
5,0 (0,52) |
0,211 |
0,040 |
0,001 |
0,358 |
||
|
Здоровые лица (9) |
5,76(0,69) |
8,1 (1,23) |
29,5 (5,72) |
4,83 (0,42) |
||||||
|
р |
5–7 |
0,0001 |
0,163 |
0,0001 |
0,0001 |
|||||
|
6–8 |
0,001 |
0,001 |
0,001 |
0,0001 |
||||||
Примечания: ЭФ – эритематозные формы рожи; ГФ – геморрагические формы рожи.
Таким образом, использование препаратов СЭТ в комплексной терапии рожи привело не только к значительному снижению, но и к нормализации основных компонентов протеолитической активности и одного из двух компонентов антипротеолитической системы.
При последующем наблюдении за реконвалесцентами рожи в 1-й группе, получавшей стандартную терапию, в течение ближайших 6 месяцев было отмечено 6 случаев рецидивов рожи (9,37 %). Во 2-й группе не было отмечено ни одного рецидива в течение периода наблюдения.
Выявленные в обеих группах больных рожей изменения протеолитической активности в острый период заболевания свидетельствуют об интенсификации протеолитических процессов на фоне бактериального воспаления и отражают тяжесть течения заболевания, что подтверждают и ранее проведенные нами исследования. ОТПА, будучи интегративным параметром, характеризует функционирование калликреин-кининовой системы, системы гемостаза и фибринолиза, с одной стороны, и отражает активацию некоторых факторов неспецифической резистентности, с другой [9]. Плазмин является ключевым протеолитическим ферментом, отражающим функционирование системы фибринолиза [10]. Вполне логично, что увеличение его активности у больных с геморрагическими формами рожи обусловливает развитие тяжелых форм заболевания. Выявленное повышение уровня α1-антитрипсина также свидетельствует об интенсивно протекающем воспалении и повреждении тканей. Являясь главным компонентом антипротеолитической системы, он обеспечивает от 75 до 90 % антипротеолитического потенциала плазмы [10, 11]. Главным образом, его ингибиторное действие направлено на эластазу, протеазы нейтрофилов, протеолитические ферменты, выделяемые микроорганизмами, макрофагами, в меньшей степени на тромбин, плазмин, плазменный калликреин, фактор Хагемана [11]. Обнаруженное снижение активности α2-макроглобулина, наиболее сильно выраженное у больных с геморрагическими формами рожи, свидетельствует о его роли в регуляции системы фибринолиза, вероятнее всего, посредством изменения активности плазмина.
Снижение ОТПА в динамике заболевания в группе пациентов, получавших СЭТ, до уровня здоровых отражает более интенсивный и полноценный ответ организма на внедрение возбудителя, косвенным подтверждением чего является сокращение длительности местных проявлений во 2-й группе и отсутствие ранних рецидивов заболевания. Тенденция к снижению активности α1-антитрипсина, более выраженная на фоне приема препаратов СЭТ, также отражает укорочение сроков реконвалесценции в исследуемой группе. Наиболее интересным нам представляется изменение активности плазмина и α2-макроглобулина у больных, получавших Вобэнзим®. Рядом авторов механизм действия этого препарата связывается как раз с модификацией последнего [12]. При этом отсутствуют четкие сведения о том, каким именно изменениям может подвергаться этот белок и какое действие они окажут на течение патологического процесса. Обнаруженная нами сильная обратная корреляционная связь между увеличением активности α2-макроглобулина и снижением активности плазмина во 2-й группе в динамике заболевания подтверждает более интенсивное снижение процессов фибринолиза на фоне СЭТ, следовательно, и минимизацию риска присоединения геморрагических осложнений.
Кроме этого, взаимосвязь между этими показателями, что подтверждает наличие умеренной связи между ними и в 1-й группе (r = 0,46), позволяет прогнозировать развитие геморрагических форм заболевания. С другой стороны, само по себе увеличение активности α2-макроглобулина может быть признаком усиления иммунного ответа. Имеется ряд работ, указывающих на роль этого белка в иммунных реакциях [13]. Кроме того, α2-МГ синтезируется также и лимфоидными клетками и может влиять на их реакции [13]. Очевидно, что препараты СЭТ ускоряют динамику классических этапов развития воспаления, стимулируя факторы неспецифической и специфической резистентности организма, приводя, в конечном итоге, к более быстрому его разрешению.
Весьма интересным и значимым представляется значительное сокращение длительности местных проявлений рожи на фоне приема СЭТ. Если сокращение периода геморрагий вполне логично объяснимо снижением интенсивности фибринолиза, то более быстрое заживление кожных покровов и снижение длительности булл требуют определенных пояснений. Известно, что заживление повреждений и формирование рогового слоя эпидермиса морфологически обусловлено созреванием ряда белков, одним из которых является профилаггрин. Образование из него филаггрина происходит ферментативным путем с участием каспазы-14. [14]. Активация этого фермента происходит по механизму частичного протеолиза с участием каскада тканевых калликреинов – белков, обладающих собственной протеолитической активностью [15].
α2-МГ обладает свойствами не только ингибитора, но и рестриктора протеолиза, поскольку, связываясь с ним в кровяном русле, протеазы обратимо теряют часть своей протеолитической активности. В таком случае последующее попадание его в очаг местного воспаления может сопровождаться локальным усилением протеолитической активности за счет высвобождения ферментов из комплекса с α2-МГ.
Результатом этого может быть, по нашему мнению, во-первых, санация очага, что способствовало бы предупреждению рецидивов в последующем (что мы и наблюдаем на практике), во-вторых, ускорение созревания филаггрина, опосредованное активацией тканевых калликреинов или непосредственно каспазы-14. Безусловно, отдельные механизмы данного процесса требуют дальнейшего изучение и уточнения.
Выводы
1. Оптимизация терапии рожи путем добавления в стандартные схемы препаратов группы СЭТ приводит к заметному сокращению основных общих и местных клинических проявлений заболевания вне зависимости от формы местного воспаления.
2. На фоне приема СЭТ в динамике заболевания отмечается более быстрая нормализация исследуемых компонентов протеолитической (ОТПА, плазмин и антипротеолитической (α1-АТ, α2-МГ) активности плазмы крови, особенно при геморрагических ее формах.
3. Терапия рожи в остром периоде с использованием СЭТ позволяет резко сократить (вплоть до полного их отсутствия) число ранних рецидивов заболевания.
4. Сокращение продолжительности острого периода заболевания, быстрая динамика нормализации систем протеолиза и нивелирование ранних рецидивов заболевания на фоне приема СЭТ позволяет рекомендовать использование данной группы препаратов в комплексной терапии рожи.
Рецензенты:Амбалов Ю.М., д.м.н., профессор, заведующий кафедрой инфекционных болезней, ГБОУ ВПО «Ростовский государственный медицинский университет» Минздрава РФ, г. Ростов-на-Дону;
Твердохлебова Т.И., д.м.н., директор Ростовского научно-исследовательского института микробиологии и паразитологии, г. Ростов-на-Дону.
Работа поступила в редакцию 18.02.2014.
Библиографическая ссылка
Московая Т.В., Пшеничная Н.Ю., Добаева Н.М. ПРОТЕОЛИТИЧЕСКИЕ СИСТЕМЫ ПРИ РОЖЕ: КОНЦЕПЦИЯ НАРУШЕНИЙ И ОПТИМИЗАЦИЯ ТЕРАПИИ // Фундаментальные исследования. – 2014. – № 4-1. – С. 122-128;URL: https://fundamental-research.ru/ru/article/view?id=33680 (дата обращения: 25.04.2024).



