Адаптация животного организма к аллоксановому экспериментальному диабету представляет сложный многоэтапный процесс, главным звеном которого является трансформация клеточного метаболизма. Индукция ферментов глиоксилатного цикла и цикла трикарбоновых кислот в тканях животных обеспечивает изменение основных путей метаболизма, обусловленных ресинтезом гликогена в печени крыс при патологиях, связанных с условиями пищевой депривации и экспериментального диабета [2, 10]. Кроме того, что глюконеогенез выступает как важнейший процесс при адаптивной реакции организма к экстремальным условиям, важную роль играет энергетический обмен, связанный, главным образом с функционированием цикла Кребса. Следовательно, адаптация клеточного метаболизма обеспечивается соотношением интенсивности катаболизма и анаболизма глюкозы в клетках печени и других органов животного организма. Несмотря на значительное количество исследований об интенсивности ферментативной активности, обусловливающей скорость энергетического и синтетического процессов, остаются невыясненными многие факторы регуляции, такие как концентрация метаболитов, воздействие гормонов и другие [4].
В литературе широко представлены работы об особенностях клинико-биохимических показателей при сахарном диабете. Данные морфологических исследований немногочисленны и зачастую разноплановы. В последнее время большое внимание исследователей направлено на изучение состояния нейроэндокринных центров и выяснение их участия в регуляции функций панкреатических островков [5].
Особый интерес вызывает молекулярный уровень регуляции ферментов ЦТК и глиоксилатного цикла, связанный с экспрессионной регуляцией ферментов. Ранее было показано наличие двух изоформ аконитатгидратазы, малатдегидрогеназы. Однако исследований по генетической детерминации изоферментного полиморфизма этих и других ферментных систем в животных организмах в условиях экспериментального диабета нами не обнаружено. В связи с этим целью данной работы являлось комплексное исследование физиолого-биохимических механизмов адаптации крыс при аллоксановом диабете.
Материалы и методы исследования
В качестве объектов исследования служили самцы лабораторных крыс (Rattus rattus L.) массой 200–250 гр., выращенные в виварии при стандартном рационе. Индукцию диабета у исследуемых животных вызывали введением внутрибрюшинно 5 % раствора аллоксана из расчета 100 мг на кг веса животного в 0,9 % растворе NaCI. Контрольные животные выращивались при обычном пищевом режиме, без введения аллоксана.
Для получения ткани печени, почек и поджелудочной железы опытных животных подвергали краниоцервикальной дислокации под эфирным наркозом.
Определение глюкозы производили стандартным глюкозооксидазным методом с помощью глюкометра «Сателлит плюс» (Россия).
Определение активности ферментов проводили при 25 °С с помощью спектрофотометрических методов [4].
Для выделения суммарной клеточной РНК использовался метод фенол-хлороформной экстракции с использованием в качестве осадителя LiCl [9].
Полимеразную цепную реакцию генспецифичными праймерами проводили с помощью набора реактивов AmpliSence (Хеликон, Россия) на приборе Bio-Rad DNA Engine Thermal Cycler Chromo 4 (Bio-Rad, США), используя в качестве красителя SYBR Green. Параметры амплификации: предварительная денатурация 95 °С – 5 мин, затем цикл: 95 °С – 20 с, 58 °С – 30 с, 72 °С – 40 с (детекция), финальная элонгация – 72 °С – 10 мин.
Фиксацию материала осуществляли по методике, предложенной Волковой [1]. Образцы уплотняли для последующей работы на микротоме. Предварительно образцы обезвоживали путем погружения на 24 часа в растворы спиртов разных концентраций. Заливку проводили инкубацией образцов в смесь ксилол-парафин и затем в жидкий парафин на 1–2 ч при 52–56 °С. Срезы приготавливали при помощи микротома 4/MedGV (Micros, Германия) [6]. Окраску препарата проводили с применением гематоксилин-эозина по ранее разработанной методике [8].
Опыты проводили в 3–4-кратной повторности, аналитические определения для каждой пробы осуществляли в трех повторностях [7].
Результаты исследования и их обсуждение
Введение аллоксана подопытным животным способствовало увеличению концентрации глюкозы в крови до 15,8 ммоль/л через 10 дней после инъекции. Проведение данных анализов в динамике в течение 21 дня позволило выявить определенные закономерности. Максимальное значение этого показателя в крови опытных крыс достигало 17,31 ммоль/л. Следовательно, при экспериментальном сахарном диабете происходила мобилизация эндогенных сахаров, которые в печени крысы представлял гликоген.
Анализ полученных данных позволяет выявить определенные тенденции в изменении исследуемых показателей. Так, масса тела контрольных животных увеличивалась в течение всего эксперимента. Ее колебания составляли от 197 г в первый день до 217 г на 21 день. Следовательно, крысы контрольной группы увеличивали свою массу в течение всего опыта на 11,3 %. Противоположная картина обнаружена для данного показателя в экспериментальной группе животных. Динамика изменения массы печени и почек не являлась одинаковой для этих органов. Масса печени, составлявшая 6,49 г в начале опыта у контрольных животных, достигала величины 6,7 г. У экспериментальных животных после введения экзогенного аллоксана масса этого органа уменьшилась с 6,35 до 4,83 г через 21 день экспозиции, что означало 24 %-е снижение массы печени.
Анализ полученных результатов по изменению массы тела и внутренних органов крыс позволяет предположить, что выявленные эффекты связаны с действием экспериментального диабета.
Анализ данных гистологических исследований образцов печени крыс экспериментальной группы свидетельствовал о том, что применение аллоксана вызывало индукцию сахарного диабета, проявляющегося в изменении морфологических особенностей тканей исследуемого органа. В целом при экспериментальном аллоксановом диабете в паренхиме печени исследуемых животных прослеживались выраженные признаки токсического гепатита в виде нарушения балочной структуры долек, некроза гепатоцитов, жировой и белковой дистрофии, наличия инфильтратов из скоплений гематогенных клеток.
Морфологические изменения в ткани поджелудочной железы крыс после введения аллоксана характеризовались наиболее выраженными дегенеративными изменениями в центральных отделах островков Лангерганса (рис. 1). Количество β-клеток в островках резко снижено, в большинстве из них отмечалась вакуолизация цитоплазмы, уменьшение размеров ядер, конденсация хроматина, в некоторых клетках – кариопикноз. Выявлено наличие лимфоцитарного инфильтрата по периферии части островков, отека междольковой соединительной ткани, полнокровие капилляров; в сосудах прослеживались стазы.
а 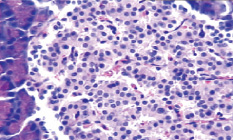 б
б 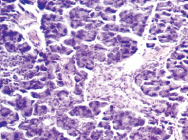
Рис. 1. Островковый аппарат поджелудочной железы крысы интактной группы (А) и после введения аллоксана (Б). Окраска гематоксилином-эозином; об. х20
Таким образом, цитотоксическое воздействие аллоксана и инсулиновая недостаточность вызывали патоморфологические изменения в островковой части поджелудочной железы, носящие выраженный деструктивный характер, причем токсическому воздействию в наибольшей степени подвергались β-клетки и компоненты микроциркуляторного русла.
Результаты исследования показали, что в печени крыс с аллоксановым диабетом наблюдается активация маркерного фермента ЦТК – сукцинатдегидрогеназы (СДГ), активность которого увеличилась у опытных животных в 1,77 раза. Увеличение активности сукцинатдегидрогеназы в печени крыс свидетельствует об интенсификации функционирования цикла Кребса в условиях аллоксанового диабета, что, по-видимому, необходимо для энергизации клеточного дыхания и усиления поставок энергетических эквивалентов АТФ, НАДН для адаптации клеточного метаболизма в гепатоцитах.
Активность цитоплазматической формы малатдегидрогеназы (МДГ) в образцах опытных животных составляет 9,38 Е/мг белка, а в контрольных – 4,36 Е/мг белка. Однако иная картина наблюдалась при анализе изменения активности митохондриальной формы малатдегидрогеназы. У крыс в условиях аллоксанового диабета обнаружено резкое увеличение скорости функционирования МДГ в 3,96 раза относительно контрольного варианта.
В наших исследованиях было показано, что активность цитоплазматической аконитатгидратазы (АГ) в опытных образцах по сравнению с контролем уменьшилась в 3,8 раза. Что касается митохондриальной формы, то здесь наблюдается увеличение активности в 3 раза относительно контрольного варианта. В гепатоцитах доминируют реакции синтетического или конструктивного характера, в частности, глюконеогенез, одним из этапов которого является ГЦ. Именно в протекании данного пути принимает участие аконитатгидратаза.
Уровень активности сукцинатдегидрогеназы в исследуемом органе нормальных крыс составлял 0,4 Е/мг белка. У экспериментальных животных поджелудочная железа имела невысокий уровень активности СДГ равный 0,14 Е/мг белка, то есть экспериментальный диабет подавлял функционирование маркерного фермента.
Изменение активности малатдегидрогеназы в разных фракциях клеток поджелудочной железы в контроле и опыте имело определенные тенденции. Уровень активности изучаемого фермента в клетках поджелудочной железы крыс, подвергшихся воздействию аллоксанового диабета, был выше по сравнению с опытными животными.
Уровень активности аконитатгидратазной ферментной системы определяет направление реакций так называемого аконитазного равновесия. Величина аконитазной активности в поджелудочной железе в опытных вариантах возрастала в 2–2,5 раза и составляла значение 0,25 Е/мг белка для цитоплазматической формы и 2,5 Е/мг белка для митохондриального фермента. Следовательно, повышение интенсивности функционирования аконитатгидратазного ферментного комплекса наблюдается как в цитоплазматической фракции, так и в митохондриальной.
Результаты исследования ПЦР-РВ приведены на рис. 2, из которого видно, что в печени крыс при пищевой депривации концентрация транскрипта исследуемого генов МДГ выше такового показателя у контрольных в более чем в 2 раза, что свидетельствует об интенсификации их экспрессии.
Расчетные значения относительной концентрации кДНК гена митохондриальной аконитатгидратазы и сукцинатдегидрогеназы в разных образцах отличаются между собой. Из полученных данных видно, что в печени крыс с аллоксановым диабетом концентрация их транскриптов выше такового показателя у контрольных почти в 3 раза.
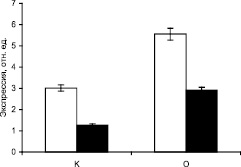
Рис. 2. Экспрессия генов малатдегидрогеназы в печени крыс в норме и при аллоксановом диабете. К – контрольные животные, О – животные с аллоксановым диабетом
Данные по экспрессии генов СДГ, МДГ, АГ свидетельствуют, что при диабете активация ферментов происходит на уровне транскрипции соответствующих генов. В условиях аллоксанового диабета наблюдается изменение транскрипционной активности ДНК клеток печени, следовательно, увеличивается скорость экспрессия исследуемых генов.
Заключение
Использование в нашем исследовании экзогенного аллоксана, вводимого подкожно крысам, позволило создать модель экспериментального диабета у животных. Индукция диабета наблюдалась в течение трехнедельного эксперимента. У опытных животных было выявлено изменение массы тела и внутренних органов, характерное для данного заболевания. Проведенные гистологические исследования тканей печени и поджелудочной железы также свидетельствуют о патологических изменениях у экспериментальных крыс, при этом наибольшее токсическое действие наблюдалось печени исследуемых животных.
Использование методов молекулярной биологии позволило установить, что индукция активности СДГ, АГ и МДГ осуществляется благодаря синтезу de novo. Это вытекает из полученных данных, свидетельствующих о резком повышении уровня экспрессии генов sdha, mdh_mtx и aco, кодирующих эти энзимы.
Таким образом, показано, что адаптация крыс к условиям аллоксанового диабета осуществляется на нескольких уровнях. Патоморфологические изменения в островковой части поджелудочной железы и нарушение балочной структуры долек гепатоцитов сопряжены с трансформацией основных путей клеточного метаболизма, обеспечиваемой изменением функционирования ключевых ферментов цикла Кребса и глиоксилатного пути (СДГ, МДГ и АГ).
Рецензенты:
Свистова И.Д., д.б.н., профессор кафедры биологии растений и животных, ФГБОУ ВПО «Воронежский государственный педагогический университет», г. Воронеж;
Алабовский В.В., д.м.н., профессор, зав. кафедрой биохимии, ФГБОУ ВПО «Воронежская государственная медицинская академия имени Н.Н. Бурденко», г. Воронеж;
Хисматуллина З.Р., д.б.н., профессор, доцент, заведующая кафедрой морфологии и физиологии человека и животных биологического факультета, ГОУ ВПО «Башкирский государственный университет», г. Уфа.
Работа поступила в редакцию 16.12.2013.
Библиографическая ссылка
Гати Моханнад Абдулраззак Гати, Федорин Д.Н., Полякова-Семенова Н.Д., Вашанов Г.А., Епринцев А.Т. ФИЗИОЛОГО-БИОХИМИЧЕСКИЕ АСПЕКТЫ АДАПТАЦИИ КРЫС К УСЛОВИЯМ АЛЛОКСАНОВОГО ДИАБЕТА // Фундаментальные исследования. – 2013. – № 11-3. – С. 465-469;URL: https://fundamental-research.ru/ru/article/view?id=33144 (дата обращения: 19.04.2024).



