Возможность использования диоксида титана в качестве реагента для концентрирования и извлечения примесей из воды изучается в последнее время все более активно [4,9]. Диоксид титана химически инертное вещество, для реализации его сорбционных возможностей требуется предварительное активирование поверхности путем создания на ней активных функциональных групп. Известны способы активирования TiO2 путем обработки кислотами и щелочами или нанесением на его поверхность групп-комплексообразователей [7]. Другим направлением в активировании поверхности TiO2 является его обработка с помощью электрофизических методов: облучением потоком электронов, ультразвуковой и/или электроискровой обработкой и другими видами воздействия [3]. Перспективным направлением для активирования поверхности диоксида титана является воздействие на нее постоянным электрическим полем [8], но этот процесс изучен недостаточно подробно.
Цель настоящей работы – формирование на поверхности диоксида титана функциональных групп, активных по отношению к сорбции растворимых ионов металлов, путем его обработки постоянным электрическим полем в дистиллированной воде и в растворе хлорида натрия.
Методики эксперимента и характеристика объекта исследования
В работе использовали порошок диоксида титана, полученный гидролизом реактива TiCl4 с последующим прокаливанием при 600 °С.
В качестве среды при обработке постоянным электрическим полем в работе выбраны: дистиллированная вода (среда сравнения) и 0,2 н раствор NaCl, которые не приводят к изменению pH.
При выполнении работы для определения вида функциональных групп на поверхности диоксида титана (ИК-Фурье спектрофотометр Nicolet 5700) использована инфракрасная спектроскопия (ИКС) пропускания. Идентификацию функциональных групп, связанных с поглощением в ИК-спектре, проводили с использованием литературных данных [5]. Количественное определение содержания растворимых примесей ионов Fe(II), Mn(II) и Ni(II) в воде проводили с использованием стандартных методик фотоколориметрии (фотометр КФК-3-01). Постоянное электрическое поле создавали путем подключения плоских титановых электродов марки ВТ-1.0 (расстояние между электродами l = 12 см, U = 200 В) к источнику напряжения Laboratory DC powersupply «Instek». Обработку суспензий диоксида титана в воде и в растворе хлорида натрия проводили в ультразвуковой ванне (22 кГц, 0,15 Вт/см2).
Результаты исследования и их обсуждение
После перемешивания суспензии ультразвуком (10 мин) в дистиллированной воде и воздействия постоянного электрического поля (30 мин) пробу диоксида титана отбирали из середины межэлектродного пространства (образец S1, табл. 1), высушивали и записывали ИК-спектр пропускания в области 400–4000 см–1 (рисунок, а) путем запрессовывания образца в бромид калия.
ИК-спектр поглощения данного образца характеризуется широкой полосой ν (Ti = O) с максимумом 697 см–1 и краем поглощения, равным 719 см–1. Эта полоса перекрывается с полосой поглощения ν (Ti–O) = 1024–1030 см–1. В спектре имеется полоса поглощения δ (H–O–H) = 1628, 1696 см–1. В области спектра 1700–2500 см–1 других полос не наблюдается. В спектре присутствует широкая полоса поглощения ν (O–H) с максимумом 3383 см–1, которая заканчивается при ν (O–H) = 3700 см–1. Интенсивность полосы поглощения ν (Ti = O) равна 88 %, а ν (O–H) – 43 %.
В то же время ИК-спектр пропускания диоксида титана, взятого у положительно заряженного электрода (образец S2, табл. 1), существенно отличается от предыдущих спектров (рисунок, б). Максимум полосы поглощения ν (Ti = O) = 532 см–1, край этой полосы наблюдается при 710 см–1и практически совпадает с предыдущими спектрами. В области ν (Ti-O) с максимумом 1011 см–1 присутствует полоса более интенсивного поглощения, и в области δ (H–O–H) наблюдается сдвоенная полоса 1627, 1680 см–1. В диапазоне длин волн 1800–2500 см–1 заметного поглощения не обнаружено. В то же время ν (O–H) с максимумом 3382 см–1 заметно интенсивнее в сравнении с предыдущими спектрами: поглощение в этой полосе снижается при ν (O–H) = 3700 см–1. Если интенсивность полосы ν (Ti = O) составляет 89,5 %, то ν (O–H) – 49,0 %.
Проба диоксида титана, обработанного в дистиллированной воде, отобранная вблизи отрицательно заряженного электрода (образец S3, табл. 1), после высушивания имеет сходный с образцом S1 ИК-спектр пропускания. Интенсивность полосы поглощения ν (Ti = O) также равна 88 %, а интенсивность ν (O–H) только 26 %.
Для сравнения структуры поверхности диоксида титана, обработанного постоянным электрическим полем в дистиллированной воде, образец TiO2 подвергали обработке постоянным электрическим полем в среде 0,2 н раствора NaCl. Пробы образца отбирали аналогично: из середины межэлектродного пространства, вблизи положительно и отрицательно заряженных электродов (образцы S4, S5 и S6 соответственно, табл. 1).
Максимум полосы поглощения ν (Ti = O) образца S4 равен 700 см–1, край его полосы поглощения соответствует 710 см–1. Широкая неразрешенная полоса в области 950–1200 см–1 проявляется в виде перегиба. В спектре имеется полоса поглощения δ (H–O–H) с двумя максимумами: 1620 (интенсивнее) и 1680 см–1. В области 1680–2600 см–1 имеются слабые полосы поглощения. Широкая полоса ν (O-H) наблюдается в диапазоне 2600–3700 см–1 с максимумом 3454 см–1. Абсолютное значение интенсивности полос ν (Ti = O) составляет 77 %, аν (O–H) – 35 %.
Диоксид титана, отобранный вблизи положительно заряженного электрода (образец S5, табл. 1), имеет полосу поглощения ν (Ti = O) = 656 см–1 (максимум), край этой полосы равен 704 см–1. Неразрешенная полоса ν (Ti-O) имеет ширину 970–1170 см–1. Полоса поглощения δ (H–O–H) характеризуется тремя максимумами: 1627 (максимально), 1644 и 1660 см–1. В диапазоне от 1880 до 2580 см–1 также имеются слабые полосы поглощения. Широкая полоса ν (O–H) наблюдается в диапазоне 2600–3700 см–1 с максимумом 3340 см–1. Интенсивность полосы поглощения ν (Ti = O) равна 88 %, а полосы ν (O–H) равна 37 %.
Расположенный у отрицательно заряженного электрода диоксид титана (образец S6, табл. 1) имеет значительные отличия от всех рассмотренных ранее образцов по характеристике спектра. Полоса поглощения ν (Ti = O) имеет максимум, равный 560 см–1, с краем в области 732 см–1. Неразрешенная полоса ν (Ti–O) характеризуется большей шириной 940–1160 см–1. Полоса поглощения δ (H–O–H) имеет два максимума: 1635 (больший) и 1650 см–1. В диапазоне от 1870 до 2250 см–1 имеются слабые полосы поглощения. Широкая полоса δ (H–O–H) наблюдается в диапазоне 2600–3700 см–1 с максимумом 3450 см–1. Интенсивность полосы поглощения ν (Ti = O) равна 82 %, а – ν (O-H) равна 37 %.
а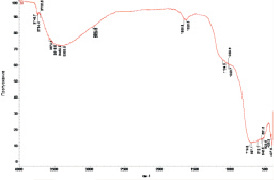 б
б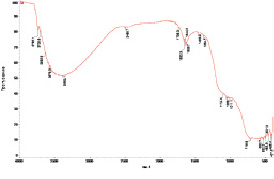
ИК-спектр пропускания образца TiO2 из середины межэлектродного пространства, обработанного постоянным электрическим полем: а – в дистиллированной воде; б – в растворе хлорида натрия
Таблица 1
Образцы диоксида титана, подвергнутые обработке ультразвуком и постоянным электрическим полем в среде различных электролитов
|
№ п/п |
Обозначение образца |
Среда обработки |
|
1 |
Образец S0 |
Не подвергался обработке |
|
2 |
Образец S1 |
Дистиллированная вода (межэлектродное пространство) |
|
3 |
Образец S2 |
Дистиллированная вода (у положительно заряженного электрода) |
|
4 |
Образец S3 |
Дистиллированная вода (у отрицательно заряженного электрода) |
|
5 |
Образец S4 |
Раствор хлорида натрия (межэлектродное пространство) |
|
6 |
Образец S5 |
Раствор хлорида натрия (у положительно заряженного электрода) |
|
7 |
Образец S6 |
Раствор хлорида натрия (у отрицательно заряженного электрода) |
Сорбционные свойства диоксида титана, обработанного постоянным электрическим полем в дистиллированной воде и растворе хлорида натрия, изучали на модельных растворах ионов двухвалентных металлов: Fe – 3,00 мг/л, Ni и Mn – 1,00 мг/л. В качестве образца сравнения использовали диоксид титана, который не подвергали дополнительной обработке (образец S0, табл. 1).
Сорбцию проводили в статических условиях, помещая по 0,2 г образцов диоксида титана (табл. 1) в 100 мл модельных растворов, приготовленных растворением точных навесок сульфатов никеля, железа и марганца. Контроль концентрации растворимых ионов железа (II), марганца (II) и никеля (II) после сорбции осуществляли с помощью стандартных методик фотоколориметрии [1, 2, 6]. Точность экспериментов обеспечивали построением калибровочных графиков и статистической обработкой полученных данных с вероятностью P = 0,95: для железа – в диапазоне концентраций от 0,01 до 3,00 мг/л, для марганца и никеля – от 0,005 до 1,000 мг/л.
Результаты определения концентрации растворимых ионов металлов в модельных растворах после сорбции диоксидом титана (образец S0) и образцами, полученными обработкой TiO2 постоянным электрическим полем в дистиллированной воде (образцы S1, S2, S3) и растворе хлорида натрия (образцы S4, S5, S6), приведены в таблицах: 2 – ионов железа, 3 – марганца, 4 – никеля.
Согласно данным таблиц 2–4, установлено, что воздействие постоянного электрического поля на реактив диоксида титана заметно влияет на его сорбционные свойства. Образцы диоксида титана, находящиеся вблизи положительно заряженного электрода, в большей степени снижают концентрацию ионов железа, марганца и никеля по сравнению с образцами, находившимися у отрицательно заряженного электрода.
Максимальное снижение концентрации примесей железа наблюдалось для образца S4: с 3,00 до 0,54 мг/л, минимальное – для образца S3 – до 1,73 мг/л (табл. 2).
Примеси ионов марганца и никеля эффективнее снижал образец S1 с 1,00 до 0,19 и 0,20 мг/л соответственно, а минимально – образец S0: до 0,53 для ионов марганца и до 0,50 мг/л для ионов никеля (табл. 3–4).
Таблица 2
Содержание примесей ионов железа после их сорбции образцами диоксида титана, полученного обработкой постоянным электрическим полем
|
Образцы сорбента |
TiO2 в H2O |
TiO2 в NaCl |
TiO2 |
|||||
|
S1 |
S2 |
S3 |
S4 |
S5 |
S6 |
S0 |
||
|
Введено ионов железа (II), мг/л |
3,00мг/л |
3,00 мг/л |
3,00 мг/л |
3,00 мг/л |
3,00 мг/л |
3,00 мг/л |
3,00 мг/л |
|
|
Найдено, мг/л |
20 мин |
2,27 |
2,40 |
2,42 |
2,45 |
2,67 |
2,52 |
2,02 |
|
60 мин |
2,06 |
2,15 |
2,10 |
1,76 |
1,73 |
1,81 |
1,90 |
|
|
24 ч |
1,43 |
1,64 |
1,73 |
0,54 |
0,77 |
0,75 |
0,94 |
|
Таблица 3
Содержание примесей ионов марганца после их сорбции образцами диоксида титана, полученного обработкой постоянным электрическим полем
|
Образцы сорбента |
TiO2 в H2O |
TiO2 в NaCl |
TiO2 |
|||||
|
S1 |
S2 |
S3 |
S4 |
S5 |
S6 |
S0 |
||
|
Введено ионов марганца (II), мг/л |
1,00 мг/л |
1,00 мг/л |
1,00мг/л |
1,00 мг/л |
1,00 мг/л |
1,00 мг/л |
1,00 мг/л |
|
|
Найдено, мг/л |
20 мин |
0,31 |
0,35 |
0,33 |
0,31 |
0,38 |
0,40 |
0,56 |
|
60 мин |
0,27 |
0,32 |
0,30 |
0,21 |
0,34 |
0,36 |
0,53 |
|
|
24 ч |
0,19 |
0,24 |
0,22 |
0,25 |
0,34 |
0,35 |
0,53 |
|
Таким образом, снижение концентрации растворимых примесей ионов железа, марганца и никеля после их сорбции с использованием исходного диоксида титана и образцов, прошедших обработку постоянным электрическим полем в дистиллированной воде и растворе хлорида натрия в среднем составило: для необработанного TiO2 (S0) – в 2,4 раза; для обработанных в дистиллированной воде: S1 – в 4,1; S2 – 3,5; S3 – 3,4 раз; для диоксида титана, обработанного в растворе хлорида натрия: S4 – в 4,7; S5 – 3,5 S6 – 3,4 раза.
Таблица 4
Содержание примесей ионов никеля после их сорбции образцами диоксида титана, полученного обработкой постоянным электрическим полем
|
Образцы сорбента |
TiO2 в H2O |
TiO2 в NaCl |
TiO2 |
|||||
|
S1 |
S2 |
S3 |
S4 |
S5 |
S6 |
S0 |
||
|
Введено ионов никеля (II), мг/л |
1,00 мг/л |
1,00 мг/л |
1,00 мг/л |
1,00 мг/л |
1,00 мг/л |
1,00 мг/л |
1,00 мг/л |
|
|
Найдено, мг/л |
20 мин |
0,41 |
0,45 |
0,46 |
0,39 |
0,41 |
0,44 |
0,61 |
|
60 мин |
0,43 |
0,43 |
0,42 |
0,37 |
0,39 |
0,40 |
0,56 |
|
|
24 ч |
0,20 |
0,22 |
0,25 |
0,22 |
0,28 |
0,30 |
0,50 |
|
Лучшие результаты по очистке воды от растворимых примесей железа (II) получены с использованием в качестве сорбента необработанного постоянным электрическим полем и раствором электролита диоксида титана (время контакта – 20 мин). Через 60 мин сорбции концентрация ионов железа (II) максимально снизилась с 3,00 до 1,73 мг/л, с использованием образца S5 (табл. 1) но уже через 24 часа лучшие результаты были получены с использованием образца S4 (табл. 1).
Изучение процесса сорбции ионов марганца (II) показало, что через 20 мин сорбции лучшие результаты получены для образцов S1 и S4: концентрация примеси снизилась от 1,00 до 0,31 мг/л. Через час сорбции максимальное снижение концентрации примесей зафиксировано для образца S4: концентрация снизилась до 0,21 мг/л. При увеличении времени сорбции до 24 часов на образце S1 установлено максимальное снижение концентрации примеси до 0,19 мг/л.
Концентрация растворимых примесей ионов никеля (II) через 20 мин сорбции на образце S4 максимально снизилась с 1,00 до 0,39 мг/л, и через 60 мин сорбции максимальное снижение примеси наблюдалось на этом же образце – 0,37 мг/л, то есть максимальная сорбция происходила на диоксиде титана, обработанном в растворе хлорида натрия. Через 24 часа сорбции концентрация примесей снизилась максимально в присутствии образца S1 (до 0,20 мг/л).
Обработка постоянным электрическим полем приводит к поляризации частиц TiO2 и функциональных групп на их поверхности. В результате действия электрического поля частицы диоксида титана разделяются на фракции, которые проявляют различные сорбционные свойства по отношению к растворимым примесям катионов железа, марганца и никеля. Действие постоянного электрического поля приводит к перераспределению концентрации функциональных групп на поверхности диоксида титана.
Выводы
1. Обработка диоксида титана, полученного гидролизом TiCl4, постоянным электрическим полем приводит к его разделению на фракции, отличающиеся сорбционной активностью по отношению к растворимым примесям ионов железа (II), марганца (II) и никеля (II), что связано с изменением содержания определенных функциональных групп на поверхности диоксида титана.
2. В средах, не смещающих ионное равновесие H+–OH–, лучшие результаты по сорбции ионов железа (II) получены на образце диоксида титана, обработанного постоянным электрическим полем в среде раствора хлорида натрия и взятого из межэлектродного пространства (S4): концентрация снизилась с 3,00 до 0,54 мг/л (в 5,6 раз).
3. Ионы марганца (II) лучше сорбировались образцом диоксида титана, подвергнутого воздействию постоянного электрического поля в среде дистиллированной воды и взятого также из межэлектродного пространства (S1): снизил концентрацию с 1,00 до 0,19 мг/л (в 5,3 раза).
4. Образец диоксида титана, обработанный постоянным электрическим полем в дистиллированной воде и взятый в середине межэлектродного пространства (S1), привел к максимальному снижению концентрации ионов никеля (II): с 1,00 до 0,20 мг/л (в 5 раз).
Рецензенты:
Козик В.В., д.т.н., профессор, заведующий кафедрой неорганической химии, ФГБОУ ВПО «Национальный исследовательский Томский государственный университет», г. Томск;
Верещагин В.И., д.т.н., профессор кафедры технологии силикатов и наноматериалов, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск.
Работа поступила в редакцию 27.05.2013.
Библиографическая ссылка
Смирнова В.В., Ильин А.П. ВЛИЯНИЕ ПОСТОЯННОГО ЭЛЕКТРИЧЕСКОГО ПОЛЯ НА СОРБЦИОННЫЕ СВОЙСТВА ДИОКСИДА ТИТАНА // Фундаментальные исследования. – 2013. – № 6-6. – С. 1366-1371;URL: https://fundamental-research.ru/ru/article/view?id=31742 (дата обращения: 19.04.2024).



