Исследованы процессы синтеза полигидроксиэфиров (ПГЭ) на основе диолов, протекающие по схеме:
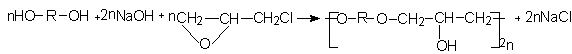
Как известно, протонные растворители ускоряют реакцию образования хлоргидриновых эфиров бисфенолов и их дегидрохлорирование, и тем самым способствуют более быстрому росту молекулярной массы эпоксидных полимеров. Установлено также, что спирты существенно замедляют побочный процесс гидролиза эпихлоргидрина. В работах Сорокина М.Ф. и сотрудников показано, что образование спиртом комплекса с эпоксидным кольцом за счет водородной связи оказывает активирующее воздействие на реакцию раскрытия оксирановых циклов.
Наиболее высокая приведенная вязкость при синтезе ПГЭ достигается в среде спиртов (ε = 18,3). Это объясняется специфическим взаимодействием молекул спиртов и фенолов, приводящее к изменению кислотности исходных бисфенолов. С увеличением кислотности фенола увеличивается его протонодонорная способность и уменьшается основность его аниона. Скорость реакции уменьшается с ростом кислотности бисфенолов. Поэтому можно предположить, что в рассматриваемом случае реакционная способность существенно зависит от природы растворителя, чем видимо, объясняется более высокая молекулярная масса в среде изопропилового спирта.
При синтезе эпоксиолигомеров одноатомные спирты вводили с целью ускорения процесса, снижения содержания органического хлора и подавления побочных реакций, для улучшения массо- и теплообмена. Выявлено, что изопропиловый спирт менее реакционноспособен, чем первичные спирты, что будет способствовать уменьшению доли побочных реакций.
Проведено потенциометрическое титрование диолов в указанных средах, выявившее, что в изопропаноле наблюдается самая низкая константа диссоциации диолов, т.е., понижается кислотность и соответственно повышается реакционная способность.
Изложенное находит объяснение при рассмотрении реакций замещения, протекающие через раскрытие эпоксидного цикла в результате атаки нуклеофильным агентом одного из углеродных атомов кольца.
По своей природе гидроксильная группа является высокополярной, электронная плотность в ней смещена от водорода к атому кислорода. В фенолах отрицательный индукционный эффект ОН-группы перекрывается действием положительного эффекта сопряжения неподеленной пары электронов кислорода с р-орбиталями ароматического кольца. Это приводит к понижению основности и нуклеофильности ОН-группы и повышению ее кислотности.
Повышению нуклеофильной реакционной способности гидроксильной группы будет способствовать вступление ОН-группы в водородную связь в качестве донора протонов вследствие смещения электронной плотности от водорода к кислороду.
Из всего изложенного можно предположить, что в изопропиловом спирте происходит повышение реакционной способности бисфенолов по приведенному механизму, что и приводит к повышению скорости реакции получения эпоксиполиэфиров, к более высоким значениям приведенной вязкости.



