Очистка природных, технологических и сточных вод от ионов меди (II) с точки зрения создания ресурсосберегающих технологий представляет большой интерес. Сорбционные технологии являются перспективными для концентрирования и выделения тяжелых металлов из растворов сложного состава [1–3], поэтому все большее применение находят природные минеральные сорбенты.
В последние годы уделяется большое внимание адсорбционным свойствам слоистых глинистых минералов, применяемых в качестве сорбентов [4–6]. Эти минералы имеют малые размеры частиц и высокую удельную поверхность, что повышает их адсорбционную способность и ионообменные свойства. Представителем таких глинистых минералов является каолинит. Каолинит имеет двухслойную структуру, в которой на один слой кремнекислородных тетраэдров приходится один слой алюмогидроксидных октаэдров [7], слои каолинита прочно связаны друг с другом посредством водородных связей. Кристаллизуется каолинит в моноклинной сингонии с жесткой структурной ячейкой [8], поэтому процесс сорбции протекает только в поверхностном слое кристаллов. Таким образом, особенность структуры каолинита характеризует его адсорбционные свойства.
Целью настоящей работы является исследование кинетических и термодинамических свойств природного и модифицированного каолинита, который может быть применен для очистки природных и промышленных сточных вод.
Таблица 1
Содержание компонентов в составе каолинита
|
Содержание |
SiO2 |
Al2O3 |
Na2O |
K2O |
CaO |
Fe2O3 |
Cu |
SO4 |
|
Состав каолинита до сорбции |
||||||||
|
% мас. |
54,55 |
27,23 |
1,29 |
0,96 |
3,81 |
9,94 |
– |
– |
|
Число молей |
0,909 |
0,267 |
0,021 |
0,010 |
0,068 |
0,062 |
– |
– |
|
Состав каолинита после сорбции |
||||||||
|
% мас. |
53,98 |
25,28 |
0,022 |
0,06 |
2,86 |
2,88 |
0,35 |
0,53 |
|
Число молей |
0,899 |
0,248 |
0,0004 |
0,0006 |
0,0510 |
0,018 |
0,006 |
0,006 |
Материалы и методы исследования
В качестве сорбента использовали каолинит. Методом рентгенофазового анализа было установлено, что исследуемый сорбент на 98 % состоит из каолинита и 2 % гидрослюд. В табл. 1 представлены количественные данные основных оксидов каолинита до и после сорбции ионов меди, полученные на сканирующем электронном микроскопе (SEM).
Представленные данные позволяют определить атомное соотношение оксида алюминия к диоксиду кремния, которое составляет ~1/2.1, что соответствует числу и силе кислотных центров поверхности алюмосиликатного каркаса каолинита [7, 9]. В качестве активных центров в каолините являются подвижные ионы Na+, K+, а также Ca2+, принимающие участие в обмене на ионы тяжелых металлов.
Процесс адсорбции изучали, используя 4 формы каолинита: каолинит в нативной (исходной) форме, Na-форме (обработан 2М раствором NaCl), ОН-форме (обработан 2М раствором NaOH), Н-форме (обработан 2М раствором НCl). При такой обработке природных глинистых сорбентов происходит увеличение поровых пространств, удельной поверхности и соответственно возрастает сорбционная емкость [9]. Для исследования использовали фракцию каолинита с размером частиц 90÷130 мкм. Концентрацию ионов меди в растворе определяли комплексонометрическим титрованием с трилоном Б в присутствии индикатора мурексида.
Кинетику сорбционного извлечения ионов меди из раствора соли исследовали методом ограниченного объема. Сорбент массой 0,1 г помещали в коническую колбу со 100 мл раствора меди заданной концентрации (0,01, 0,03, и 0,05 М). Скорость перемешивания 150 об/мин. Время контакта навесок каолинита с раствором составило 60 мин. Объем отобранных проб за время эксперимента не превышал 2 % от общего количества.
Определение термодинамических параметров сорбции осуществляли по изотермам сорбции в интервале температур 298, 313, 333 К.
Результаты исследования и их обсуждение
При определении оптимальных условий извлечения, концентрирования и разделения тяжелых ионов из сточных вод необходимы сведения по характеру кинетики и значениям основных кинетических и термодинамических параметров. Кинетические параметры необходимы при расчетах и проектировании аппаратуры. Из кинетических кривых устанавливается скорость достижения равновесия, максимальная рабочая емкость ионита для определенного состава раствора и температуры, механизм взаимодействия ионов с сорбентом при ионном обмене.
На рис. 1 представлены кинетические зависимости адсорбции ионов меди от времени на различных (модифицированных) формах каолинита. Из рисунка видно, что для всех форм величины адсорбции достигают постоянных значений за 20–30 мин. Установление времени адсорбционного равновесия необходимо для характеристики и описания равновесных процессов. Для каолинита модифицированного раствором соляной кислоты время достижения адсорбционного равновесия устанавливается за 20 мин. Объясняется это тем, что кислота подавляет диссоциацию силановых групп.
Сорбционный процесс является сложным и многостадийным. Скорость многостадийного процесса в формальной кинетике описывается уравнением кинетики наиболее медленной стадии. Согласно данным [10, 11] скорость адсорбции в гетерогенных системах рассчитывается по уравнению
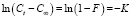 (1)
(1)
или в интегральной (дифференциальной) форме:
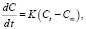 (2)
(2)
где Ct и C∞ – концентрации частиц в растворе в момент времени (t) и после установления сорбционного равновесия соответственно, мг/л; F = Q1/Q2 – безразмерная величина, характеризующая степень достижения сорбционного равновесия; К – константа скорости реакции, с-1.
Из уравнения (2) следует, что зависимость 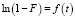 , представляющая прямую линию, указывает на внешнедиффузионный характер адсорбции, который наблюдается в течение первых минут [12]. По тангенсу угла наклона прямой линии (рис. 2) определяется величина константы скорости процесса сорбции. Значения констант скоростей при температурах 298, 313, 333 К представлены в табл. 2.
, представляющая прямую линию, указывает на внешнедиффузионный характер адсорбции, который наблюдается в течение первых минут [12]. По тангенсу угла наклона прямой линии (рис. 2) определяется величина константы скорости процесса сорбции. Значения констант скоростей при температурах 298, 313, 333 К представлены в табл. 2.
Полученные результаты показывают, что значения констант скорости адсорбции ионов меди для всех форм каолинита увеличиваются с ростом температуры. Наиболее заметное увеличение константы скорости адсорбции наблюдается для Na-формы каолинита.
Таблица 2
Значение констант скоростей при адсорбции ионов меди на каолините в различных формах
|
Форма каолинита |
Константа скорости (k•103, с-1) |
||
|
298 К |
313 К |
333 К |
|
|
нативная |
0,7 |
1,1 |
1,5 |
|
Н-форма |
0,5 |
0,8 |
1,0 |
|
Na-форма |
1,1 |
2,0 |
3,8 |
|
ОН-форма |
1,0 |
1,7 |
2,7 |
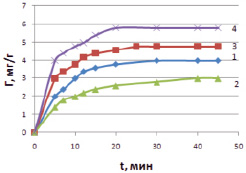
Рис. 1. Кинетические кривые адсорбции ионов меди различными формами каолинита: 1 – каолинит в нативной форме, 2 – Н-форма, 3 – Na-форма, 4 – ОН-форма при Т = 298 К
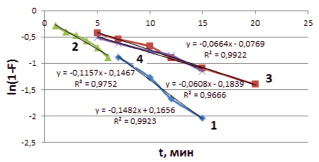
Рис. 2. Зависимость ln(1-F) от времени t для сорбции ионов меди на каолините в нативной форме (1), Н-форме (2), Na-форме (3), ОН-форме (4)
Энергия активации (Ea) процесса адсорбции ионов меди на каолините определена из зависимости lnk – 1/Т по уравнению Аррениуса [13]:
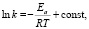 (3)
(3)
где k – константа скорости, с-1; Ea – энергия активации, кДж/моль; R – универсальная газовая постоянная (8,314 Дж/моль•К). Результаты расчета представлены в табл. 3.
Согласно литературным данным [13] при адсорбционном процессе, если энергия активации диффузии изменяется в пределах 8,5–12,6 кДж/моль – происходит диффузия в пленке, а 12,6–42,0 – диффузия в зерне.
Рассчитанные значения энергии активации для каолинита в Н – форме показывают на протекание смешанно-диффузионного режима процесса адсорбции ионов меди, а на остальных формах наибольший вклад вносит диффузия внутри зерна. Таким образом, диффузия ионов через пленку раствора, диффузия в зерне и взаимодействие ионов меди с водородом силановой группы вносят свой вклад в общую скорость процесса адсорбции.
Различия в адсорбции ионов меди при разных температурах позволило рассчитать термодинамические характеристики адсорбции: изменение энтальпии (ΔН) и энергии Гиббса (ΔG), позволяющие предположить механизм сорбции.
Расчет ΔН проводили с использованием уравнения изостеры в интегральном виде согласно уравнению:
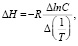 (4)
(4)
где С – равновесная концентрация ионов меди в растворе, мг/г; Т – температура, К; R – универсальная газовая постоянная, Дж/моль.
Таблица 3
Значения энергии активации процесса адсорбции ионов меди на каолините
|
Форма сорбента |
нативная форма |
Н-форма |
Na – форма |
ОН форма |
|
Ea, кДж/моль при 298,313 К |
23,3 |
24,3 |
30,4 |
27,5 |
|
Ea, кДж/моль при 313,333 К |
13,4 |
9,5 |
27,8 |
20,1 |
Таблица 4
Термодинамические параметры сорбции ионов меди
|
Постоянные Лэнгмюра, термодинамические функции |
298 К |
312 К |
333 К |
|
Каолинит в нативной форме |
|||
|
Г∞, г/г |
1,0 |
1,0 |
1,0 |
|
К•10-3, мл/мг |
3,00 |
3,26 |
3,38 |
|
ΔG, кДж/моль |
–14,38 |
–14,84 |
–15,74 |
|
ΔH, кДж/моль |
0,59 |
||
|
Каолинит в Н – форме |
|||
|
Г∞, г/г |
0,25 |
0,33 |
0,5 |
|
К•10-3, мл/мг |
12,58 |
12,88 |
8,97 |
|
ΔG, кДж/моль |
–10,82 |
–11,31 |
–13,04 |
|
ΔH, кДж/моль |
1,37 |
||
|
Каолинит в Na – форме |
|||
|
Г∞, г/г |
0,33 |
0,5 |
1,0 |
|
К•10-3, мл/мг |
14,85 |
9,95 |
4,93 |
|
ΔG, кДж/моль |
–10,41 |
–11,97 |
–14,71 |
|
ΔH, кДж/моль |
1,78 |
||
|
Каолинит в ОН – форме |
|||
|
Г∞, г/г |
0,5 |
0,5 |
1,0 |
|
К•10-3, мл/мг |
6,71 |
7,75 |
4,35 |
|
ΔG, кДж/моль |
–12,38 |
–12,63 |
–15,04 |
|
ΔH, кДж/моль |
0,71 |
||
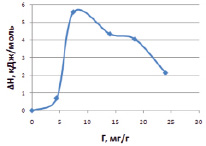
Рис. 3. Изменение энтальпии сорбции ионов меди (II) от величины адсорбции на каолините в ОН-форме
Энергию Гиббса ΔG определяли в соответствии с уравнением [13]:
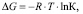 (5)
(5)
где ΔG – энергия Гиббса, Дж/моль; R – молярная газовая постоянная, Дж/моль·К; Т – температура, К; К – константа равновесия. Результаты расчетов представлены в табл. 4.
Результаты приведены на рис. 3 и показывают, что в начальной области заполнения активных центров наблюдается резкое увеличение теплоты адсорбции, а затем происходит уменьшение ΔН. Такая зависимость характерна для всех модифицированных форм каолинита. То есть по мере заполнения активных центров на поверхности в процесс начинают вступать менее активные центры, поэтому изменение ΔН по мере заполнения адсорбционного пространства каолинита постепенно снижается.
Спонтанное протекание процесса адсорбции подтверждается значениями энергии Гиббса (ΔG), это в свою очередь соответствует устойчивому закреплению ионов меди на поверхности каолинита и характеризует самопроизвольное протекание адсорбции ионов.
На основании полученных результатов исследования можно сделать следующие выводы.
Установлено, что константы скорости ионов меди увеличиваются с ростом температуры в следующем ряду: Na-форма > OH-форма > нативная форма > H-форма. Значения энергии активации изменяются от 9,5 до 30,4 кДж/моль.
Отрицательные значения изобарно-изотермического потенциала (энергия Гиббса) подтверждают самопроизвольный характер адсорбции. Экспериментально определенные кинетические и термодинамические параметры адсорбции ионов меди на каолините позволяют прогнозировать решения практических задач по количеству расхода каолинита с целью эффективного извлечения ионов меди из природных и промышленных сточных вод.



