Открытый ещё в начале 1970-х гг. 4,5,6,7-тетрагидроиндол (ТГИ) является достаточно известным и ценным соединением. Следует отметить, что в научной литературе достаточно много внимания (сотни работ) уделено разработке эффективных способов получения различных производных ТГИ и исследованию их разнообразных свойств, поскольку они являются ценными реагентами и синтонами для получения перспективных продуктов. Эти методы получения производных ТГИ предполагают использование дорогостоящих катализаторов на основе металлов платиновой группы и основаны, как правило, на экзотичных исходных соединениях, что ограничивает их широкое применение. Поэтому долгое время ТГИ оставался недоступным для промышленного производства. При этом существовал перспективный способ получения одного из его производных N-винил-4,5,6,7-тетрагидроиндола (ВТГИ) из циклогексаноноксима (ЦГО) и ацетилена.
Цель исследования
Данное исследование было направлено на поиск технологических решений, позволяющих осуществлять промышленное производство недорогого ТГИ с высоким выходом и чистотой целевого продукта, а также максимальной степенью конверсии сырья и возможностью его последующей рециркуляции.
Материалы и методы исследования
Известно, что ТГИ практически всегда образуется в качестве одного из продуктов при восстановлении индола щелочными металлами в системе NH3 / MeOH, в частности металлическим литием при низкой температуре (минус 78 °C):
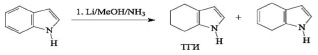
Однако при этом образуется сложная смесь продуктов, включая непрореагировавший индол и не менее четырех неидентифицированных соединений, для разделения которой можно использовать только методы препаративной газожидкостной хроматографии. К тому же концентрация целевого ТГИ в данной смеси не превышает 30 %.
Гораздо более селективно с выходом до 70 % ТГИ образуется в условиях высокотемпературного пиролиза циклогекса[а]пиррола [4]:
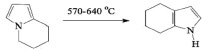
Но это исходное вещество еще более труднодоступно, чем ТГИ.
Известны патенты, в которых описаны способы каталитического восстановления водородом производных индола. Однако ТГИ в продуктах этих реакций присутствует преимущественно в следовых количествах.
Только после открытия общего метода пиррольного синтеза (реакция Трофимова) взаимодействием доступных и недорогих кетоксимов с ацетиленом в сверхосновных системах типа MOH/ДМСО (где M – щелочной металл), появилась возможность получать с высокими выходами разнообразные 2-х-замещенные и 2,3-х-дизамещенные NH – и N винилпирролы, в том числе и ТГИ, а также реализовать этот метод в заводских условиях [5]:
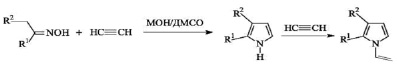
где R1 , R2 = Alk, Ar, Het; M = Li, Na, K, Cs
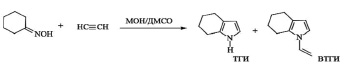
В 1979 году на Ангарском заводе химических реактивов была впервые запущена пилотная установка с объемом реактора 63 л для синтеза ВТГИ из ЦГО и ацетилена (под давлением ацетилена до 1,4 атм) в системе КОН/ДМСО. В то время этот оригинальный синтез не был востребован промышленностью, поскольку рынок индола был не развит и ограничивался использованием его в парфюмерии и фармацевтике, а производство триптофана составляло всего несколько тонн. Потребовалось 25 лет, чтобы фундаментальные исследования были реализованы в эффективной технологии получения недорогого индола через ТГИ. В дальнейшем на базе реакции Трофимова разрабатывалось несколько способов получения тетрагидроиндола.
Известен способ получения ТГИ взаимодействием ЦГО с ацетиленом в присутствии гидроксида калия в водном ДМСО (12 % Н2О, давление ацетилена 10 атм) при 120 °С. Для выделения ТГИ реакционную смесь промывают водой и экстрагируют его диэтиловым эфиром. Далее эфирные экстракты вновь многократно промываются водой, после чего осушаются карбонатом калия. Высушенные эфирные экстракты перегоняются в вакууме, закристаллизовавшийся дистиллят очищается перекристаллизацией из октана. Выход ТГИ в данном способе составляет 74 %, а конверсия ЦГО 50 % [2]. Недостатками этого способа являются невысокая конверсия исходного ЦГО и использование ацетилена под давлением (что повышает взрывоопасность и делает процесс труднореализуемым в производстве), а также трудоемкая многостадийная очистка целевого продукта с применением высоко пожаро- и взрывоопасного диэтилового эфира [3].
С целью повышения конверсии ЦГО в той же реакции предложен способ получения ТГИ, в котором в качестве катализатора использованы гидроокиси рубидия или тетрабутиламмония. Однако при этом возникла необходимость повысить давление ацетилена до 16 атм [2]. Таким образом, основной недостаток первого способа сохранился.
Имеется описание способа получения ТГИ взаимодействием ЦГО с ацетиленом под давлением 1,2–1,5 атм в среде ДМСО-диоксан (1:1) в присутствии гидроксида калия при температуре 110–120 °С и скорости подачи ацетилена 30 л/ч в течение 4–6 часов. Для выделения ТГИ также используется диэтиловый эфир и перекристаллизация из гексана, гептана или октана. Однако выход целевого продукта ТГИ в нем остается невысоким и составляет 45–50 %.
Сообщалось, что реакцию могут катализировать также гидроксиды лития и натрия, однако, конверсия ЦГО и выходы целевого ТГИ при этом чрезвычайно низки (10–20 %) и не интересны для промышленности.
Известен способ получения ТГИ взаимодействием ЦГО с ацетиленом в системе КОН – ДМСО при атмосферном давлении ацетилена, мольном соотношении ЦГО : КОН = 1:0,3–0,4, массовом соотношении ЦГО : ДМСО = 0,08 и продолжительности контакта реагентов 12–16 часов с перемешиванием реакционной смеси только в течение первых 0,5–2 часов. В этих условиях выход ТГИ и конверсию ЦГО удалось повысить до 93,5 и 95 % соответственно. Но это произошло за счет очевидного ухудшения главнейших технологических параметров: повышения концентрации нерегенерируемого катализатора (15–20 % КОН от массы ЦГО), увеличения продолжительности реакции (до 12–16 ч) и большого разбавления (ЦГО в ДМСО – 8 %), что привело к резкому снижению производительности на единицу объема катализаторного раствора. Отсутствие перемешивания осложнило контроль за ходом реакции (поскольку в каждой точке реактора создаются разные концентрации реагентов и продукта), создало условия для нежелательного образования ВТГИ и существенно снизило безопасность процесса, так как из-за градиента температуры в поверхностном слое реакционной смеси процесс может выйти из-под контроля за счет большой теплоты реакции и вызвать взрывное разложение ацетилена [1].
Фундаментальным недостатком этого способа, как и способов-аналогов, использующих в качестве катализатора гидроксиды щелочных металлов, является необратимое превращение катализатора в ацетаты за счет известной реакции гидроксидов щелочных металлов с ацетиленом и водой КОН + НС≡СН + Н2О > > КОСОСН3 + Н2. Эта побочная реакция приводит к снижению концентрации катализатора, а стало быть, и скорости основной реакции уже на начальных стадиях процесса. Она также является причиной накопления водорода в газовой фазе над реакционной смесью, что вызывает снижение парциального давления ацетилена и, как результат, дальнейшее падение скорости. Очевидной нетехнологичностью отмечается также и стадия выделения ТГИ путем экстракции, приводящая к безвозвратным потерям экстрагентов и продукта [2]. Перечисленные недостатки препятствуют практическому использованию этого способа.
В опубликованном патенте ФРГ описан синтез пирролов, в том числе ТГИ, на базе реакции Трофимова из кетоксимов и ацетилена в различных растворителях, включая N-метилпирролидон, в присутствии алкоксидов щелочных металлов. Однако лучший пример синтеза ТГИ из этого патента (реакция ЦГО с ацетиленом в системе t-BuOK/NMP) нам не удалось воспроизвести: ТГИ был получен с выходом только 17 % (вместо заявленных в нем 52 %).
Результаты исследования и их обсуждение
Промышленный вариант технологии производства ТГИ был достигнут в совместной разработке Иркутского института химии СО РАН и литовской научно-исследовательской компании «Waldis», которые стремились получить недорогой индол, как сырье для быстро развивающегося рынка триптофана. Оригинальность их решения состояла в том, что экзотический ТГИ, стоимость которого на рынке доходила до 240 евро за грамм, превратился в недорогое сырье для производства индола, так как реакционные компоненты его получения являются продуктами многотоннажных производств и вполне доступны на рынке. Технология, в основе которой лежит реакция Трофимова, была отработана как в лабораторных условиях в стеклянной посуде, так и на опытном производстве в 6-литровом и 10-литровом стальных реакторах с использованием промышленного сырья польской компании «Azoty Tarnow», российской компании «Саяныхимпром» и промышленных растворителей французской компании «Arkema». При этом выход ТГИ с чистотой 99,7 % составил за один проход 98 % на прореагировавший ЦГО, степень конверсии которого была более 75 %. Непрореагировавший ЦГО при экстрагировании ТГИ остается в растворителе, поэтому легко осуществима его рециркуляция.
В ходе исследований эффективно была решена также и задача дегидрирования ТГИ в индол с помощью сульфидного нано-катализатора и разработана уникальная промышленно-реализуемая технология производства. В данной технологии рост наноструктур на подложке оксида алюминия легко регулируется изменением величины фильтрования каталитического раствора. Благодаря возможности подобрать оптимальную структуру активной зоны нанокатализатора, достигается 96 % выход индола при селективности процесса 100 % и чистоте продукта более 99,7 %. Другие известные катализаторы дегидрирования ТГИ явно уступают ему по эффективности получения индола, обеспечивая выход в диапазоне до 66 %. Так, на хром-редкоземельном катализаторе выход индола на пропущенную смесь составляет 65,7 %. При этом образуются 1-этилиндол (1,3 %), 2-этилиндол (8,9 %), неидентифицированные продукты (5,8 %), а также тетрагидроиндол (1,2 %). Все компоненты данной смеси имеют близкие температуры кипения и растворимости, образуя сложную технологически неразделимую смесь. Это является одним из недостатков данного способа. Другой недостаток – использование каталитических систем, содержащих высокие концентрации дорогостоящих компонентов – палладия (1–1,5 %) и редкоземельных элементов (5 %).
Уникальность подхода отработанной нами технологии дегидрирования состояла в том, что использовалась каталитическая система, в которой в качестве активного компонента применен наноразмерный сульфид никеля, не используемый ранее для ароматизации азотистых гетероциклов с насыщенными нанофрагментами. Обычными для таких процессов являются нанесенные катализаторы на основе палладия и редкоземельных элементов, а также платины и родия, реже используются соединения хрома, железа, молибдена, меди, кадмия, цинка или металлический никель. Известно, что пирролидин превращается в пиррол на родиевом катализаторе (0,5 % Rh на Al2O3, 650 °С) с небольшим (до 45 %) выходом продукта, а на алюмохромовом контакте (33,5 % Cr2O3 на Al2O3, 400 °С) выход пиррола снижается в три раза (до 17 %). Для дегидрирования ТГИ в индол может использоваться и палладий на углероде. Эта же каталитическая система (5 % Pd/C, 200 °С) применялась для ароматизации продуктов индольного ряда с небольшим выходом, например, 3,4-дигидро-β-карболинов и тетрагидро-β-карболинов с выходом β-карболинов 25 % [1].
Высокий уровень уникальности описанных научных и технологических решений, использующих в качестве активного компонента нанокатализатора сульфид никеля, обусловлен тем, что по общепринятым представлениям соединения серы являются каталитическими ядами по отношению к гетерогенным катализаторам дегидрирования на основе Ni, Pt, и Pd, которые теряют активность даже в присутствии следов сероводорода, меркаптанов и сульфидов. Таким образом, данная разработка ставит новый широкий вопрос в каталитических реакциях относительно соединений серы.
При разработке катализатора установлено, что допирование ионами Na+ и Cl- повышает поляризацию амфотерных молекул оксида алюминия и усиливает взаимодействие мезополостей носителя с сульфидом никеля. Аффинность катализатора, в свою очередь, влияет на размер и количество нанокластеров (NiS) на фрактальной поверхности носителя (γ-Al2O3), а уменьшение размеров нанокластеров NiS приводит к увеличению выхода индола на этом катализаторе. Оптимальные размеры кластеров нанокристаллов NiS составляют 300–800 нм (рисунок).

Фрактальная поверхность катализатора с содержанием никеля 0,56 %
Величину допирования определяли с помощью величины отжима (фильтрованием) полученной каталитической суспензии. Увеличение фильтрации снижало количество нанокластеров, но увеличивало их размер. Уменьшение величины фильтрации, наоборот, снижало размеры нанокристаллов, но увеличивало их количество.
Путем варьирования степени допирования были получены наилучшие результаты, которые определили количественное содержание никеля в нанокластерах (таблица).
Зависимость выхода индола от размера нанокластеров кристаллов никеля
|
Катализатор |
Содержание Ni, % |
Размер крис-таллов Ni , нм |
Выход индола, % |
Катализатор |
Содержание Ni, % |
Размер крис-таллов Ni , нм |
Выход индола, % |
|
К1 |
2,10 |
10 |
52 |
К6 |
1,40 |
7 |
57 |
|
К2 |
2,00 |
10 |
46 |
К7 |
1,20 |
6 |
66 |
|
К3 |
1,90 |
10 |
59 |
К8 |
1,00 |
5 |
76 |
|
К4 |
1,80 |
8 |
46 |
К9 |
0,99 |
4,5 |
96 |
|
К5 |
1,60 |
7 |
46 |
К10 |
0,44 |
3 |
93 |
Из таблицы видно, что увеличение размеров нанокристаллов никеля снижает выход индола при дегидрировании даже при большом содержании Ni в каталитической системе. И, наоборот, уменьшение размеров нанокристаллов никеля приводит к возрастанию выхода индола на этом катализаторе. Оптимальными оказались размеры кристаллов никеля равные 3–4,5 нм и соответствующие содержанию никеля в нанокластере 0,99 %, как в катализаторе К9.
Выводы
Таким образом, в ходе исследований разработаны технологии, позволяющие получать в промышленных масштабах недорогой ТГИ и путем его дегидрирования на каталитической системе, в которой в качестве активного компонента применяется нано-размерный сульфид никеля на Al2O3, производить индол. Данные вещества являются ценным сырьем для тонкого органического синтеза. И если рынок индола был определен и понятен, а рост его был обусловлен ростом производства кормовой аминокислоты (L-триптофан), то рынок ТГИ стал быстро формироваться с публикаций о возможности его промышленного производства. Поскольку некоторые производные ТГИ это био- и ДНК-активные вещества, то научное сообщество прежде всего стало разрабатывать фармацевтическое направление. Так, Институт элементоорганических соединений РАН им. А.Н. Несмеянова предложил большую линейку онколекарств – фтор-производных тетрагидроиндола; а германская компания «Symrise» заинтересовалась ТГИ как фиксатором запахов в парфюмерных композициях. В последние 10 лет активные исследования с ТГИ ведут такие гиганты фармацевтического рынка, как «Janssen Pharmaceutica», «Mitsubishi Pharma Corporation», «Myriad Genetics». Данные факты свидетельствуют о перспективности предлагаемой технологии производства ТГИ.



