В настоящее время поиск катализаторов селективного окисления углеводородов различного строения для получения первичных продуктов реакции гидропероксидов ведется весьма активно в связи с промышленным значением получаемых из гидропероксидов органических соединений. Одним из таких соединений является фенол, промежуточная и самая сложная стадия получения которого - это окисление кумола в гидроперекись кумола (ГПК). В промышленности ГПК получают окислением кумола молекулярным кислородом при 100–120 °С, конверсия процесса составляет 20–30 %. Это типичный свободнорадикальный процесс, и в отсутствие каких-либо посторонних инициирующих агентов зарождение цепей происходит крайне медленно (4–6 часов). Кроме этого, при температуре выше 100 °С происходит частичное разложение гидроперекиси, что уменьшает селективность процесса [4]. Поэтому поиск новых катализаторов, позволяющих проводить данный процесс при более низких температурах, с высокими значениями селективности и конверсии является задачей весьма актуальной на сегодняшний день.
Базовыми каталитическими системами реакции окисления являются оксиды переходных металлов [2] или металлы в компактном состоянии [7]. Можно выделить катализаторы на основе наноразмерных, наноструктурированных и нанокомпозитных материалов [1, 6].
В последние годы имеется тенденция к использованию в качестве носителя катализатора различных форм углерода [9, 8].
Темой данной работы является исследование композиционных материалов «металл - углеродный носитель» на основе различных видов углерода и металлов в каталитическом процессе окисления кумола.
Материалы и методы исследования
В качестве углеродных носителей в работе использовали: многослойные углеродные нанотрубки (МУНТ) «BaytubesC 150 P» (Bayer MaterialScience AG) с числом слоёв 3–15, диаметром 13–16 нм, длиной 1–10 мкм (НТ (Б)); технический углерод (ТУ) марки П354 и углерод-углеродный композиционный материал «Сибунит» (Сибунит), оба получены в Институте проблем переработки углеводородов СО РАН (г. Омск). Поверхность Сибунита представлена пиролитическим углеродом [5].
В работе использовали композиционный материал «серебро - углеродный носитель», полученный нанесением наночастиц серебра методом ионной адсорбции или пропитки (IMP) углеродного носителя солью металла (Ag(NO3) в щелочной среде с последующим восстановлением серебра при температуре 310 °С (Ag-МУНТ, Ag-ТУ, Ag-Сибунит).
Композиционный материал «никель, кобальт углеродный носитель» получен методом химического восстановления металлов из растворов их солей в присутствии углеродных носителей (Ni–Co-МУНТ, Ni–Co–ТУ, Ni–Co-Сибунит).
Рентгено-фазовый анализ. Исследование проводилось на рентгеновском дифрактометре Shimadzu XRD 7000.
Исследование размера и формы частиц в исследуемых композициях проводили с помощью метода просвечивающей электронной микроскопии на электронном микроскопе JEM-100 CX II JEOL в ЦКП «НАНОТЕХ» ИФПМ СО РАН (ЦКП ТНЦ СО РАН).
Процесс низкотемпературного окисления кумола проводили в стеклянном реакторе барботажного типа на газометрической установке при 60 °С и атмосферном давлении. После реакции смесь анализировали методом газовой хроматографии на хроматографе Agilent 7890A (пламенно-ионизационный детектор, капиллярная колонка НР-5 (длина 30 м, внутренний диаметр 0,32 мм), режим программирования температуры, скорости газа носителя 0,7 мл/мин).
Результаты исследования и их обсуждение
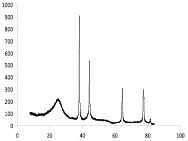
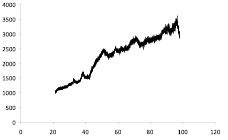
Присутствие наночастиц серебра, никеля и кобальта в композиционном материале «Ag – углеродный носитель» и «Ni–Co-углеродный носитель» подтверждается данными РФА, ИК спектроскопии и ПЭМВР. На рентгенограмме композиционного материала «Ag-ТУ» просматриваются пики кристаллического серебра (38,12; 44,3; 64,45; 77,41; 81,55 град) и углерода (25,94; 42,96; 53,29; 78,72 град.) (рис. 1, а), а на рентгенограмме композиционного материала «Ni–Co-ТУ» пики никеля (38,42; 44,555; 58,462; 71,074) и кобальта (43,838; 51,731) (рис. 1, б).
Ранние исследования показали [10], что спектры комбинационного рассеивания композиционного материала «Ag-УНТ» кроме полос структурированного углерода на частотах 1595 и 1282 cм–1 (G и C полосы соответственно) содержат дополнительную широкую полосу в области 600–500 см–1.
В ИК-спектрах композиционного материала Ni–Co-УНТ наблюдается небольшое смещение полос, отнесенных к колебаниям –С–С– связей на частотах 1057 и 1126 см-1 и увеличивается интенсивность полос на частотах 563 и 580 см–1 (колебания связи –М–С–) [3]. Квантово-химический расчет модельного соединения AgC2 методом B3LYP/DGDZVP дает валентные колебания Ag–C в области 480–500 см–1, деформационные в области 580 см–1.
а б
Рис. 1. Рентгенограмма композиционных материалов ТУ-Ag (а) и ТУ-Ni–Co (б)

а б
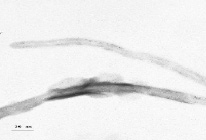
Рис. 2. Микрофотографии композиционных материалов «УНТ-Ni–Co» (а) и «УНТ-Ag (б)
Микрофотографии композиционных материалов на примере активированных металлами углеродных нанотрубок представлены на рис. 2.
Никель на поверхности УНТ имеет аморфизированную пластинчатую структуру (рис. 2, а), а серебро – кристаллическую структуру (dкр = 10–15 nm) (рис. 2, б).
Каталитическую активность композиционных материалов изучали в реакции окисления кумола молекулярным кислородом при температуре 40–60 °С и атмосферном давлении без инициатора. Скорость процесса окисления оценивали по скорости поглощения кислорода системой кумол-катализатор.
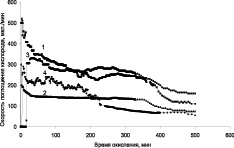
Кинетические зависимости изменения скорости поглощения кислорода от времени системой кумол-катализатор, при окислении кумола в присутствии катализаторов «металл – углеродный носитель» представлены на рис. 3.
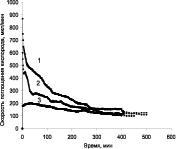
Можно отметить, что окисление кумола проходит достаточно активно в присутствии всех исследованных катализаторов, но с более постоянной скоростью при температуре 40 °С на катализаторе ТУ-Ag (рис. 3, а, кривая 2). В результате окисления на катализаторах с серебром образуется в основном гидроперекись кумола (ГПК) и следовые количества диметилфенилкарбинола (ДМФК) и ацетофенона (АФ) (рис. 4). Селективность по гидроперекиси при конверсии 28 % достигает 75 %.
Продуктами реакции окисления кумола на катализаторах, содержащих никель и кобальт (рис. 5), является не только ГПК, но и продукты его разложения ДМФК и АФ. При этом селективность по ГП снижается до 45–50 %.
а б
Рис. 3. Зависимость скорости поглощения кислорода от времени при окислении кумола в присутствии композиционных материалов «Ag –иуглеродный носитель» (а) и «Ni–Co-углеродный носитель» (б): А: 1 – ТУ Ag (Скат. = 0,12 %, Т = 60 °С); 2 – ТУ-Ag (Скат. = 0,12 %, Т = 40 °С); 3 – Сибунит Ag (Ni–Co Скат = 0,12 %, Т = 60 °С); 4 – УНТ Ag. (Скат = 0,12 %, Т = 60 °С). В: 1 – ТУ-Ni–Co; 2 – МУНТ-Ni–Co; 3 – ТУ-Ni–Co (восстановленный после 10 часов работы)
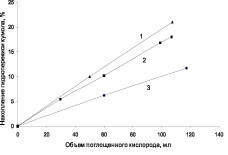
Рис. 4. Зависимость скорости накопления гидроперекиси от объема поглощенного кислорода при окислении кумола в присутствии композиционных материалов «серебро – углеродный носитель»: 1 – Ag-ТУ; 2 – Ag-МУНТ; 3 – Ag-Сибунит
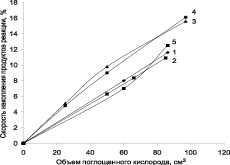
Рис. 5. Зависимость скорости накопления продуктов реакции окисления от объема поглощенного кислорода при окислении кумола в присутствии катализатора «никель – кобальт – углеродный носитель»: 1 – ГП (ТУ-Ni–Co); 2 – ГП (ТУ-Ni–Co (катализатор после восстановления)); 3 – ГП (МУНТ Ni–Co); 4 – ДМФК (МУНТ Ni–Co); 5 – ДМФК (ТУ Ni–Co)
Этот факт можно объяснить, используя представления о механизме разложения гидроперекисей в присутствии металлов переменной валентности (Ni и Co) (механизм Габера - Вейсса).
Можно высказать некоторые предположения о механизме окисления кумола в присутствии полученных композиционных материалов.
Процесс окисления кумола при температуре 60 °С и атмосферном давлении без катализатора и инициатора практически не идет (отсутствуют даже следовые количества продуктов реакции), т.е. термическое окисление не оказывает влияние на кинетику его каталитического окисления, и, вероятно, учитывая, что процесс радикальный, зарождение радикалов осуществляется на поверхности катализатора, который является одновременно и инициатором данного процесса, а окисление в целом проходит по гомогенно-гетерогенному механизму.
Можно предположить, что первая стадия процесса активации молекулярного кислорода в результате его адсорбции на поверхности катализатора с переносом электронной плотности с металла катализатора на кислород.
Ме + О2 > (Ме+)…(О–О)–. (1)
Координированный кислород обладает радикальными свойствами и, вероятно, способен оторвать атом водорода от молекулы углеводорода:
(Ме+ )…(О–О)– + RH > (Ме+ )…(ООН)– + R• . (2)
И далее, процесс идет по схеме:
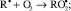
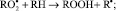
RООН + R• → RОН + RО•;
RО• + RH → RОН + R•.
Таким образом, представленные в настоящей работе активированные серебром, никелем и кобальтом углеродные носители обладают достаточно высоким потенциалом для применения их в качестве гетерогенных катализаторов процесса окисления кумола.
Выводы
1. Композиционные материалы на основе углеродных носителей (УНТ, ТУ и углерод-углеродного материала Сибунит) и наночастиц металлов (Ag, Ni, Co) исследованы в качестве катализаторов в реакции окисления кумола молекулярным кислородом.
2. Показано, что использование композиционного материала «Ag - углеродный носитель» в реакции окисления позволяет существенно снизить температуру реакции (до 40 °С) и повысить селективность по гидроперекиси.
3. При использовании металлов переменной валентности в составе катализатора наряду с образованием гидроперекиси кумола происходит ее разложение по механизму Габера - Вейса, при этом снижается селективность по гидроперекиси.



