Сердечно-сосудистая патология остается одной из актуальных проблем практического здравоохранения и медицинской науки. В развитых странах Европы показатель смертности от сердечно-сосудистых заболеваний достигает 50 % от общей смертности населения. Обращает на себя внимание высокий процент встречаемости ишемической болезни сердца (ИБС) у лиц мужского пола в возрасте 30–60 лет, т.е. трудоспособной, высококвалифицированной части общества [8].
Наиболее часто и тяжело поражаются атеросклерозом проксимальные отделы левой венечной артерии (ЛВА): ствол, начальные отделы передней межжелудочковой, огибающей и диагональной ветвей. Это, несомненно, приводит к ухудшению васкуляризации миокарда левого желудочка и развитию ИБС [3, 7]. При проведении реконструктивно-восстановительных операций по поводу ИБС нередко возникают технические трудности, связанные как с недостоверными и не четко ориентированными в прикладном аспекте данными по хирургической анатомии венечных артерий [4]. Данный факт требует детализированного изучения ангиоархитектоники зон разветвления ЛВА.
В настоящее время наиболее приоритетной задачей в практической российской медицине является развитие персонализированного подхода к анализу патоморфологических состояний. Активно используется метод персонального моделирования сосудистого русла, разработка программно-информационного комплекса которого не возможна без использования базы данных по ангиоморфометрии [2, 5, 6]. Поэтому новые данные о структурной организации левовенечного сосудистого русла сердца являются весьма актуальными.
Цель исследования: выявить топографо-морфологические особенности субэпикардиального левовенечного сосудистого бассейна у взрослых мужчин.
Материал и методы исследования
Материалом для исследования послужили 128 сердец, 128 левых венечных артерий, изъятые при аутопсии 128 трупов мужчин в возрасте 31–70 лет, поступившие в ГУЗ «Бюро судебно-медицинской экспертизы» Министерства здравоохранения Саратовской области. Причина смерти умерших преимущественно носила насильственный характер и не была связана с заболеваниями сердечно-сосудистой системы. Средний возраст в исследовании составил 50,2 ± 1,5 лет. Для детального анализа возрастной динамики топоморфологических изменений ЛВА материал исследования распределен по десятилетиям на 4 возрастные группы (таблица).
Распределение объектов исследования в зависимости от возраста
|
Возрастная группа |
Возраст (лет) |
Число наблюдений |
|
|
Абсолютные значения |
Относительный показатель (%) |
||
|
1 |
31–40 |
32 |
25,0 |
|
2 |
41–50 |
32 |
25,0 |
|
3 |
51–60 |
32 |
25,0 |
|
4 |
61–70 |
32 |
25,0 |
|
Всего |
128 |
100 |
|
Топографию ЛВА исследовали на нативных и коррозионных препаратах. Использовали следующие методы исследования: кардио- и ангиометрию, оригинальный метод заливки венечных артерий ацетатным силиконом, препарирование, фотографирование. При помощи обработки цифровых фотографий с использованием компьютерной программы CorelDRAW измеряли углы в местах разветвления и ответвления ветвей ЛВА: угол отклонения α-угол, между осями проксимальной части сосуда и боковой ветви; угол разветвления β-угол между осями дистальной части магистрального сосуда и боковой ветви. Изучали число и уровень ответвления ветвей ЛВА.
При описании ветвей левой венечной артерии пользовались Международной анатомической терминологией. Для систематизации полученных при исследовании топоморфометрических параметров использовали принцип сегментарного деления венечных артерий.
Обработку полученных количественных данных проводили вариационно-статистическими методами с использованием пакета прикладных программ «Statistica 10.0» (StatSoft Inc., USA). Для всех параметров определяли амплитуду (A), минимальное (Min) и максимальное (Max) значения, среднее значение (M), ошибку среднего (m), стандартное отклонение (s), 25 и 75 %-ные процентили. Показатель наглядности определяли по формуле
D = (M2/M1)∙100 % – 100.
Показатель экстенсивности определяли как частоту встречаемости различных групп по отношению к выборке. Варьирование считали слабым, если коэффициент вариации Cv не превышал 10 %, средним, когда Cv составлял 11–25 %, и значительным при Cv > 25 %. Распределение считали асимметричным при Cv > 50 %. Для определения достоверности различия средних величин использовали параметрические и непараметрические статистические критерии. При исследовании взаимосвязи между количественными параметрами применяли непараметрический критерий Спирмена. Критический уровень статистической значимости значения p для вышеуказанных статистических критериев был принят за 95 %-ный (p < 0,05) и выше порог вероятности.
Результаты исследования и их обсуждение
Левая венечная артерия отходила от левого аортального синуса Вальсальвы в виде ствола (98,4 % случаев), следующего влево и вниз между легочным стволом и ушком левого предсердия до начала левой атриовентрикулярной и передней межжелудочковой борозд. Отрезок ЛВА – от устья до места ее деления, чаще на две ветви (66,7 % случаев): переднюю межжелудочковую (ПМЖВ) и огибающую (ОВ), представляет собой ствол ЛВА (I сегмент). Реже, в 33,3 % случаев, ствол ЛВА делился трифуркационно: при этом делении между ПМЖВ и ОВ наблюдалась диагональная ветвь (ДВ) ЛВА. Угол отклонения (α) начального отдела I сегмента ЛВА от аорты в среднем составил 120,5 ± 1,7°; s = 12,6°, варьируя в пределах 86,0–155,0°. В подавляющем большинстве случаев (97,6 %) данный угол тупой (А от 92,0 до 155,0°), в 2,4 % случаев угол α менее 90,0° (85,0–88,0°). Длина I сегмента ЛВА в изучаемой выборке варьировала от 5,8 до 18,8 мм (11,1 ± 0,3 мм, s = 3,0 мм). Экстенсивность угла отклонения представлена на рис. 1.
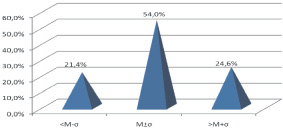
Рис. 1. Экстенсивность угла отклонения ствола ЛВА
Передняя межжелудочковая ветвь (II сегмент) ЛВА в 1,6 % (два случая из 128) ответвлялась самостоятельным устьем от аорты, в остальных 98,4 % случаев – от ствола ЛВА. Угол α ПМЖВ от ствола ЛВА – острый и варьировал от 2,0 до 57,0°, в среднем равен 26,3 ± 1,4° (s = 9,0°), коэффициент вариации высокий (Сv = 34,2 %). ПМЖВ с углом α менее 20,0° обнаруживалась в 30,1 % наблюдений, с углом от 21,0–40,0° – в 58,0 % случаев, более 41,0° – только в 11,9 %. Угол α ПМЖВ методом сигмальных отклонений разделен три группы: М ± σ – средний угол (от 17,0 до 35,0°) представлен 62,7 % случаями; < М–σ – малый (< 17,0°) – 16,7 %; > M + σ – большой (> 35,0°) – 20,6 %. С возрастом отмечено уменьшение угла α ПМЖВ (рис. 2) от 1-й ко 2-й возрастной группе с 30,3 ± 2,1° до 22,2 ± 2,3°, что составило 26,7 % (p < 0,05), от 2-й к 4-й его величина практически не изменяется (p > 0,05).
После ответвления передняя межжелудочковая ветвь следовала вдоль передней межжелудочковой борозды субэпикардиально, по направлению к верхушке левого желудочка. Изредка встречалось погружение небольшого участка ПМЖВ в миокард, чаще в средней трети. Первая ветвь, отходящая от проксимальной трети ПМЖВ, чаще крупная, в 50 % случаев следует на переднелатеральную поверхность левого желудочка и тем самым замещает диагональную ветвь, которая, как правило, при этом отсутствует. Угол α данной желудочковой ветви составил 32,6 ± 2,5° (А от 9,0 до 65,0°). Кроме вышеописанной ветви, к передней стенке левого желудочка от ПМЖВ ответвляются желудочковые ветви в количестве от 2 до 7. В среднем угол α данных ветвей составил 48,2 ± 2,0° (А от 15,0 до 80,0°). Во всех случаях от ПМЖВ ответвляются желудочковые ветви и к передней стенке правого желудочка. Их количество варьировало от 1 до 4. Как правило, первая из них самая крупная. Угол отклонения данных ветвей в среднем 54,2 ± 2,40° (А от 20,0 до 85,0°). На всем протяжении, чаще от миокардиальной поверхности передней межжелудочковой ветви, отходят передние септальные ветви, количество которых наблюдалось от 4 до 14. Угол α данных ветвей в среднем равен 73,5 ± 1,8° (А от 55,0 до 90,0°).
В 13,3 % ПМЖВ оканчивалась в нижней трети передней межжелудочковой борозды, не достигая верхушки сердца, однако в большинстве случаев ПМЖВ не только достигала верхушки сердца (46,1 %), но, и переходила конечными ветвями на диафрагмальную поверхность сердца в 40,6 % наблюдений. Длина II сегмента ЛВА в изучаемой выборке варьировала от 89,9 до 200,2 мм (125,4 ± 2,7 мм, s = 26,3 мм).
Огибающая ветвь (III сегмент) ЛВА в 1,6 % случаев, как ПМЖВ, ответвлялась самостоятельным устьем от аорты. Угол α ОВ варьировал в широких пределах (А 20,0–110,0°) и в среднем составил 57,2 ± 2,3°, s = 18,2°, коэффициент вариации высокий (Сv = 31,8 %). Угол α ОВ от 46,0–90,0° встречается в 44,4 % случаев, менее 45,0° угол α обнаруживается в 48,4 % наблюдений, более 90,0° – только в 7,2 %. Методом сигмальных отклонений угол α ОВ в выборке разделен на три группы: М ± σ – средний угол (от 37,0 до 73,0°) составили 72,2 % наблюдений; < М – σ – малый (< 37,0°) – 15,9 %; > M + σ – большой (> 73,0°) – 11,9 % случаев. Наблюдалось увеличение угла α ОВ (рис. 2) от 1-й ко 2-й возрастной группе с 48,6 ± 3,7 до 60,9 ± 5,1°, т.е. на 25,3 % (p < 0,05). В 3‒4-й возрастных группах данный параметр составляет 54,9 ± 3,2 и 58,8 ± 5,8°, достоверных различий между 2, 3, 4-й группами не выявлено (p > 0,05).
В 43,0 % наблюдений после отхождения от ствола ЛВА огибающая ветвь следовала в левой атриовентрикулярной борозде до тупого края сердца, отдавая ветви к переднебоковой стенке левого желудочка, и оканчивалась разветвлением на левые краевые ветви. Реже (в 34,4 %) ОВ продолжалась по венечной борозде на диафрагмальную поверхность в виде заднебоковой левожелудочковой ветви, которая разветвлялась в левой трети задней стенки левого желудочка, в 9,4 % ОВ достигала области «креста» – места пересечения задней межжелудочковой, задней межпредсердной и предсердно-желудочковых борозд. В большинстве случаев, чаще от проксимального и среднего отделов ОВ, отходили предсердные ветви к левому предсердию в количестве от 2 до 6.
При развитой огибающей ветви, от ее проксимального отдела, в случае отсутствия диагональной, в 28,9 % наблюдений, ответвлялась крупная ветвь под углом α в среднем равным 53,1 ± 2,4° (А от 15,0 до 73,0°), которая следовала на переднелатеральную поверхность левого желудочка. При этом варианте крупная левая краевая ветвь (ЛКрВ) чаще отходила от ОВ в области «тупого» края сердца, под углом α, в среднем равным 61,1 ± 2,8° (А от 30,0 до 90,0°), и направлялась к верхушке левого желудочка.
В 13,2 % случаев огибающая ветвь была представлена только крупной левой краевой ветвью, которая нисходила по переднелатеральной поверхности левого желудочка к верхушке сердца и отдавала свои желудочковые ветви на заднюю поверхность левого желудочка. В этом случае угол α ЛКрВ от ствола ЛВА варьировал в пределах 20,0–60,0° и составил в среднем 43,5 ± 1,9°. Длина III сегмента ЛВА высоко изменчива (Cv = 33,7 %) и варьировала от 51,1 до 198,7 мм (101,4 ± 3,6 мм, s = 34,1 мм).
Угол β ПМЖВ-ОВ колебался в пределах от 40,0 до 140,0° и составил в среднем 80,3 ± 2,1°, s = 17,1°. Угол β от 0–45° встретился в 2,4 % наблюдений, от 46–90° – в 77,0 % случаев и более 90° – в 20,6 %. Угол β ПМЖВ-ОВ методом сигмальных отклонений разделен на три группы: М ± σ – средний угол (от 62,0 до 97,0°) представлен 69,8 % случаями; < М – σ – малый (< 62,0°) – 13,5 %; > M + σ – большой (> 97,0°) – 16,7 %. Выявлено статистически значимое увеличение угла β ПМЖВ-ОВ от 1-й к 4-й возрастной группе с 78,9 ± 3,6° до 86,3 ± 3,6°, что составляет 9,4 % (p < 0,05) (рис. 2).
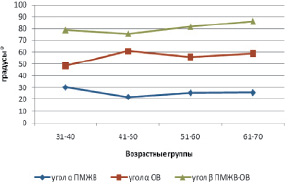
Рис. 2. Возрастная изменчивость углов отклонения ПМЖВ и ОВ и разветвления ПМЖВ-ОВ
Диагональная ветвь (IV сегмент) встретилась в 33,3 % наблюдений, когда имело место трифуркационное деление ствола ЛВА. Ответвляясь от него, диагональная ветвь (ДВ) следовала по передней стенке левого желудочка вниз и вправо, иногда достигая верхушки левого желудочка. В 76,2 % случаев обнаруживали одноствольную ДВ, в 23,8 % – бифуркационную (рис. 3, 4).
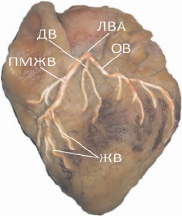
Рис. 3. Коррозионный препарат сердца № 28. Переднелатеральная поверхность (тупой край сердца)
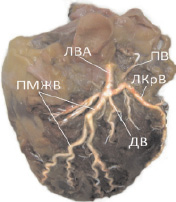
Рис. 4. Коррозионный препарат сердца № 24. Переднелатеральная поверхность (тупой край сердца)
Угол α ДВ от ствола ЛВА варьировал от 1,0 до 28,0° и в среднем составил 8,5 ± 1,2°. Длина IV сегмента ЛВА высоко изменчива (Cv = 30,5 %) и варьировала от 44,8 до 121,0 мм (70,9 ± 4,1 мм, s = 21,6 мм). Угол β ДВ-ПМЖВ в среднем был равен 31,1 ± 1,6° (от 20,0 до 55,0°, s = 10,0°), коэффициент вариации высокий (Cv = 32,2 %). Угол β ДВ-ОВ высоко вариабелен (Cv = 30,9 %) и колебался в пределах 35–113°, в среднем составляя 64,4 ± 3,1°, s = 19,9°. С возрастом угол α ДВ и угол β ДВ-ПМЖВ проявляют слабую отрицательную корреляционную зависимость (r = –0,11 и –0,14; p < 0,05), а угол β ДВ-ОВ – умеренную положительную (r = 0,41; p < 0,006).
Таким образом, анализ углов отклонения и разветвления показал индивидуальную, вариантную, сегментарную и возрастную изменчивость ангиоархитектоники левой венечной артерии. Однако провести точные сопоставления с данными литературы сложно, так как многие исследователи в своих работах [4, 8] не указывают, какой угол они называют «углом отхождения», и не описывают методику его измерения.
Заключение
Полученные морфологические данные характеризуют закономерности изменчивости топографии эпикардиально расположенных ветвей левой венечной артерии у взрослых мужчин. Несомненно, уточненные данные по клинической анатомии левой венечной артерии и ее ветвей необходимы при проведении и планировании различного вида реконструктивно-восстановительных операций по поводу ИБС с целью предупреждения развития осложнений и обеспечения адекватной реваскуляризации миокарда. Детализированные данные о хирургической анатомии левой венечной артерии являются базисом для создания математической модели ее сосудистого русла, что является весьма актуальным для развития персонализированной медицины.
Рецензенты:
Калмин О.В., д.м.н., профессор, заведующий кафедрой анатомии человека, ФГБОУ ВПО «Пензенский государственный университет» Минобрнауки России, г. Пенза;
Баландина И.А., д.м.н., профессор, заведующая кафедрой нормальной, топографической и клинической анатомии, оперативной хирургии, ГБОУ ВПО «Пермский государственный медицинский университет им. акад. Е.А. Вагнера» Минздрава России, г. Пермь.



