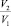Извлечение цветных и редких металлов из техногенных отходов может быть осуществлено с помощью прямого синтеза комплексных соединений [2]. В реакцию с органическим лигандом в апротонном растворителе вступает нуль-валентный металл или его химическое соединение с ковалентными связями. Этот процесс может быть интенсифицирован в присутствии мицелл ПАВ [5, 7]. Обычно для реакций органического синтеза это связывают с проявлением мицеллярного катализа: мицеллы ПАВ ускоряют реакции, выполняя роль нанореакторов. В процессе коррозионной защиты металлов мицеллы ПАВ доставляют ингибитор на поверхность металла, подавляя коррозионный процесс [3].
Целью данной работы явилось изучение влияния различных по природе ПАВ: неионогенных (НПАВ), катионогенных (КПАВ), анионогенных (АПАВ) на реакционную способность донорно-акцепторной системы «медь – апротонный растворитель – 2-окси-1-бензилиденанилин». В качестве растворителей использовали диполярные апротонные среды различной полярности и вязкости: N,N-диметилформамид (ДМФ), N-метил-2-пирролидон (МП) и трибутилфосфат (ТБФ), кинетика растворения меди в которых исследована ранее [8].
Материал и методы исследования
Для исследования влияния ПАВ выбраны НПАВ ОП-7 (полиоксиэтиленовые эфиры алкилфенолов), АПАВ – додецилсульфат натрия (SDS) и КПАВ – иодид тетрабутиламмония (ТБАI). ОП-7 образует небольшое число оксиэтиленовых групп и в значительной степени способствует образованию обращенных мицелл. Выбор SDS и ТБАI обусловлен их доступностью, возможностью образования большой удельной поверхности и невысокой стоимостью.
Результаты исследования и их обсуждение
В литературных источниках отсутствуют данные о ККМ исследуемых ПАВ в диполярных апротонных растворителях. Поскольку влияние ПАВ обнаруживается при концентрациях выше и ниже критических, нами были определены ККМ методами максимального давления в пузырьке по Ребиндеру (МДП) и вискозометрии. Вязкость раствора определяли с помощью капиллярного вискозиметра Убеллоде. Эти методы измерения позволили выявить области мицеллообразования апротонных растворов ПАВ. Точки перегиба на кривых зависимостей поверхностное натяжение – концентрация ПАВ (σ – СПАВ) и приведенная вязкость – концентрация ПАВ (ηприв – СПАВ) можно связать с изменениями структуры растворов. Установлены точки перехода от молекулярного раствора ПАВ к раствору, содержащему мицеллы (ККМ1), и последующие изменения симметрии этих агрегатов как ККМ2, ККМ3 [1, 4, 6]. Экспериментально подтверждено изменение размеров наноструктурированных агрегатов во времени [9].
Характеристики использованных ПАВ и значения ККМ представлены в табл. 1.
Как следует из табл. 1, низкие значения ККМ1 имеет АПАВ – додецилсульфат натрия в ДМФ.
Кинетические особенности комплексообразования меди изучали при погружении пластины металла площадью 6,25 см2 в раствор апротонного растворителя, содержащего 0,1 М лиганда, и ПАВ, при интенсивном перемешивании, свободном доступе кислорода воздуха и температуре 298 К. Концентрацию полученных комплексных соединений определяли измерением оптической плотности окрашенных растворов с помощью фотоколориметра при длине волны 490 нм и рабочей длине кюветы 10 мм. Скорость процесса растворения находили по убыли массы меди и изменению концентрации комплексных соединений во времени. Состав полученных комплексных соединений определяли методом Гарвея – Меннинга; строение – совокупностью методов ИКС, УФ-спектров, элементного анализа. Спектроскопические исследования проводили на спектрофотометре CHITA CHI-1800, электронные спектры снимались на SPECORD-75 IR. Комплексное соединение идентифицировано как CuL2 (состав 1:2), т.е. бис (2-окси-1-бензилиденанилинат меди) как в домицеллярной области концентраций ПАВ, так и при концентрациях, равных ККМ1, ККМ2, ККМ3.
Исследование кинетических закономерностей процесса показало, что в присутствии мицелл ПАВ в апротонном растворителе скорость реакции увеличивается. На рисунке в качестве примера приведены изотермы поверхностного натяжения, приведенной вязкости и скорости комплексообразования в зависимости от концентрации ОП-7 в ТБФ. Кривые зависимости V = f(CПАВ) имеют перегибы. Максимальные значения скорости приходятся на области, близкие к ККМ1, ККМ2, т.е. на области формирования микрофаз в обратномицеллярных растворах. В табл. 2 приведены данные по физико-химическим свойствам растворителей и скорости комплексообразования меди и азометина, как в системах, не содержающих ПАВ, так и в их присутствии.
Таблица 1
Значения ККМ1, ККМ2 и ККМ3 в диполярных апротонных растворителях
|
ПАВ |
Формула ПАВ |
Растворитель |
ККМ1·103, моль/л (масс., %) |
ККМ2·103, моль/л (масс., %) |
ККМ3·103, моль/л (масс., %) |
|
SDS (АПАВ) |
C12H25SO4Na |
Диметилформамид |
0,35 (0,01) |
5,27 (1,5) |
90,15 (2,6) |
|
ТБАI (КПАВ) |
(С4H9)4NI |
Диметилформамид |
2,59 (0,1) |
7,77 (0,3) |
– |
|
ОП-7 (НПАВ) |
CnH2n+2C6H4O (C2H4O)mH |
Диметилформамид |
76,15 (3,7) |
309,51 (15) |
516,23 (25) |
|
N-метил-2-пирролидон |
20,66 (2) |
123,97 (15) |
185,95 (25) |
||
|
Трибутилфосфат |
10,95 (0,1) |
61,98 (3) |
– |
Примечание. ОП-7 – полиоксиэтиленовые эфиры алкилфенолов, n = 8–10, m = 6–7, SDS – додецилсульфат натрия, ТБАI – тетрабутиламмоний иодистый.
Таблица 2
Физико-химические свойства растворителей и скорости реакций комплексообразования без ПАВ (V1), с введением ПАВ (V2) при СПАВ = ККМ1 и (V3) при СПАВ = ККМ2
|
Растворитель |
Ет |
ε |
AN |
η∙103, Н·с·м–2 |
ПАВ |
Скорость комплексообразования, V∙103, моль·см–2·ч–1 |
|
|
||
|
V1 без ПАВ |
V2 СПАВ = ККМ1 |
V3 СПАВ = ККМ2 |
||||||||
|
Диметил-формамид |
43,8 |
36,71 |
16 |
0,796 |
SDS (АПАВ) |
5,1 |
25,1 |
43,2 |
4,92 |
8,47 |
|
TБАI (КПАВ) |
5,1 |
58,65 |
28,8 |
11,5 |
5,64 |
|||||
|
ОП-7 (НПАВ) |
5,1 |
28,8 |
18 |
5,64 |
3,52 |
|||||
|
N-метил-2-пирролидон |
42,2 |
32 |
13,3 |
1,663 |
ОП-7 |
4,98 |
17,5 |
15,9 |
3,51 |
2,71 |
|
Трибутил-фосфат |
37,4 |
8,16 |
9,0 |
3,336 |
ОП-7 |
1,20 |
10,2 |
6,2 |
8,5 |
5,2 |
Примечания: Ет – параметр Димрота – Рейнхардта, учитывающий полярность и поляризуемость растворителя; ε – диэлектрическая проницаемость; η – динамическая вязкость; AN – акцепторное число по Гутману – Майеру.
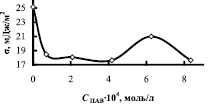
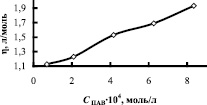
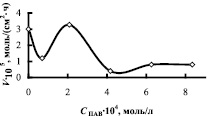
Зависимость поверхностного натяжения σ, приведенной вязкости η и скорости комплексообразования V от концентрации ПАВ в системе медь-лиганд-трибутилфосфат-ОП-7
Как следует из данных табл. 2, наибольшему значению фактора ускорения V2/V1 содействует катионное ПАВ – иодид тетрабутиламмония и анионное ПАВ – додецилсульфат натрия в растворителе высокой полярности – диметилформамиде. Скорость увеличивается в 11,5 и 8,5 раз при введении относительно небольших количеств ПАВ ТБАI – 0,1 масс. % и SDS – 0,01 масс. %.
Следует отметить, что влияние физико-химических свойств растворителя на реакционную способность металла и лиганда сохраняется и в случае введения ПАВ. Скорость комплексообразования возрастает в ряду растворителей трибутилфосфат – N-метил-2-пирролидон – диметилформамид. Это согласуется с уменьшением параметра электрофильности Димрота – Рейнхардта ЕТ, акцепторного числа растворителей AN, диэлектрической проницаемости ε и с увеличением вязкости растворителей η. Введение ПАВ в концентрациях, равных ККМ, увеличивает скорость независимо от природы растворителя.
Предложен механизм прямого синтеза комплексных соединений в мицеллярных системах. Первоначально мицеллы ПАВ аккумулируют лиганд. Доставка лиганда к поверхности металла осуществляется в обратных мицеллах ПАВ. На поверхности металла после адсорбции мицелл и последующего их разрушения возникает повышенная концентрация лиганда. Это приводит к увеличению скорости реакции [9]. В домицеллярных областях и в области концентраций ПАВ между ККМ1 и ККМ2 скорость реакции или не изменяется или незначительно снижается. Следовательно, величины концентраций ПАВ, при которых наблюдается возрастание скорости реакции, определяются мицеллообразованием.
Вывод
Введение ПАВ в донорно-акцепторные системы на основе апротонных растворителей приводит при достижении ККМ к наноструктурированию реакционной среды и к интенсификации процесса прямого синтеза комплексных соединений. Появление мицелл ПАВ в донорно-акцепторных системах может быть использовано для оптимизации технологии извлечения цветных и редких металлов из бедного рудного сырья и техногенных отходов с низким содержанием извлекаемых металлических элементов.
Рецензенты:
Таранушич В.А., д.т.н., профессор, Южно-Российский государственный политехнический университет имени М.И. Платова, г. Новочеркасск;
Ельчанинов М.М., д.х.н., Южно-Российский государственный политехнический университет имени М.И. Платова, г. Новочеркасск.