Несмотря на предпринимаемые усилия, направленные на борьбу с инфекционными заболеваниями, их уровень распространения не только не сокращается, но даже возрастает. Ежегодно во всем мире заболевает около 2 млрд человек, из которых гибнет более 17 млн [9]. При этом начало третьего тысячелетия характеризуется ярко выраженной тенденцией к преобладанию заболеваний вирусной этиологии в общей структуре инфекционной патологии человека и животных, среди которых основными являются острые респираторные вирусные инфекции.
На сегодняшний день существует не менее 3 основных групп этиотропных противогриппозных лекарственных препаратов:
1. Блокаторы М2 ионных каналов вируса гриппа А (амантадин и ремантадин).
2. Ингибиторы функции нейраминидазы вируса гриппа А и В (осельтамивир и занамивир).
3. Другие препараты (рибавирин, интерферон, индукторы интерферонов и т.д.).
Большую проблему представляет появление новых вариантов вирусов, устойчивых к лекарственным противовирусным препаратам [8]. В 2006 г. Центр контроля заболеваний и профилактики США опубликовал материалы, согласно которым в последние годы отмечена необычайно высокая резистентность (более 90 %) вируса гриппа H3N2 к адамантанам [5]. По данным L. Barclay, резистентность вируса гриппа H3N2 к амантадину и римантадину в мире увеличилась с 1,8 % в 2001–2002 гг. до 12,3 % в 2003–2004 гг. [3].
Ранее считалось, что развитие резистентности вируса гриппа к ингибиторам нейраминидазы встречается редко и не является клинической проблемой. Частота резистентности клинических изолятов вируса гриппа А в 2001 году не превышала 1,5 % (резистентность к осельтамивиру составляла 0,32 % у взрослых и 4,1 % у детей), а среди штаммов гриппа В резистентных к препаратам не было обнаружено [7]. Однако по данным Ferraris O. и Lina B., развитие резистентности к ингибиторам нейраминидазы возрастает, и изучение появления резистентности является весьма актуальной проблемой [4]. Это, в первую очередь, обусловлено структурой активного центра нейраминидазы, которая консервативна не только между подтипами, но и типами фермента, что указывает не только на важность всех составляющих его компонентов, но и эволюционно-отлаженную систему его функционирования [6]. Механизм действия NА за счет формирования оксокарбониевого иона субстрата является ключевым моментом в поиске новых соединений, способных в той или иной степени подавлять активность вирусного фермента, т.к. из-за сильных ионных взаимодействий между карбоксилатом субстрата и гуанидиновыми группами аргининов 118, 292 и 371 остаток Neu5Ac переходит из конформации кресла в конформацию полукресла, т.е. образуется оксокарбониевый ион, что приводит к расщеплению гликозидной связи. Другими словами, ингибирующими свойствами может обладать большая группа полифенольных соединений, содержащих фенольную группу и боковые заместители углеродного скелета.
Целью настоящей работы являлось изучение влияния веществ полифенольной природы на активность различных подтипов нейраминидаз вируса гриппа А.
Материалы и методы исследования
В работе были использованы 5 веществ полифенольной природы (рис. 1).
Суспензии и растворы изучаемых препаратов готовили на фосфатно-солевом буфере, рН 7,2.
В качестве объектов исследования были использованы вирусы гриппа птиц и человека (ортомиксовирусы) трех штаммов с различными подтипами нейраминидазы (N1, N2, N6): A/FPV/Rostock/34 (H7N1), А/Алматы/8/98 (H3N2), А/Речная крачка/Коргалжын/847/04 (H3N6). Вирус выращивали в аллантоисной полости 10–11-дневных куриных эмбрионов в течение 24–36 ч. при 37 °С. Титр вируса в аллантоисной жидкости составлял 107–109 ИД50/мл.
В работе были использованы коммерческие лекарственные средства, содержащие полифенолы: «Капилар» (Дигидрокверцетин), «Аскорутин» (Витамин Р) и «Карсил» (Силибинин), а также флавоноидные препараты КВ8 (3-0-(2»-галлоил)-β-D-глюкопиранозид кверцетина) и RAM 3 (3-0-(2»,6»-дигаллоил)-β-D-глюкопиранозид кемпферола), выделенные из растений рода Polygonum, произрастающих на территории Казахстана.
Нейраминидазную активность определяли стандартным тиобарбитуровым методом по Aminoff с использованием в качестве субстрата фетуин [2]. Об активности фермента судили по оптической плотности при длине волны 549 нм.
Обработку данных производили в программе Microsoft Office Excel 2003. Для математической обработки результатов использовали стандартные методы нахождения средних значений и их средних ошибок [1].
Результаты исследования и их обсуждение
В работе изучена способность 5 препаратов полифенольной природы ингибировать нейраминидазную активность поверхностных антигенов ортомиксовирусов.
Исследования проводили на различных штаммах вируса гриппа человека и птиц с разными подтипами нейраминидаз: H7N1, H3N2 и Н3N6. Влияние препаратов на нейраминидазную активность изучали в диапазоне доз от 0,7 до 12,5 мг/мл.
По полученным данным была рассчитана доза вещества, способная подавлять 50 % активности фермента (IC50) (рис. 2). При изучении влияния полифенолов на нейраминидазу вируса гриппа А 2 подтипа (N2) показано, что дигидрокверцетин способен эффективно подавлять активность фермента уже в дозе 0,7 мг/кг, препарат КВ8 – в дозе 1,5 мг/кг. IC50 для препаратов рутина и RAM 3 наблюдалось в дозе 5,7 мг/кг. Силибинин во всем исследованном диапазоне доз не был способен подавить на 50 % активность нейраминидазы подтипа N2.
Далее изучалось влияние полифенольных препаратов на способность снижать активность нейраминидазы вируса гриппа А подтипа 1 (N1). Установлено, что препараты дигидрокверцетин и силибинин в дозе 0,7 мг/кг подавляли 50 % активности нейраминидазы подтипа N1. Препарат RAM 3 был способен подавить 50 % активности фермента подтипа N1 в дозе 3,0 мг/кг, а КВ8 – в дозе 6,2 мг/кг. Наименьшую способность влиять на активность нейраминидазы подтипа N1 показал препарат рутин (11,7 мг/кг).
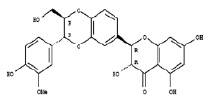 а)
а) 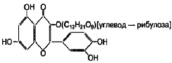 б)
б)
 в)
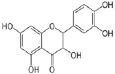
в) 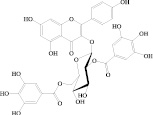 г)
г) 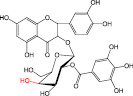 д)
д)
Рис. 1. Химическая структура Силибинина (а), Рутина (б), Дигидрокверцетина (в), RAM 3 (г), КВ8 (д)
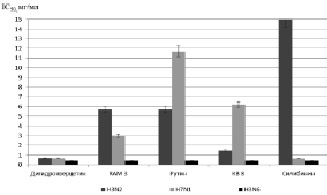
Рис. 2. Подавление активности нейраминидазы вируса гриппа веществами полифенольной природы
При изучении влияния веществ полифенольной природы на снижение активности нейраминидазы вируса гриппа А подтипа 6 (N6) показано, что все исследованные препараты уже в дозе 0,7 мг/кг подавляли более 95 % активности фермента.
Анализ действия исследуемых препаратов на нейраминидазную активность вируса гриппа А с разными подтипами нейраминидазы (H7N1, Н3N6, H3N2) показал, что дигидрокверцетин и КВ8 снижают активность нейраминидазы подтипа N2 наиболее эффективно, что по-видимому связано с отсутствием двойной связи между 2 и 3 атомами углерода в С кольце. Препараты RAM 3 и рутин проявляют сходную активность при воздействии на нейраминидазу подтипа N2, что, скорее всего, связано с наличием углеводного компонента в структуре этих соединений. Силибинин, единственный из изученных препаратов имеющий в своем составе метильную группу проявлял наименьшую способность снижать активность нейраминидазы подтипа N2.
Установлено, что наибольшей способностью подавлять активность нейраминидазы подтипа N1 вируса гриппа А, обладали препараты дигидрокверцетин и силибинин, что возможно связано с наличием у них гидроксильных групп в положении С-3, 5, 7 С и А колец. Нейраминидазная активность препаратов RAM 3 и КВ8 была ниже, что может быть связано с увеличением молекулы вещества и заменой гидроксильной группы по 3-О положению С кольца на углеводный компонент, содержащий остатки галловой кислоты. Наименьшую способность подавлять нейраминидазу подтипа N1 вируса гриппа А показал препарат рутин, сходный по химической структуре с препаратами RAM 3 и КВ8, но не содержащий остатков галловой кислоты.
Показано, что вещества полифенольной природы в изученном диапазоне доз обладали одинаково эффективной способностью снижать активность нейраминидазы вируса гриппа А подтипа N6, что скорее всего связано с менее специфичным активным центром данного фермента.
Заключение
Таким образом показано, что препарат дигидрокверцитин обладал одинаковой способностью эффективно снижать активность нейраминидазы вируса гриппа А подтипов N1, N2 и N6. В зависимости от изменения структуры веществ полифенольной природы изменялась и их способность подавлять ферментативную активность нейраминидазы вируса гриппа А подтипов N1, N2 и N6. Так, отсутствие двойной связи между 2 и 3 атомами углерода в С кольце фенольного соединения, делает его наиболее активным против нейраминидазы подтипа N2, а наличие метильной группы значительно снижает антинейраминидазную активность вещества. Наибольшую способность подавлять активность нейраминидазы подтипа N1 вируса гриппа А проявляли вещества, содержащие гидроксильные группы в положении С-3, 5, 7 С и А колец, а наименьшую показало вещество, содержащее по 3-О положению С кольца углеводный компонент, не содержащий остатки галловой кислоты.
Изученные вещества полифенольной природы обладали одинаково эффективной способностью снижать активность нейраминидазы вируса гриппа А подтипа N6, что скорее всего связано с менее специфичным активным центром данного фермента.
Подобные исследования позволят разработать экспериментально обоснованные рекомендации к применению медикаментозных средств направленного действия для лечения острых респираторных вирусных инфекций.
Работа выполнена благодаря наличию грантовых проектов 0113PK00473 и 0112РКО2471, финансируемых Министерством образования и науки Республики Казахстан.
Рецензенты:
Смирнова И.Э., д.б.н., главный научный сотрудник лаборатории экологии микроорганизмов, Институт микробиологии и вирусологии, г. Алматы;
Кыдырманов А.И., д.в.н., заведующий лабораторией экологии вирусов, Институт микробиологии и вирусологии, г. Алматы.



