В настоящее время композиты составляют одну из наиболее важных групп материалов в стоматологической практике. Они используются при пломбировании всех групп зубов, герметизации фиссур, для фиксации ортопедических конструкций, в качестве облицовочных композитов [3]. Наибольшее распространение получили материалы, органическая матрица которых представляет собой сополимер акриловых и эпоксидных смол, одним из основных мономеров которого является бисфенол – глицидилметакрилат (Bis-GMA) [5], комономерами выступают триэтиленгликольдиметакрилат (TEGDMA) и уретандиметилметакрилат (UDMA). Соотношение и состав мономеров варьируются в зависимости от специфики использования, а также от производителя полимера [2, 9, 10]. Принципиально новыми по химическому строению являются композиты Tet-Sil на основе оксиранов и силоранов – мономеров с открытыми кольцами, не содержащих метакриловые группы. Данные пломбировочные материалы разработаны для уменьшения и преодоления полимеризационной усадки. Очевидно, что различия типов мономеров в составе композита определяют свойства материала, оказывают влияние на степень его полимеризации, биодеградации, химической реактивности [11].
Для оценки потенциального риска возникновения неблагоприятных реакций, обусловленных стоматологическими материалами, изучают преимущественно физические, химические и механические свойства полимера [8, 12]. С целью определения биосовместимости на доклиническом этапе в настоящее время используют изучение цитотоксичности на культуре клеток мышиных фибробластов, контактные тесты полимеров с базофилами цельной крови человека для выявления выброса гистамина, имплантацию композита в ткани полости рта лабораторных животных [1, 4, 6, 7, 9, 13, 14]. Данные методы являются трудоемкими, дорогостоящими, требуют наличия специального оборудования и не дают возможности определить индивидуальную реакцию организма на пломбировочный материал в конкретной клинической ситуации. В этом плане актуально создание новых in vitro тестов для изучения биосовместимости полимерных стоматологических материалов, оптимизации клинического выбора композита.
Цель исследования: изучить характер влияния композитов на структурно-функциональные свойства клеток крови в модельных опытах для определения биосовместимости стоматологических материалов.
Материалы и методы исследования
В исследовании принимали участие 60 соматических здоровых лиц с санированной полостью рта в возрасте от 18 до 21 года. Материалом служила венозная кровь, взятая стандартным методом. Контрольную группу составили 22 человека, экспериментальную – 38 человек. Влияние метакрилата и оксирана изучали в двух подгруппах, действуя на образцы крови неполимеризованным и полимеризованным материалом.
Исследование структурно-функциональных характеристик клеток крови осуществлялось с использованием автоматического гематологического анализатора Sismex КХ-21 до и после 30-минутной инкубации с композитами. Также после предварительного окрашивания по методу Лейшмана проводилась ультрамикроскопия препаратов крови на микроскопе Zeiss Axiostar (×1500). Статистическую обработку полученных результатов проводили с помощью компьютерной программы «ANOVA».
Таблица 1
Влияние неполимеризованного и полимеризованного материала на основе метакрилата на гематологические показатели (M ± St.dev.)
|
№ п/п |
Показатели |
Контрольная группа (n = 22) |
Экспериментальная группа, неполимеризованный материал (n = 19) |
Экспериментальная группа, полимеризованный материал (n = 19) |
|
1 |
Лейкоциты (WBC, × 109/л) |
6,10 ± 0,45 |
5,97 ± 0,40 |
6,18 ± 0,56 |
|
2 |
Эритроциты (RBC, × 1012/л) |
4,90 ± 0,15 |
5,06 ± 0,15 |
5,27 ± 0,14* |
|
3 |
Гемоглобин (HGB, × 10 г/л) |
14,33 ± 0,44 |
15,34 ± 0,54* |
15,74 ± 0,41* |
|
4 |
Гематокрит (HCT, %) |
43,11 ± 1,29 |
45,79 ± 1,44* |
46,29 ± 1,28* |
|
5 |
Средний объем эритроцитов (MCV, фл) |
88,01 ± 0,57 |
88,40 ± 0,58 |
87,86 ± 0,70 |
|
6 |
Среднее объемного содержания гемоглобина в эритроците (MCH; пг) |
29,21 ± 0,18 |
30,25 ± 0,32 |
29,88 ± 0,27 |
|
7 |
Среднее содержание гемоглобина (MCHC; г/л) |
33,26 ± 0,18 |
34,22 ± 0,28 |
34,03 ± 0,27 |
|
8 |
Тромбоциты (PLT, ×109/л) |
248,06 ± 20,03 |
247,08 ± 22,22 |
237,94 ± 19,61* |
|
9 |
Лимфоциты (LYM, %) |
34,56 ± 2,04 |
33,36 ± 1,93 |
33,03 ± 2,29 |
|
10 |
Клетки среднего размера(MXD, %) |
10,79 ± 1,13 |
11,21 ± 2,35 |
8,78 ± 1,82* |
|
11 |
Нейтрофилы (NEUT, %) |
55,48 ± 3,89 |
56,24 ± 4,68 |
60,88 ± 4,33* |
|
12 |
Абсолютное число лейкоцитов в/мкл цельной крови (LYM) |
2,09 ± 0,16 |
1,96 ± 0,15 |
2,00 ± 0,19 |
|
13 |
Абсолютное число базофилов, эозинофилов и моноцитов в/мкл цельной крови (MXD) |
0,74 ± 0,09 |
0,70 ± 0,13 |
0,67 ± 0,15 |
|
14 |
Абсолютное число нейтрофилов в/мкл цельной крови(NEUT) |
3,92 ± 0,45 |
3,82 ± 0,47 |
4,20 ± 0,69 |
|
15 |
Взвешенное распределение тромбоцитов (PDW, фл) |
13,79 ± 0,42 |
13,82 ± 0,49 |
14,57 ± 0,56 |
|
16 |
Средний объем тромбоцита (MPV, фл) |
10,89 ± 0,23 |
10,86 ± 0,22 |
11,28 ± 0,24 |
Примечание. *p = 0,01.
Результаты исследования и их обсуждение
При анализе полученных результатов выявлено, что после инкубации цельной крови с неполимеризованным материалом на основе метакрилата имеется тенденция к увеличению содержания гемоглобина, гематокрита, что, вероятно, обусловлено склеиванием и агрегацией эритроцитов, изменением формы клеток, что отражается на детекции (табл. 1).
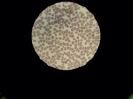
Полученные данные подтверждаются при проведении ультрамикроскопии изучаемых образцов. Так, при микроскопии препаратов крови контрольной группы обнаружены эритроциты обычной формы с центральным просветлением (рис. 1, А). В препаратах крови после инкубации с неполимеризованным материалом на основе метакрилата заметно склеивание, агрегация эритроцитов (++++), выраженная деформация мембраны, которая приобретает бугристую форму (рис. 1, Б).
Под влиянием полимеризованного метакрилата происходит более выраженное увеличение концентрации гемоглобина (+ 10,0 %, р = 0,01), значения гематокрита (+ 7,4 %, р = 0,01), которое, вероятно, обусловлено агрегацией эритроцитов, что отчетливо наблюдается при микроскопии данных образцов (рис. 1, В). Кроме того, выявлены явления склеивания, агрегации эритроцитов, так называемые «монетные столбики», определяется сгущение и увеличение количества эритроцитов в поле зрения, обнаруживается явление пойкилоцитоза (овалоцитоза).
Также выявлено влияние исследуемого материала на показатели лейкоцитарного ряда. Отмечается выраженное снижение количества клеток MXD-группы – моноцитов, эозинофилов, базофилов на 18,6 % относительно значения в контроле (р = 0,01), увеличение количества нейтрофилов на 9,7 % (р = 0,01), отражающее сдвиги в лейкоцитарной формуле. Обнаружена тенденция к снижению количества тромбоцитов (табл. 1).
При оценке показателей клеточного состава крови, инкубированной с материалом на основе оксирана, выявлено увеличение содержания гемоглобина (+ 13,0 %; р ≤ 0,01), тенденция к увеличению гематокрита (+ 9,0 %, р = 0,01) (табл. 2).
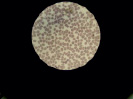
При микроскопии в образцах крови после инкубации с неполимеризованным материалом на основе оксирана определяется изменение формы и усиление агрегации эритроцитов с большим количеством агрегатов (++++) (рис. 2, Б).
При сравнении гематологических показателей после инкубации с полимеризованными порциями материала с показателями контрольной группы определяется тенденция к увеличению гематокрита (+ 8,2 %; р = 0,01), количества эритроцитов, содержания гемоглобина (+ 8,1 % и + 12,3 % соответственно; р = 0,01) (табл. 2).
Выявляются также изменения в лейкоцитарной формуле, проявляющиеся в снижении количества MXD-клеток на 15,3 % (р = 0,01), увеличении количества нейтрофилов на 10,6 % (р = 0,01), тенденции к снижению числа лимфоцитов. Данные изменения, вероятно, обусловлены фиксацией клеток в белковом монослое, образующемся на поверхности полимера при его взаимодействии с кровью.
Примечательным является тот факт, что при микроскопии образцов крови после инкубации с полимеризованным материалом на основе оксирана картина приближена к норме. Определяется монослой эритроцитов без выраженной агрегации (рис. 2, В).
 А)
А) 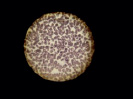 Б)
Б)  В)
В)
Рис. 1. Препараты крови, инкубированной с композитом на основе метакрилата: А – контрольный образец, Б – препарат крови, инкубированной с неполимеризованным материалом, В – препарат крови, инкубированной с полимеризованным материалом
Таблица 2
Влияние неполимеризованного и полимеризованного материала на основе оксирана на показатели клеточного состава крови (M ± St.dev.)
|
№ п/п |
Показатели |
Контрольная группа (n = 22) |
Экспериментальная группа, неполимеризованный материал (n = 19) |
Экспериментальная группа, полимеризованный материал (n = 19) |
|
1 |
Лейкоциты (WBC, × 109/л) |
6,10 ± 0,45 |
5,96 ± 0,46 |
6,12 ± 0,53 |
|
2 |
Эритроциты (RBC, × 1012/л) |
4,90 ± 0,15 |
5,31 ± 0,14 |
5,30 ± 0,14* |
|
3 |
Гемоглобин (HGB, × 10 г/л) |
14,33 ± 0,44 |
16,20 ± 0,52* |
16,09 ± 0,52* |
|
4 |
Гематокрит (HCT, %) |
43,11 ± 1,29 |
46,98 ± 1,30* |
46,65 ± 1,29* |
|
5 |
Средний объем эритроцитов (MCV, фл) |
88,01 ± 0,57 |
88,54 ± 0,58 |
87,98 ± 0,69 |
|
6 |
Среднее объемного содержания гемоглобина в эритроците (MCH; пг) |
29,21 ± 0,18 |
30,49 ± 0,34 |
30,33 ± 0,36 |
|
7 |
Среднее содержание гемоглобина (MCHC; г/л) |
33,26 ± 0,18 |
34,44 ± 0,28 |
34,46 ± 0,30 |
|
8 |
Тромбоциты (PLT, ×109/л) |
248,06 ± 20,03 |
243,42 ± 23,65 |
226,35 ± 19,71* |
|
9 |
Лимфоциты (LYM, %) |
35,15 ± 2,04 |
33,90 ± 1,61 |
33,31 ± 2,21* |
|
10 |
Клетки среднего размера (MXD, %) |
12,12 ± 1,41 |
12,74 ± 1,75 |
10,27 ± 2,65* |
|
11 |
Нейтрофилы (NEUT, %) |
50,75 ± 4,79 |
52,30 ± 4,28 |
56,15 ± 4,57* |
|
12 |
Абсолютное число лейкоцитов в/мкл цельной крови (LYM) |
2,09 ± 0,16 |
1,99 ± 0,15 |
2,03 ± 0,18 |
|
13 |
Абсолютное число базофилов, эозинофилов и моноцитов в/мкл цельной крови (MXD) |
0,71 ± 0,12 |
0,79 ± 0,11 |
0,75 ± 0,20 |
|
14 |
Абсолютное число нейтрофилов в/мкл цельной крови (NEUT) |
3,90 ± 0,57 |
3,73 ± 0,59 |
3,63 ± 0,55 |
|
15 |
Взвешенное распределение тромбоцитов (PDW, фл) |
13,79 ± 0,42 |
13,85 ± 0,46 |
14,48 ± 0,53 |
|
16 |
Средний объем тромбоцита (MPV, фл) |
10,89 ± 0,23 |
11,07 ± 0,23 |
11,26 ± 0,25 |
|
17 |
Отношение ( %) объема крупных тромбоцитов ко всему объему тромбоцитов (P-LCR) |
32,29 ± 1,90 |
33,44 ± 1,88 |
35,24 ± 2,03 |
Примечание. *p = 0,01.
 А)
А) 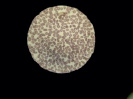 Б)
Б) 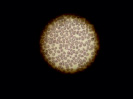 В)
В)
Рис. 2. Препараты крови, инкубированной с композитом на основе оксирана: А – контрольный образец, Б – препарат крови, инкубированной с неполимеризованным материалом, В – препарат крови, инкубированной с полимеризованным материалом
Заключение
Таким образом, полученные результаты позволяют использовать разработанную экспериментальную модель для определения биосовместимости полимерных стоматологических материалов, осуществлять индивидуальный подбор композита в каждом конкретном клиническом случае. Применение данных in vitro тестов выявило мембраноповреждающее действие метакрилата и оксирана, отражающееся в изменениях структурно-функциональных характеристик клеток крови. Причем метакрилат обладает более выраженным повреждающим потенциалом по сравнению с оксираном. Негативное действие композита вследствие биодеградации после полимеризации требует тщательного соблюдения режимов окончательной обработки пломб. Полимеризованные композиты на основе оксирана биоинертны, что дает возможность рекомендовать их для более широкого применения.
Рецензенты:
Тлустенко В.П., д.м.н., профессор, заведующая кафедрой ортопедической стоматологии ГБОУ ВПО СамГМУ Минздрава России, г. Самара;
Кретова И.Г., д.м.н., профессор, заведующая кафедрой безопасности жизнедеятельности и физического воспитания ФГБОУ ВПО «Самарский государственный университет», г. Самара.



