Сахарный диабет (СД) является одним из наиболее распространенных хронических заболеваний. По данным ВОЗ, в настоящее время в мире насчитывается 285 млн больных СД, а к 2025 г. и 2030 г. их количество составит 380 и 435 млн соответственно. Развитие СД обусловлено абсолютной или относительной недостаточностью инсулина, развивающейся в результате воздействия разнообразных факторов. Результатом таких патологических изменений является хроническая гипергликемия, приводящая к нарушениям всех видов обмена, в первую очередь углеводного и энергетического. Нарушение углеводного обмена и накопление конечных и промежуточных продуктов неферментного гликирования белков, а также других продуктов измененного метаболизма приводят к структурным и функциональным изменениям в эпидермисе, дерме, фолликулах и потовых железах. Такие нарушения в сочетании с диабетическими макро- и микроангиопатиями, нарушениями локальной и общей иммунологической реактивности лежат в основе развития поражения кожи при СД 2 типа. Иногда проявления кожной патологии могут выступать в качестве первых признаков нарушения углеводного обмена. К настоящему времени описано около 30 видов дерматозов, сопутствующих СД 2 типа, в том числе псориаз, дисгидротическая экзема, атопический дерматит и др. [4, 8, 9, 10].
Исследования последних лет отчетливо показали, что такие заболевания как СД и псориаз, относятся к группе патологий, сопровождающихся дисбалансом в прооксидантно-антиоксидантной системе организма, с явным подавлением антиокислительного компонента, что ведет к интенсификации свободнорадикального окисления биомолекул и способствует развитию разнообразных осложнений. В развитии поздних осложнений СД оксидативному стрессу, запускаемому гипергликемией, отводится одна из ключевых ролей [11, 12].
В настоящее время остается актуальной разработка новых и совершенствование уже существующих лечебных мероприятий при рассматриваемых патологиях, что связано с высокой степенью инвалидизации и смертности, в результате подверженности микро- и макроангиопатиям жизненно важных органов и систем. Особенно это актуально для течения сочетанных патологий, таких как СД и псориаз, имеющих множество общих звеньев патогенеза, взаимно отягощающих друг друга. В ряде исследований продемонстрирована возможность предупреждения или замедления развития поздних сосудистых осложнений сахарного диабета, а также коррекция метаболических нарушений при псориазе, с помощью средств, обладающих выраженными антиоксидантными свойствами [1, 2, 3, 5, 6]. Однако все еще нет однозначных рекомендаций по применению в терапевтической практике таких препаратов, в особенности при течении сочетанных патологий, взаимно отягощающих друг друга, имеющих целый ряд общих звеньев патогенеза, таких как СД и псориаз. Так же в зачаточном состоянии находятся разработки схем антиоксидантной терапии в зависимости от степени тяжести патологии, наличия тех или иных осложнений.
Целью нашей работы была оценка антиокислительной емкости плазмы крови больных при СД и псориазе, а также их сочетанном течении и экспериментальное обоснование in vitro возможности использования для коррекции дисбаланса антиоксидантной системы парафармацевтика с комбинированным составом: лютеин, зеаксантин, витамины А, С, Е, группы В, микроэлементы цинк, марганец, селен и медь; жирные кислоты омега-3 (супероптик).
Материалы и методы исследования
Наблюдения были выполнены на базе ГБУЗ «Клинический кожно-венерологический диспансер» министерства здравоохранения Краснодарского края. При выполнении исследования было обследовано 22 человека, страдающих СД 2 типа (группа 2, n = 14), а также псориазом при сочетанном течении СД (группа 3, n = 9). Все больные находились на лечении в стационаре по основному заболеванию – псориаз. Соответственно были сформированы 2 опытные группы и одна контрольная, которую составили относительно здоровые доноры (группа 1, n = 12), сопоставимые по поло-возрастным характеристикам с обследуемыми больными.
Объектом исследования была плазма крови пациентов опытных и контрольной групп. Кровь отбирали в утреннее время, натощак из локтевой вены. Полученную венозную кровь центрифугировали при 2000 g в течение 15 минут.
Определение антиокислительной активности (АОА) образцов плазмы крови проводили амперометрически на анализаторе антиоксидантной активности «Яуза-01-ААА» по способу, по которому сначала при определенном потенциале (1,3 В) измеряли электрический ток, возникающий при окислении на поверхности рабочего электрода стандарта (аскорбиновой кислоты в концентрации от 0,1 до 8,0 мг/л), на основании полученных данных строили калибровочный график. Помимо определения АОА плазмы исследуемых групп больных осуществляли определение того же показателя для тех же образцов плазмы, но с добавлением биологической добавки (супероптик) до концентраций, соответствующих приему 1/2, 1 и 2 капсул в сутки (состав 1 капсулы: лютеин 10 мг, зеаксантин 500 мкг, аскорбиновая кислота 60 мг, витамины В1 4 мг, В2 1,6 мг, В3 18 мг, В6 2 мг, В9 200 мкг, В12 1 мкг, Е 10 мг, А 800 мкг, жирные кислоты омега-3 280 мг, цинк 15 мг, марганец 2 мг, медь 1 мг, селен 40 мкг) в среднем объеме циркулирующей плазмы крови. При изучении влияния парафармацевтика с комбинированным составом на антиоксидантную систему у больных группы 3 все исследуемые образцы были разделены на следующие пробы: контрольные пробы (плазма без биологической добавки); плазма после инкубации с биодобавкой; плазма, полученная из цельной крови, которую предварительно инкубировали с парафармацевтиком. Инкубацию осуществляли в течение 10 минут при t = 25 °С. Аналогично проводили инкубацию плазмы и цельной крови с парафармацевтиком в группе 1 (контроль) [7].
Статистическую обработку экспериментальных данных проводили в соответствии с методами, принятыми в вариационной статистике, с использованием программного обеспечения, находящегося в свободном доступе – системы статистического анализа R (R Development Core Team, 2008, достоверным считали различие при р < 0,05).
Результаты исследования и их обсуждение
В результате проведенных исследований было выявлено снижение АОА плазмы крови у всех групп обследованных больных, в сравнении со здоровыми донорами. Так, в группе больных СД 2 типа этот показатель был снижен на 31,8 ± 2,8 %, а при сочетанной патологии псориаза и СД 2 типа снижен на 33,9 ± 2,1 %, что говорит о более глубоких метаболических нарушениях у таких больных (рис. 1).
Изучение влияния парафармацевтика показало, что внесение в плазму крови препарата до концентраций, соответствующих рекомендуемым суточным дозировкам (1 капсула в сутки), повышает ее общую антиоксидантную емкость в контрольной группе на 250,1 ± 11,5 %, а в группе больных с сочетанным течением псориаза и СД 2 типа повышает на 32,7 ± 3,6 %. Полученные результаты могут говорить о резко сниженном антиоксидантном резерве плазмы крови больных, таким образом, что большая часть веществ с антиокислительными свойствами расходуется еще при инкубации биодобавки с плазмой. При добавлении в плазму парафармацевтика до концентрации, соответствующей половине суточной дозы компонентов (половина капсулы в сутки), общая АОА контрольной группы повышалась на 65,2 ± 6,4 %, в то время как аналогичный показатель группы больных с псориазом и сочетанным течением СД 2 типа статистически значимо не изменялся. Инкубация плазмы крови исследуемых групп с парафармацевтиком в концентрации, равной 2 капсулам в сутки, с последующей оценкой общей антиоксидантной активности показала повышение исследуемого показателя в контрольной группе на 180,2 ± 12,9 %, что ниже значений для суточной дозировки компонентов биодобавки и может говорить о полном насыщении плазмы крови веществами антиоксидантной направленности уже при приеме одной капсулы. В группе больных с сочетанным течением псориаза и СД 2 типа при этом АОА возросла на 102,3 ± 5,7 %, что может указывать на целесообразность повышения дозировки парафармацевтика у данной категории больных. Интересными оказались результаты предварительной инкубации добавки с цельной кровью, последующим центрифугированием и отбором плазмы для оценки антиокислительной активности. Исследуемый показатель в этом случае возрастал дозозависимо аналогично предыдущим пробам, но до значений примерно в 2 раза меньших. В контрольной группе антиокислительная емкость возрастала на 140,2 ± 10,1 % при однократной суточной дозировке, при половине суточной дозы – на 42,6 ± 2,1 %, а при двукратной – на 190,5 ± 5,9 %, В 3-й группе наблюдались аналогичные изменения: так, при инкубации с 1/2 суточной концентрацией парафармацевтика антиокислительная емкость существенно не изменялась, при концентрации биологически активной добавки, соответствующей одной суточной норме, АОА возрастала на 20,4 ± 1,0 %, с двойной суточной дозой – на 60,2 ± 2,3 %. Такой характер изменения АОА может быть объяснен или сохранностью метаболизма эритроцитов, при котором расходуется часть веществ с восстановительной активностью, или адсорбцией компонентов добавки эритроцитами (рис. 2).
Таким образом, следует рассмотреть возможность изменений рекомендаций по приему исследуемого парафармацевтического препарата. С позиции полученных данных представляется наиболее целесообразным прием не более одной капсулы в сутки с профилактическими целями, а возможно, даже стоит разработчикам подумать и о снижении концентрации некоторых веществ в расчете на одну капсулу, в то время как прием даже до 2-х капсул в сутки биодобавки больными с дисбалансом прооксидантно-антиоксидантной системы вполне представляется целесообразным. Однако, принимая во внимание сложный комбинированный состав парафармацевтика, следует при такой трактовке результатов иметь в виду возможность передозировки отдельных компонентов, что может вести к значительно большим отрицательным последствиям, чем ее антиоксидантный эффект.
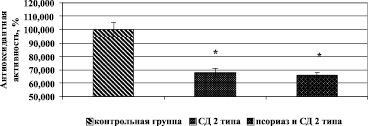
Рис. 1. Антиоксидантная активность плазмы крови при псориазе с сочетанным течением СД 2 типа. Примечание. * – p < 0,05 в сравнении с контрольной группой
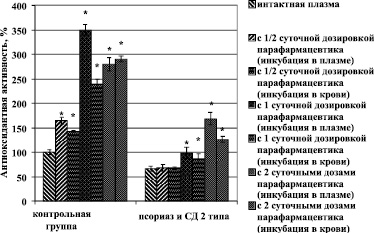
Рис. 2. Влияние парафармацевтика (супероптик) на антиоксидантную активность плазмы крови при сочетанном течении псориаза и СД 2 типа. Примечание. * – р < 0,05 в сравнении с показателями соответствующей группы без добавления парафармацевтика супероптик
Выводы
Таким образом, полученные данные свидетельствуют о значительном снижении общей антиокислительной активности плазмы крови у больных с СД 2 типа и при сочетанном течении псориаза и СД 2 типа и, вероятно, о значимой роли дисбаланса в антиоксидантной системе у данных категорий больных. Изучено влияние парафармацевтического препарата с комбинированным составом (лютеин, зеаксантин, витамины А, С, Е, группы В, микроэлементы цинк, марганец, селен и медь; жирные кислоты омега-3 (супероптик)). Показано значительное повышение антиоксидантной активности плазмы крови, после инкубации ее с парафармацевтиком в концентрациях соответствующих приему 1/2, 1 и 2 капсул в сутки, и возможность применения данной биодобавки для коррекции антиоксидантного статуса у исследуемых категорий больных.
Работа выполнена при поддержке государственного задания Министерства здравоохранения Российской Федерации (от 28.01.2015 г. ч. 1, раздел 1) «Осуществление прикладных научных исследований, в том числе проведение доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов».
Рецензенты:
Павлюченко И.И., д.м.н., профессор, заведующий кафедрой клинической иммунологии, аллергологии и лабораторной диагностики факультета повышения квалификации и профессиональной переподготовки специалистов, ГБОУ ВПО «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Краснодар;
Быков И.М., д.м.н., профессор, заведующий кафедрой фундаментальной и клинической биохимии, ГБОУ ВПО «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Краснодар.



