Разработка методов лечения злокачественных опухолей с помощью клеточных технологий, в частности иммунотерапии, является одним из приоритетных направлений в онкологии. В настоящее время в мире ведется более 300 клинических испытаний по использованию вакцин на основе стволовых и дендритных клеток для лечения онкологических заболеваний, из которых 232 в США и только 3 в России (согласно данным U.S. National Institutes of Health (clinicaltrials.gov). В НИИ клинической иммунологии СО РАМН (Новосибирск) разработаны и готовы к клиническим испытаниям специфические вакцины на основе активированных дендритных клеток, сенсибилизированных опухолевыми антигенами, против рака молочной железы, колоректального рака, рака простаты и яичника [1]. В НИИ онкологии им. Н.Н Петрова (С-Петербург) ведутся исследования по разработке и применению вакцин для иммунотерапии меланомы [2]. Оптимизация технологиии и стандартизация получения противоопухолевых вакцин на основе аутологичных дендритных клеток, диссертация на соискание ученой степени кандидата медицинских наук. Применение клеточных технологий для иммунотерапии онкологических заболеваний может способствовать преодолению резистентности опухоли к химиотерапии и повышению эффективности лечения больных [4, 5, 6].
Среди современных направлений в области вакцинотерапии злокачественных опухолей следует отметить расширение нозологических форм, подлежащих этому методу лечения, а также оптимизацию методов получения дендритноклеточных вакцин и протоколов их применения. Представляется значительной вероятность того, что рак шейки матки, в возникновении которого, как известно, велика роль вирусной инфекции, в частности ВПЧ высокого онкогенного риска, окажется чувствительным к иммунотерапии, например вакцинации дендритно-клеточными вакцинами.
Дендритные клетки (ДК) являются профессиональными антиген-представляющими клетками, участвующими в иммунном ответе благодаря своей способности активировать не только «наивные» CD4+ и CD8+ T-лимфоциты, но и Т-клетки памяти паракортикальных зон периферических лимфоидных органов. В связи с центральной ролью в формировании иммунных реакций изучение ДК является не только крайне важной фундаментальной, но и прикладной медико-биологической задачей. Имеющиеся в современной литературе данные свидетельствуют о значительном уменьшении количества ДК в опухолевой ткани, а также их функциональной неполноценности. В настоящее время разработаны методы получения дендритных клеток из CD34+ костномозговых миелоидных предшественников и моноцитов периферической крови.
Целью данной работы является отработка метода получения зрелых дендритных клеток из крови доноров и больных раком шейки матки для получения ДК-вакцины.
Материалы и методы исследования
Для получения фракции мононуклеарных клеток (МНК) периферической крови использовали ЭДТА-стабилизированную кровь 3-х здоровых женщин (доноров) и 3-х больных раком шейки матки (РШМ) в количестве 50 мл. Возраст доноров составлял 25, 34 и 65 лет; возраст больных 34, 36 и 39 лет.
Работу с клетками человека на всех этапах проводили в стандартных условиях стерильного модуля в ламинарно-потоковом шкафу II класса биологической защиты. Дендритные клетки получали из периферической крови с использованием стандартной процедуры [3]. В качестве ростовой среды использовали среду CellGroDC с добавлением 50 мкг/мл гентамицина, ростовых факторов и факторов дифференцировки GM-CSF (72 нг/мл) и IL-4 (20–45 нг/мл). На 3-й и 5-й день культивирования добавляли свежую порцию GM-CSF (72 нг/мл) и IL-4 (20–45 нг/мл). На 7-й день культивирования клетки из одного флакона использовали для анализа иммунофенотипа незрелых ДК на проточном цитометре. Во второй флакон добавляли ростовые факторы и факторы дифференцировки GM-CSF (72 нг/мл), IL-4 (20–45 нг/мл) и TNF-α (20 нг/мл), а также клеточный лизат культуры клеток HeLa в качестве антигенной нагрузки из расчета 3 клетки культуры HeLa на 1 дендритную клетку. Спустя 48 часов клетки снимали скрепером и после подсчета и анализа жизнеспособности в камере Горяева выполняли иммунофенотипирование зрелых ДК с помощью проточного цитометра путем выделения на графиках популяции МНК-ДК и очистки её от дебриса и лимфоцитов с помощью меток CD45, CD3, CD4, CD8, CD16+56, CD19. Оценка стадии созревания мононуклеаров производилась с помощью антител к CD1a, CD11c, CD14, CD33, CD38, CD83, CD86, HLA-DR.
Характеристика больных
Больная № 1 (34 года) 3 курса полихимиотерапии (ПХТ) в предоперационном периоде, курс дистанционной гамма-терапии (ДГТ). Операция: нервосберегающая экстирпация матки с придатками и верхней третью влагалища, тазовая лимфаденэктомия. Кровь взята в послеоперационном периоде.
Больная № 2 (36 лет) 2 курса ХТ в предоперационном периоде, курс иммунотерапии препаратом «аллокин-альфа». Операция: нервосберегающая экстирпация матки с придатками и верхней третью влагалища, тазовая лимфаденэктомия. Кровь взята в послеоперационном периоде.
Больная № 3 (39 лет) 2 курса ХТ в предоперационном периоде, курс иммунотерапии препаратом «аллокин-альфа». Кровь взята до операции.
Основными критериями отбора больных для настоящего исследования являлись степень распространения процесса, соответствующая по классификации TNM: T1в2N0-хM0, T2аN0-хM0, T2вN0-хM0 и репродуктивный возраст больных.
Критерием исключения служили: наличие метаболического синдрома; наличие отдаленных метастазов, выявленных до начала или в процессе лечения; отсутствие эффекта или прогрессирование заболевания после проведения 2 курсов неоадъювантной химиоиммунотерапии; наличие общих противопоказаний для проведения плазмафереза: критический уровень белка крови (ниже 50 г/л); наличие анемии III ст. (гемоглобин ниже 70 г/л); недренируемый очаг гнойного воспаления; инкурабельные состояния больных.
Результаты исследования и их обсуждение
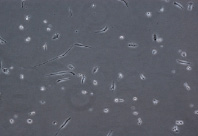
При культивировании МНК крови отмечено, что уже через 3–4 часа начинается процесс прикрепления части моноцитов к субстрату подложки флакона. В процессе адгезии к подложке происходит увеличение размеров клеток, появление единичных отростков, распластывание по субстрату подложки. Через 3 суток становится заметно, что количество прикрепившихся к субстрату МНК здоровых доноров превышает количество МНК больных, что подтверждается и количественными данными, полученными при помощи камеры Горяева (1,5∙106/мл клеток больной и 2,5∙106/мл клеток здорового донора), (рис. 1, а, б). Через 7 сут культивирования в пробе больной присутствует 0,7∙106/мл, в донорской пробе 1,18∙106/мл клеток. Снижение их количества по мере культивирования представляется закономерным, поскольку происходит гибель и отмывание лимфоцитов, после чего на пластике остаются преимущественно ДК различной степени зрелости. На 7-е сутки эксперимента клетки, растущие на подложке флакона, в основном имеют многоугольную, отростчатую и веретеновидную формы (рис. 1, в, г).
На 9-е сутки культивирования дендритных клеток в присутствии GM-CSF, IL-4 и TNF-α, а также лизата культуры HeLa (рис. 2, а, б) отмечены различия между клетками больных и доноров. Характерная для ДК отростчатая или веретеновидная форма более выражена у донорских клеток; они более крупного размера, чем клетки больных.
А Б
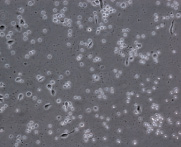
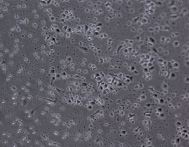
а б
МНК, 3 суток культивирования, GM-CSF (72 нг/мл) и IL-4 (20-45 нг/мл). Об. х10, ок. х10
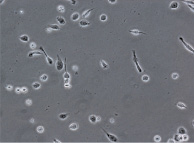
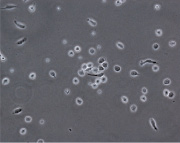
в г
Дендритные клетки, 7-е сутки культивирования. GM-CSF (72 нг/мл), IL-4 (20-45 нг/мл) и TNF-α (20 нг/мл, лизат культуры HeLa).Об. х10, ок. х20
Рис. 1. Количественные и структурные изменения МНК больных и доноров при культивировании в течение 7 дней: А – клетки больной; Б – клетки донора
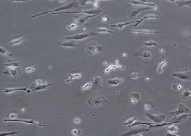
ДК больной ДК донора
Рис. 2. Результаты заключительного этапа генерации ДК из МНК больных и доноров (9 суток культивирования, 48 часов инкубации с лизатом HeLa в присутствии факторов роста и дифференцировки). Об. х20, ок. х10
В таблице представлены результаты оценки эффективности генерации ДК из МНК 6 проб. Как видно из представленных данных, индивидуальная вариабельность результатов весьма значительна; пробы МНК различаются как по количеству выделенных, так и по проценту погибших клеток. У 2-х доноров количество ДК превышало этот показатель больных на 1–2 порядка.
Результаты эксперимента по генерации ДК из МНК доноров и больных РШМ
|
Показатели |
Доноры |
Больные |
||||
|
1 |
2 |
3 |
1 |
2 |
3 |
|
|
Кол-во клеток в 1 мл |
1.793.000 |
400.000 |
297.000 |
6.230.000 |
1.287.000 |
3.157.000 |
|
Погибшие клетки ( %) |
20 |
50 |
30 |
40 |
10 |
35 |
|
Дендритные клетки ( %) |
около 1000 клеток |
50 |
15 |
– |
4 |
0,7 |
А Б
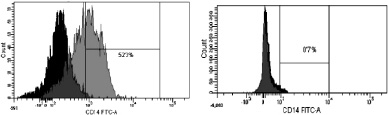
а. CD14
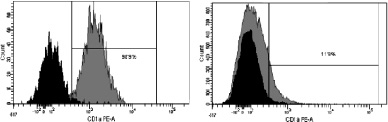
б. CD1а
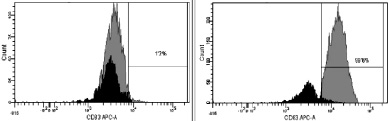
в. CD83
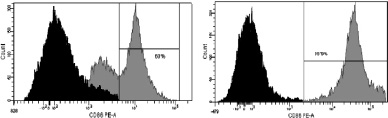
г. CD86
Рис. 3. Динамика изменения иммунофенотипа культуры: А – на 7-й день; Б – на 9-й день культивирования. Серым цветом окрашены ДК, чёрным – клетки, находящиеся в лимфоцитарном гейте
При иммунофенотипировании культуры ДК с использованием моноклональных антител к якорным общелейкоцитарным антигенам и антигенам, характеризующим различные стадии созревания ДК, выявлены следующие закономерности изменения экспрессии поверхностных кластеров дифференцировки (CD). На рис. 3 представлены результаты донорских проб, из которых удалось выделить максимальное количество клеток. По мере созревания культуры и трансформации МНК в дендритные клетки изменялась экспрессия основных поверхностных антигенов CD14, CD1a, CD83, CD86, CD33. Так, при культивировании в присутствии цитокиновых стимуляторов и лизата клеток HeLa в качестве антигена с 7-х по 9-е сутки МНК полностью теряли моноцитарный маркер CD14 (количество экспресирующих его клеток снижалось с 52,3 до 0,7 %; рис. 3, а А, Б) и маркер CD1a (с 98,9 до 11,9 %; рис. 3, б А, Б). При этом в те же сроки на МНК возрастала экспрессия дендритноклеточных рецепторов CD83 (с 1,2 до 99,6 %; рис. 3, в А, Б) и CD86 (с 60 до 99,9 %; рис. 3, г, А, Б), достигая максимальных значений на 9-й день культивирования, что свидетельствует о получении зрелой культуры ДК. Кроме того, по мере созревания ДК отмечалось возрастание экспрессии маркера CD33.
Заключение
Итак, результаты эксперимента по генерации ДК из МНК крови доноров и больных РШМ на основании морфологических и иммунофенотипических критериев показали возможность получения зрелых ДК в условиях, описанных выше. К 9-м суткам культивирования в присутствии GM-CSF, IL-4 и TNF-α, а также лизата культуры HeLa происходит утрата мембранных маркеров моноцитов (СD14, СD1а) при нарастании количества клеток, экспрессирующих маркеры ДК (СD83, СD86), что сопровождается характерными для ДК морфологическими признаками (приобретением многоугольной, отростчатой и веретеновидной формы). В этот срок наблюдения маркеры зрелых ДК экспрессированы на 99,6 % (СD83) и 99,9 % (СD86) клеток. Добавление лизата культуры HeLa в последние 2 дня культивирования ДК не угнетает их дифференцировку, а напротив, потенциально может являться фактором ее стимуляции.
Работа создана при поддержке гранта «Новые технологии молекулярной детоксикации и клеточной иммунологии в персонализированном лечении больных при злокачественных опухолях гениталий» МК-4427.2014.7.
Рецензенты:
Шихлярова А.И., д.б.н., профессор, заведующая лабораторией изыскания новых противоопухолевых средств, ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России, г. Ростов-на-Дону;
Николаева Н.В., д.м.н., ассистент кафедры онкологии, ГБОУ ВПО РостГМУ Минздрава России, г. Ростов-на-Дону.



