В настоящее время важной проблемой физиологии адаптационных процессов является исследование диапазона генетически детерминированных физиолого-биохимических реакций организма в ответ на экстремальные воздействия. Известно, что эволюционно сформировавшаяся норма реакции на гипоксию отличается даже у животных одного вида и пола, что находит отражение в особенностях индивидуальной резистентности к гипоксии. Адаптивно-компенсаторный ответ на острую гипоксию и его нейрогуморальная регуляция у животных с различной устойчивостью к гипоксии различаются в широком диапазоне параметров, которые сохраняются на системном, тканевом, клеточном и субклеточном уровнях и, безусловно, могут определять выживаемость животных после тяжелой острой гипоксии/аноксии и восстановление функций [4, 5]. Хорошо известно, что чувствительность животных к гипоксии зависит от соотношения перекисное окисление липидов/антиоксидантные системы в мозге [6], сердце, печени [3]. В то же время многие вопросы тканеспецифичности ответа системы про-и антиоксидантов на экстремальные воздействия остаются открытыми.
Почки, наряду с сердцем и головным мозгом, наиболее уязвимы для повреждающих факторов ишемии и реперфузии [10, 12], а нарушение их функций лежит в основе вторичных нарушений кровообращения, водно-солевого обмена и интоксикации организма [8, 11]. Однако механизмы, определяющие особенности липопероксидации и устойчивости к ишемическим повреждениям почек, вызванным остановкой системного кровообращения, требуют дальнейшего изучения.
Цель работы – выявление закономерностей процессов перекисного окисления липидов в почках у крыс с различной резистентностью к гипоксии в длительной динамике после ишемического повреждения, вызванного остановкой системного кровообращения.
Материалы и методы исследований
Серия экспериментов выполнена на 320 половозрелых самцах неинбредных белых крыс массой 150–180 г, содержавшихся в виварии на стандартном рационе и свободном доступе к воде, после предварительного тестирования на резистентность к гипоксии [1]. По итогам тестирования все животные были разделены на 4 группы – неустойчивые (НеУ), низкоустойчивые (НизУ), среднеустойчивые (СУ) и высокоустойчивые к гипоксии (ВУ). Группы включали по 70 опытных и 10 контрольных крыс. Через неделю после тестирования под общим эфирным наркозом моделировали 5-минутную аноксию интраторакальным пережатием сосудистого пучка сердца по методу В.Г. Корпачева (1982). Реанимация проводилась с помощью наружного массажа сердца и искусственной вентиляции легких. Контрольная группа крыс после тестирования на устойчивость к гипоксии подвергалась эфирному наркозу без моделирования аноксии. Период наблюдения составлял 35 дней.
В гомогенатах тканей почек определяли содержание глутатиона восстановленного (Patterson et al., в модификации Ф.Е. Путилиной, 1982), каталазы (М.А. Королюк, 1988), ТБК-реагирующих продуктов (ТБК-рп) [7].
Результаты статистически обрабатывали параметрическими методами с вычислением средних значений (m), стандартных отклонений (n), достоверность различий средних оценивали по t-критерию Стьюдента, отношения между независимыми и зависимыми переменными исследовали с помощью дисперсионного анализа.
Результаты исследований и их обсуждение
До моделирования аноксии крысы с разной устойчивостью к гипоксии достоверно отличались по уровню функционирования защитных систем в клетках тканей почек. Так, активность каталазы и содержание восстановленного глутатиона были выше у ВУ животных в сравнении со СУ соответственно на 11 % (р < 0,05) и 13 % (Р < 0,05); с НизУ – на 15 % (р < 0,01) и 20,4 % (р < 0,01); с НеУ – на 21 % (р < 0,001) и 28,6 % (р < 0,001). При этом активность процессов ПОЛ по уровню накопления ТБК-рп во всех группах животных не различалась.
После моделирования аноксии при анализе биохимических показателей гомогенатов почек было установлено изменение накопления ТБК-активных продуктов в различной степени во всех экспериментальных группах. В группе ВУ животных в первые сутки после перенесенной аноксии отмечалась тенденция к снижению показателя (93 % от контроля), которая сменилась тенденцией к повышению на 3 сутки (133 %) и статистически значимым повышением на 5-е сутки (163 %, р < 0,05). Далее вплоть до 21-х суток содержание ТБК-рп уменьшалось до 112 %, сохраняя статистически значимое отличие от контроля. Наибольшее значение показателя отмечено к концу периода наблюдения (173 %, р < 0,001). У крыс СУ уровень ТБК-рп во все сроки, кроме 7- х и 14-х суток, был статистически значимо выше контроля, демонстрируя максимумы на 3-и (168 %, р < 0,05) и 35-е сутки (190 %, р < 0,01), минимум на 14 (108 %). У животных НеУ и НизУ к гипоксии направленность изменений совпадала и была статистически значимой у НеУ во все сроки, кроме 3-х, а у НизУ ‒ кроме 14-х суток (р < 0,05). Таким образом, активность процессов липопероксидации была наиболее выражена у НеУ, имела в динамике нелинейный характер с максимумом на 21 сутки. Восстановления уровня ТБК-рп к концу периода наблюдения не произошло ни в одной из групп, он оставался в 1,7–2,0 раза выше контроля, независимо от степени устойчивости к гипоксии. Полученные нами данные согласуются с литературными [8].
Динамика уровня восстановленного глутатиона в гомогенатах ткани почек у животных разных групп имела существенные различия. В первые сутки эксперимента его содержание у неустойчивых к гипоксии животных резко (в 3 раза) падало (р < 0,001), у низкоустойчивых имело тенденцию к снижению, что представляется вполне закономерным, учитывая исходно низкий резерв глутатиона в клетках почек этих животных в контроле. В группе среднеустойчивых и высокоустойчивых наблюдалась тенденция к повышению этого показателя. Совершенно иная картина отмечалась на 5-е сутки: во всех группах животных содержание этого субстрата антиоксидантной защиты было выше нормы, но максимальные значения показателя были в группе НизУ крыс (176 %, р < 0,001), а минимальные ‒ у ВУ (110 %). На протяжении следующих дней наблюдения вплоть до 21 суток снижение уровня восстановленного глутатиона отмечалось в той или иной степени во всех группах, что повторяло ситуацию на первые сутки. К 35 суткам ни в одной из экспериментальных групп показатель так и не пришел к контрольным цифрам, превышая их на 20–30 %. Таким образом, на 5-е сутки острого постреанимационного периода в группах НеУ и НизУ была зарегистрирована кратковременная мобилизация механизмов антиоксидантной защиты, что может быть обусловлено фазным характером гемодинамики после реперфузии [9].
Активность каталазы в гомогенатах почек у крыс с высокой устойчивостью к гипоксии после реперфузии резко значимо повышалась (122 %, р < 0,001), к концу 3-х суток достигала 146 % от контроля (р < 0,001) и держалась приблизительно на этих цифрах до конца второй недели наблюдения, затем начинала снижаться и в конце эксперимента была на уровне исходных значений. В группе СУ в течение всего срока наблюдения показатель был значимо выше контроля. Животные низкоустойчивые и неустойчивые к гипоксии реагировали на перенесенную аноксию значимым снижением активности каталазы в первые 5 суток. Минимум наблюдался у НизУ на 1-е сутки (85 %, р < 0,05), у НеУ на 3-и (58 %, р < 0,001).
Таким образом, в первые трое суток у этих животных страдают и неферментативное (глутатион), и ферментативное (каталаза) звенья антиоксидантной защиты. Хотя каталаза является ферментом, достаточно устойчивым к нарушениям свободно-радикального гомеостаза [2], тяжелое гипоксическое воздействие на животных с исходно низким уровнем каталазы вызывает критическое снижение ее активности. На 5-е сутки на фоне снижения каталазы адаптационно-приспособительная реакция осуществляется за счет напряжения неферментативного глутатионового звена.
Некоторое усиление каталазной активности регистрировалось на 7-е сутки (НизУ до 133 %, НеУ до 120 %), это были максимальные значения за весь период наблюдения. Восстановление активности каталазы в тканях почек у этих групп животных до контроля происходило только к 35-м суткам.
Обработка полученных данных с помощью дисперсионного анализа выявила статистически значимое влияние (p < 0,01) устойчивости к гипоксии на уровень ТБК-активных продуктов на 1, 5 и 21 сутки (рис. 1). На 1-е и 21-е сутки устойчивость к гипоксии уменьшала содержание ТБК-рп, т.е. у устойчивых к гипоксии животных их уровень был ниже, чем у неустойчивых. Это свидетельствует о более эффективной работе антиоксидантных систем у высокоустойчивых животных. Полученные результаты позволяют предположить, что на 5-е сутки наблюдался срыв адаптационных процессов у ВУ животных, поскольку уровень ТБК-рп был выше, чем у НеУ и НизУ животных.
На рис. 2 хорошо видно, что уровень глутатиона повышается по мере возрастания показателя устойчивости к гипоксии (p < 0,001), и самый низкий его уровень соответствует группе НеУ. И вновь на 5-е сутки, очевидно, происходит срыв адаптационно-компенсаторных механизмов у животных, высокоустойчивых к гипоксии.
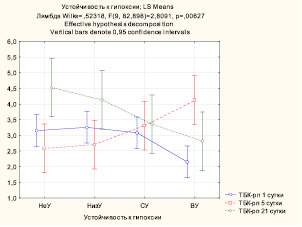
Рис. 1. Влияние устойчивости к гипоксии на уровень ТБК-рп в гомогенате почек
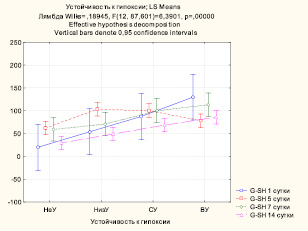
Рис. 2. Влияние устойчивости к гипоксии на содержание восстановленного глутатиона в гомогенате почек
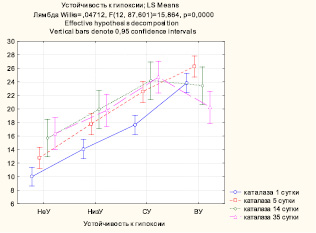
Рис. 3. Влияние устойчивости к гипоксии на активность каталазы в гомогенате почек
Влияние устойчивости к гипоксии на уровень каталазы демонстрирует рис. 3. Различия между средними значениями показателя достоверны во все сроки наблюдения: чем больше резистентность животных к гипоксии, тем выше у них уровень каталазы. И только к концу эксперимента значения показателя в группе ВУ становятся ниже, чем в других группах.
Заключение
Результаты исследований свидетельствуют, что развитие и исход ишемического повреждения почек, вызванного остановкой системного кровообращения, обусловлены индивидуальными физиолого-биохимическими характеристиками животных, которые, очевидно, во многом генетически детерминированы. У крыс высокоустойчивых и среднеустойчивых к гипоксии отмечались исходно высокие показатели антиоксидантной защиты при относительно низкой активности ПОЛ. У животных неустойчивых к гипоксии на фоне недостаточности антиоксидантной защиты наблюдалась высокая активность процессов липопероксидации. Динамика всех показателей носила нелинейный характер с положениями экстремальных точек на 5–7-е и 21-е сутки.
Рецензенты:Каюмова А.Ф., д.м.н., профессор, зав. кафедрой нормальной физиологии, ГБОУ ВПО «Башкирский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Уфа;
Хисматуллина З.Р., д.б.н., зав. кафедрой физиологии человека и зоологии биологического факультета, ФГБОУ ВПО «Башкирский государственный университет» Министерства образования и науки РФ, г. Уфа.
Работа поступила в редакцию 10.03.2015.



