Непрерывное совершенствование каталитических процессов переработки низкокипящих бензиновых фракций позволяет снижать расходы на производство единицы продукции за счет проведения процесса в более мягких условиях, уменьшения доли активного компонента катализатора и, как следствие, его удешевления, увеличения межрегенерационного пробега и общего срока службы катализатора, а также повышения стойкости к каталитическим ядам при сохранении или увеличении его активности и эффективности.
В настоящее время изомеризация является процессом получения наиболее экологичных высокооктановых компонентов автомобильных бензинов. В этой области ведется активная разработка новых технологий и каталитических систем. Основными компонентами фракций, поступающих на установки изомеризации, являются алканы состава С5–С6, а также циклоалканы, среди которых наименьшим октановым числом обладает циклогексан. Изомеризация этих компонентов, обладающих невысокой детонационной стойкостью, заметно улучшает детонационную стойкость товарного бензина. Наиболее известные технологии изомеризации легкокипящих углеводородов основаны на использовании цеолитов, сульфатированных оксидов металлов, а также оксида алюминия, промотированного хлором. Однако все выше перечисленные катализаторы работают при температурах не меньше 150 °С, а в случае использования цеолитов ‒ не ниже 250 °С, а так как известно, что реакция изомеризации углеводородов является слабо экзотермичной, снижение температуры реакции смещает равновесие в сторону образования изомерных углеводородов [2]. Изомеризация циклогексана при высоких температурах протекает с низкой селективностью из-за параллельно протекающих реакций дегидрирования с образованием аренов, а также дециклизации и последующего крекинга образовавшихся алканов. Для выявления активности гетерогенизированных ионных жидкостей к нормальным алканам и циклогексану были проведены соответствующие исследования.
Результаты исследований и их обсуждение
Эксперименты по каталитической изомеризации углеводородов проводили в реакторе из нержавеющей стали марки 12Х18Н10Т, предварительно продуваемом осушенным инертным газом для минимизации воздействия атмосферной влаги на каталитическую систему. Перемешивание и нагрев смеси осуществляли при помощи магнитной мешалки с нагревательным элементом и масляной бани. Температура реакции варьировалась от 40 до 100 °С, давление 1 атм., соотношение твердого катализатора к сырью 1:3, а соотношение активного компонента каталитической системы к сырью составляло 1:10. Продолжительность (время инсталляции) каждого опыта от 1 до 5 часов. Скорость перемешивания смеси составляла 500 об/мин.
Компонентный анализ продуктов изомеризации проводили по ГОСТ Р 52714-2007 на газо-жидкостном хроматографе Хроматэк Кристалл 5000.2, с капиллярной колонкой длиной 100 м и внутренним диаметром 0,25 мм.
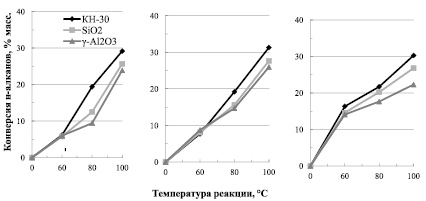
Данные по изомеризации циклогексана приведены на рис. 1.
В процессе изомеризации циклогексана в отличие от изомеризации н-алканов и их смесей практически не происходит образование побочных продуктов каталитической реакции. Минимальная селективность образования метилциклопентана на всех изученных каталитических системах составила 96,5 % масс. В качестве побочных продуктов образуется минимальное количество алканов, как нормального, так и изомерного строения, а также незначительное количество аренов различной молекулярной массы. Все изученные катализаторы увеличивают конверсию циклогексана при повышении температуры и увеличении времени реакции, кроме достижения самых жестких условий эксперимента, а именно температуры реакции 100 °С и времени реакции 300 минут. В последнем случае тенденция к росту конверсии не сохраняется и происходит ее снижение по сравнению с опытами при меньших временах инсталляции. Как известно, равновесие реакции изомеризации циклогексана смещается в сторону образования метилциклопентана при повышении температуры. Рассчитанные равновесные значения циклоалканов при изомеризации в газовой фазе при температуре 500 К имеют следующие параметры: равновесная смесь метилциклопентан (МЦП) – циклогексан (ЦГ) состоит из 25 % МЦП и 75 % ЦГ [4]. Изученные нами каталитические системы позволяют достичь приведенных значений при температуре 100 °С в первый час реакции. Каталитическая система на основе синтетического высококремнеземного цеолитного катализатора (ВКЦ) КН-30 позволяет достаточно существенно сместить равновесие в сторону образования МЦП. Так, из диаграммы Б) на рисунке видно, что выход МЦП превысил 30 % масс. В более ранних исследованиях [1, 5, 6], описывающих термодинамику изомеризации смеси ЦГ (85 % масс.): МЦП (15 % масс.) при использовании чистой ионной жидкости в качестве катализатора, указано, что при температуре 60 °С и соотношении субстрат: катализатор 2:1 заданное равновесие было достигнуто в течение 5 часов протекания реакции. Проведенные нами исследования показали, что при изомеризации чистого ЦГ в подобных условиях такого результата достичь не удается. Причиной этого может служить меньшее количество активного компонента катализатора (ионной жидкости), а также затруднения, связанные с протеканием реакции в диффузионной области при использовании гетерогенного катализатора.
Из анализа полученных данных установлено, что наиболее высокая активность в реакции изомеризации циклогексана была достигнута при участии катализатора на основе ВКЦ КН-30. Данный факт проявился как в скорости протекания реакции, так и достижения максимальной конверсии. В то время как катализаторы на основе γ-Al2O3 и крупнопористого силикагеля показали более скромные и сопоставимые между собой результаты.
а б в
Рис. 1. Зависимость конверсии циклогексана от температуры: а – τ = 60 минут; б – τ = 180 минут; в – τ = 300 минут
Каталитическая система на основе крупнопористого силикагеля, модифицированного ионной жидкостью триэтиламин гидрохлорид – хлорид алюминия, показала положительные результаты в изомеризации пентан-гексановой смеси. Проведение реакции при температуре 60 °С показало наличие активности только при времени проведения эксперимента выше 60 минут. К 180 минутам система достигла состояния равновесия, т.к. при дальнейшем увеличении времени реакции конверсия практически не изменилась. Как видно из таблицы, после 180 минут эксперимента не произошло снижение селективности, что может свидетельствовать о том, что доля реакций крекинга и диспропорционирования невысока. Дальнейшее повышение температуры реакции привело к увеличению активности катализатора и более быстрому достижению системой состояния равновесия. При температуре 80 °С уже после первого часа инсталляции конверсия достигает 27 % масс., а к 180 минутам – 30 % масс. Однако при данной температуре интенсивнее протекает коксообразование, которое уменьшает конверсию сырьевой смеси при длительном времени инсталляции. В частности, накопившиеся изомерные углеводороды, имеющие в своем составе вторичные и третичные атомы углерода, прочнее адсорбируются на активных центрах катализатора и в отсутствии конкуренции со стороны, например, водорода, и через стадию образования карбокатиона полимеризуются, дезактивируя катализатор.
Изомеризация смеси алканов С5, С6 в массовом соотношении 1:1 на крупнопористом силикагеле, модифицированном ионной жидкостью Et3NHCl: AlCl3.
|
Температура реакции, °С |
Время реакции, ч |
Конверсия (C), % масс. |
Si-C6, % масс. |
Si-C4-C12, % масс. |
Выход изоалканов, % масс. |
|||||
|
i-C4 |
i-C5 |
i-C6 |
i-C7 |
i-C8 |
Σ i-C8 + |
|||||
|
60 |
1 |
2,5 |
91,3 |
0,77/1 |
0,0 |
1,0 |
1,3 |
0,0 |
0,0 |
0,0 |
|
3 |
29,3 |
61,6 |
0,84/1 |
5,1 |
8,22 |
9,84 |
3,53 |
1,2 |
0,67 |
|
|
5 |
28,8 |
61,7 |
0,85/1 |
5,0 |
8,15 |
9,61 |
3,41 |
1,2 |
0,7 |
|
|
80 |
1 |
26,9 |
63,2 |
0,85/1 |
4,9 |
7,8 |
9,24 |
3,1 |
1,0 |
0,6 |
|
3 |
30,3 |
60,2 |
0,88/1 |
4,8 |
8,53 |
9,71 |
4,39 |
1,4 |
0,7 |
|
|
5 |
26,3 |
58,4 |
0,99/1 |
5,8 |
7,6 |
7,7 |
3,1 |
1,0 |
0,6 |
|
|
100 |
1 |
25,5 |
62,3 |
0,81/1 |
4,6 |
7,1 |
8,8 |
2,9 |
1,0 |
0,5 |
|
3 |
27,9 |
60,6 |
0,86/1 |
4,9 |
7,8 |
9,05 |
3,9 |
1,1 |
0,5 |
|
|
5 |
25,3 |
60,7 |
0,96/1 |
5,5 |
7,5 |
7,8 |
3,1 |
0,9 |
0,5 |
|
Выгруженный из реактора катализатор, используемый в течение 300 минут, был более темного цвета, чем образцы катализатора, отработавшие 60 и 180 минут. То же самое можно сказать и для экспериментов, проводимых при температуре 100 °С, однако в данном случае еще можно говорить о подавлении реакций изомеризации, что отражено в снижении выхода изопентана и изогексанов. Также немаловажным показателем является содержание продуктов реакций димеризации и крекинга с более высокой, чем у исходных алканов, молекулярной массой, в частности доли изогептанов в катализате.
Падение их выхода после 180 минут реакции происходит для всех температур. При 60 °С снижение выхода изогептанов наименьшее, что свидетельствует о том, что роль процесса полимеризации минимальна. При температурах 80 и 100 °С конечное значение выхода одинаково, что свидетельствует о потере активности катализатора и приближающейся его дезактивации. При температуре 100 °С коксообразование начинается раньше, т.к. на всем протяжении эксперимента выход изогексанов ниже, чем при температуре 80 °С.
Анализ продуктов превращений углеводородов на исследованных каталитических системах позволил выявить следующие вероятные механизмы образования карбений-ионов, в соответствии с составом ионной жидкости, формирующим механизм каталитической активности.
1. Исследуемая ионная жидкость имеет в своем составе хлорид алюминия, являющийся кислотой Льюиса, способный привести к образованию карбений-иона путем отрыва от углеводорода гидрид-иона (рис. 2).
2. Также известно, что ионные жидкости способны проявлять протонную кислотность, а также суперкислотные свойства при наличии водорода на четвертичном атоме азота. Органический катион триэтиламин гидрохлорид используемой ионной жидкости полностью соответствует данным параметрам. Механизм инициирования реакции изомеризации заключается в протолизе C–H или C–C связи с образованием пентакоординированного карбониевого иона и дальнейшим отщеплением молекулы водорода с образованием карбений-иона (рис. 3).
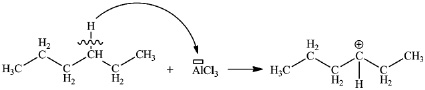
Рис. 2
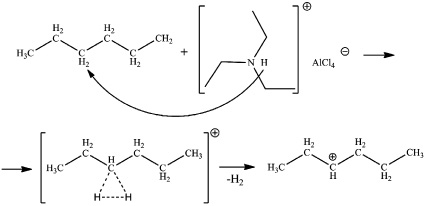
Рис. 3
3. Также существует предположение, что при частичном гидролизе галогенидов металлов, активных в реакции изомеризации, происходит образование дигалогеноксидов, способных вступать в реакцию замещения с алканами, образуя галогеналкилы, которые являются источником карбений-ионов и инициируют реакцию изомеризации [3]. В нашем случае на стадии предварительной обработки носителя хлоридом алюминия образуются подобные дигалогеноксиды, которые в процессе последующей модификации ионной жидкостью предположительно могут трансформироваться в еще более активную форму (рис. 4).

Рис. 4
Соответствие основ данных реакций характеристикам изучаемого катализатора позволяет предположить, что инициирование цепной каталитической реакции изомеризации может проходить по любому из предложенных вариантов. Вероятнее всего, каждая из этих схем инициирования каталитического превращения имеет место в условиях изомеризации на гетерогенизированных ионных жидкостях.
Заключение
Проведен сравнительный анализ активности новых каталитических систем на основе носителей различных типов (цеолитного катализатора КН-30, силикагеля крупнопористого ШСКГ и гамма-оксида алюминия) и иммобилизованной на их поверхности ионной жидкости: триэтиламин гидрохлорид – хлорид алюминия по отношению к углеводородам различных классов. Установлено, что каталитическая система на основе ВКЦ КН-30 в большей степени подходит для изомеризации пентана, пентан-гексановой смеси, а также циклогексана, в то время как изомеризация н-гексана лучше всего протекает с участием катализатора на основе γ-Al2O3. Изомеризация парафиновых углеводородов достигает степени конверсии до 65 % и селективности по изогексанам до 70 % при температурах 60–100 °С.
Рецензенты:Крапивин Г.Д., д.т.н., профессор кафедры биоорганической химии и технической микробиологии, института пищевой и перерабатывающей промышленности, ФГБОУ ВПО «Кубанский государственный технологический университет», г. Краснодар;
Боковикова Т.Н., д.т.н., профессор кафедры химии, метрологии и стандартизации института техносферной безопасности, ФГБОУ ВПО «Кубанский государственный технологический университет», г. Краснодар.
Работа поступила в редакцию 02.03.2015.



