Нарушения параметров липидного обмена являются ведущим фактором в патогенезе атеросклеротического поражения сосудистой стенки. Это заболевание, характеризующееся аккумуляцией липидов и фиброзных элементов в субэндотелиальном пространстве, является одной из главных причин инфаркта миокарда, инсульта, гипертонической болезни [8]. Одним из самых частых и опасных предикторов этих болезней считается нарушение липидного профиля крови, в частности ее плазмы. Липиды в плазме крови присутствуют в составе липопротеинов в виде фосфолипидов (фосфатидилхолин, лизофосфатидилхолин, фосфатидилэтаноламин, лизофосфатидилэтаноламин, сфингомиелин, фосфатидилсерин, фосфатидилинозит, дифосфатидилглицерин) и нейтральных липидов (триацилглицерины, холестерин и его эфиры, свободные жирные кислоты и их эфиры). Это транспортная форма для взаимообмена липидными фракциями между плазмой (в частности, липопротеинами) и мембранами эритроцитов, клеток органов и тканей, субклеточных структур, а также для выведения холестерина из их мембран в печень. Фосфолипиды относятся к легкообменивающимся компонентам, особенно фосфатидилхолин фосфатидилэтаноламин, фосфатидилинозит и сфингомиелин [3]. Липопротеины очень низкой плотности являются главной транспортной формой триглицеридов (их еще называют триацилглицеринами) и холестерина. Эти липидные фракции очень атерогенны, способствуют образованию атеросклеротических бляшек в сосудах, а их повышенное содержание в крови всегда свидетельствует о наличии у пациента атеросклероза. В клинической практике еще крайне редко используют показатели состава фосфо- и нейтральных липидов для анализа состояния липидного обмена, хотя это дает возможность проследить эффективность лечения пациентов, понять механизмы действия исследуемых препаратов и разработать схемы лечения в каждом конкретном случае. Коррекция дислипидемий (ДЛП) остается актуальной проблемой современной медицины. Одним из базисных средств для коррекции нарушений липидного обмена являются статины, представляющие собой ингибиторы ключевого фермента биосинтеза холестерина – ГМГ-КоА-редуктазы. Основным недостатком эффективных гиполипидемических препаратов является их высокая стоимость и наличие в ряде случаев неблагоприятных побочных эффектов и противопоказаний. В связи с этим актуальным является поиск их альтернативы или замены немедикаментозными гиполипидемическими средствами на основе природного сырья, в частности, биологически активными веществами из морских гидробионтов. Значительный интерес в этом плане представляют сульфатированные полисахариды из морских бурых водорослей – фукоиданы, характеризующиеся отсутствием токсичности и обладающие широким спектром биологической активности, в том числе антидислипидемическим, антиоксидантным и противовоспалительным действием [6, 13–15]. Ряд полезных эффектов на организм при ДЛП оказывают альгинаты из морских водорослей. Будучи пищевыми волокнами, они являются эффективными сорбентами холестерина [10].
В литературе мы не обнаружили работ, освещающих динамику фосфо- и нейтральных липидов у пациентов с ДЛП, получавших полисахариды из морских бурых водорослей в течение длительного времени в комплексе со стандартным лечением. В связи с этим целью настоящей работы было изучение влияния полисахаридов из морской бурой водоросли Fucus evanescens на динамику фосфо- и нейтральных липидов плазмы крови у пациентов с ДЛП, получавших эти соединения в виде препарата «Фуколам®» в составе базисной терапии perse и с аторвастатином.
«Фуколам®» – это первый отечественный препарат на основе полисахарида фукоидана, выделенного из водоросли Fucus evanescens (ТИ и ТУ 9284-065-02698170-2005, инструкция по применению). Центром гигиенической сертификации пищевой продукции при Институте питания РАМН проведены соответствующие исследования и экспертиза представленных документов (заключение № 72/Э-6736/б-05 от 20.10.05), получено свидетельство Федерального центра гигиены и эпидемиологии Роспотребнадзора о государственной регистрации № 77.99.23.3.У.739.1.06 от 30.01.06. 7 июня 2006 г. на имя Тихоокеанского института биоорганической химии ДВО РАН (ТИБОХ ДВО РАН) зарегистрирован товарный знак Фуколам-Fucolam (свидетельство № 308197). Фуколам на основании экспертной оценки Минздрава России ГУ НИИ питания РАМН рекомендован в качестве дополнительного источника полисахаридов (фукоидан) и растворимых пищевых волокон (альгинат). Показатели безопасности фуколама не превышают допустимых уровней, регламентируемых СанПин 2.3.2.1078-01. для препаратов из водорослей. Одна капсула содержит 100 мг фукоидана и 400 мг альгиновой кислоты. Промышленный выпуск фуколама осуществляется на экспериментальном производстве ТИБОХ ДВО РАН.
Материалы и методы исследования
В рандомизированном исследовании, обеспечивающем случайное распределение на 3 группы, принимали участие 114 пациентов с ДЛП в возрасте от 45 до 70 лет (средний возраст 60,0 ± 1,3 года). Все обследуемые были распределены на группы: 1 группа (контроль) – 20 практически здоровых людей (доноры); 2-я группа – 36 больных, которые на фоне базисной терапии принимали 10 мг аторвастатина внутрь один раз в день, 3-я группа – 39 больных, которые на фоне базисной терапии принимали фуколам по 1 капсуле внутрь один раз в день; 4-я группа – 39 больных, которые на фоне базисной терапии принимали 10 мг аторвастатина в комплексе с фуколамом по 1 капсуле внутрь один раз в день. Курс лечения составлял 30 дней. После выписки из стационара больные продолжали принимать препараты в течение 180 дней.
В исследование включали пациентов с ДЛП, не получавших ранее статинотерапию; принимавшие статины нерегулярно в малых дозах (5 мг); получавшие по показаниям базисную терапию (антитромбоцитарные препараты, метаболически нейтральные β-адреноблокаторы, ингибиторы ренин-ангиотензин-альдостероновой системы– ингибиторы ангиотензинпревращающего фермента и блокаторы рецепторов ангиотензина II и антагонисты кальция, а также нитраты по «требованию»). Пациенты участвовали в исследовании после подписания на добровольной основе письменного информированного согласия. Критериями исключения из исследования являлось наличие первичной ДЛП по данным анамнеза; хронических заболеваний внутренних органов в фазе обострения; гипотиреоза; сахарного диабета 1 или 2 типа; заболеваний печени и билиарного тракта; хронической почечной недостаточности; инфаркта миокарда, перенесенного менее чем за 3 месяца до начала исследования; хронической сердечной недостаточности III – IV ФК; артериальной гипертензии 3 ст.; индивидуальной непереносимости ингибиторов ГМГ-КоА-редуктазы; наличие противопоказаний, нежелательных реакций, побочных эффектов и возможных взаимодействий гиполипидемических средств (БАВ, лекарственных средств) с другими медикаментами, указанные в инструкциях препаратов и по данным литературы. Эффективность применения фуколама у больных с ДЛП оценивали по лабораторным показателям в динамике через 30, 90 и 180 дней от начала исследования.
Экстракцию липидов из плазмы крови проводили общепринятым методом [12]. Фракционное разделение фосфолипидов осуществляли методом двумерной микротонкослойной хроматографии на силикагеле [17], а их количественное определение по методу [19]. Использовали следующие системы растворителей: в первом направлении – хлороформ:метанол:аммиак (28 %-й) (65:25:5 или 65:35:5, по объему), во втором – хлороформ:ацетон:метанол:ледяная уксусная кислота:вода (30:40:10:10:5 или 50:20:10:10:5, по объему) [16]. Для обнаружения холиносодержащих фосфолипидов (фосфатидилхолин, лизофосфатадилхолин, сфингомиелин) использовали реактив Драгендорфа [20]. Липиды проявлялись в виде оранжевых пятен на желтом фоне. Для обнаружения фосфолипидов, содержащих аминогруппу (фосфатидилэтаноламин, лизофосфатидилэтаноламин, фосфатидилсерин), пластинки опрыскивали 5 %-м раствором нингидрина в ацетоне с последующим нагреванием в течение 2–3 минут над парами воды до появления розовых пятен на белом фоне [16]. Фосфолипиды, содержащие гидроксильную группу (фосфатидилинозит – ФИ), обнаруживали с помощью периодатного реактива Шиффа [4], пятна липидов имели розово-сиреневый цвет. Для проявления всех фосфолипидных фракций применяли молибдатный реактив [18] и реагент на основе малахитового зеленого [19]. Липиды проявлялись в виде синих или зеленых пятен на белом фоне. Хроматографическое распределение нейтральных липидов и их количественное определение проводили методом одномерной микротонкослойной хроматографии на силикагеле в системе растворителей гексан-серный эфир-уксусная кислота в соотношении 90:10:1 (по объему) [11]. Обнаружение пятен нейтральных липидов осуществляли с помощью паров йода. Количественное содержание отдельных фракций выражали в процентах от общей суммы нейтральных липидов и фосфолипидов, соответственно.
Полученные данные были обработаны методом вариационной статистики с использованием пакета программы «Statistica-7» со встроенной процедурой проверки соответствия выборки закону нормального распределения. Для определения статистической значимости различий в зависимости от параметров распределения использовали параметрический t-критерий Стьюдента или непараметрический U-критерий Манна-Уитни. Исследование одобрено Комиссией по вопросам этики МО ДВО РАН (протоколы: № 6 от 14 июля 2009 г, № 9 от 1 ноября 2010 г. и № 12 от 15 октября 2012 г.).
Результаты исследования и их обсуждение
У всех обследованных пациентов с дислипидмией (n = 114) до лечения были выявлены нарушения липидного обмена. Как видно из рисунка при сравнении количественных характеристик фракций нейтральных липидов в плазме крови у больных с таковыми у здоровых доноров была обнаружена гипертриглицеринемия и гиперхолестеринемия.
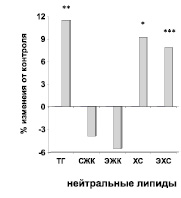
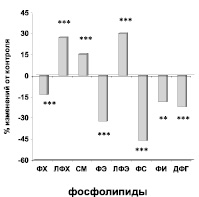
Изменения в содержании фракций нейтральных липидов и фосфолипидов в плазме крови больных пациентов с ДЛП до лечения. Достоверность различий: * – р < 0,05; ** – р < 0,01; *** – р < 0,001. Условные обозначения: ТГ – триглицериды, СЖК – свободные жирные кислоты, ЭЖК – эфиры жирных кислот, ХС – холестерин, ЭХС – эфиры холестерина, ФХ – фосфатидилхолдин, ЛФХ – лизофосфатидилхолин, СМ – сфингомиелин, ФЭ – фосфатидимлэтаноламин, ЛФЭ – лизофосфатидилэтаноламин, ФС – фосфатидилсерин, ФИ – фосфатидилинозит, ДФГ – дифосфатидилглицерин
Так, количество триглицеридов было выше, чем в контроле на 11,4 % (р < 0,01). Количество неэтерифицированного холестерина превышало контрольный уровень на 9,2 % (р < 0,05), а количество этерифицированного холестерина на 7,8 % (р < 0,001). Общий холестерин плазмы крови слагается из двух фракций: неэтерифицированного холестерина или альфа-холестерина и эфиров холестерина. Эфиры холестерина в плазме крови в норме преимущественно находятся в составе липопротеинов низкой плотности (ЛПНП) до 50 % и липопротеинов высокой плотности (ЛПВП) до 20 %. Этерификация холестерина происходит как в ЛПВП, так и в ЛПНП при участии фермента ЛХАТ (лецитин: холестерин-ацилтрансфераза) [5]. В плазме крови обследованных больных выявлено достоверное повышение эфиров холестерина. Известно, что изменения в интиме и медии артерий при развитии атеросклероза обусловлены массивным отложением эфиров холестерина, в составе так называемых «пенистых» клеток. При этом основная масса эфиров холестерина в бляшке при атеросклерозе происходит из циркулирующих в крови ЛПНП [9].
Сравнительный анализ состава фосфолипидных фракций плазмы крови обследованных пациентов с ДЛП (n = 114) (рисунок), с таковыми в контроле показал, что среди холиносодержащих фракций отмечалось достоверное снижение доли фосфатидилхолина на 13,3 % (р < 0,001) при одновременном увеличении лизофосфатидилхолина на 27,2 % (р < 0,001), что может быть обусловлено увеличением активности фосфолипазы А2. Обращает на себя внимание увеличение сфингомиелина на 15,4 % (р < 0,001), что является компенсаторной реакцией на изменения в соотношении холиносодержащих липидов. В составе этаноламиновых фракций фосфолипидов отмечалось уменьшение доли фосфатидилэтаноламина на 32,5 % (р < 0,001) при одновременном увеличении лизофосфатидлэтаноламина на 30,2 % (р < 0,001). Следует отметить снижение содержания метаболически активных фракций фосфолипидов. Так, доля фосфатидилсерина в плазме крови больных по сравнению с контролем была меньше на 46,2 % (р < 0,001), фосфатидилинозита – на 18,7 %, дифосфатидилглицерина – на 22,1 % (р < 0,001). Снижение содержания фосфолипидных фракций в плазме крови, являющихся основными структурными компонентами клеточных мембран (фосфатидилхолин и фосфатидилэтаноламин), предполагает нарушения в структуре мембран эритроцитов, интиме сосудов, которые проявляются увеличением доли холестерина в липидной составляющей мембран [7]. Снижение содержания метаболически активных фракций, по-видимому, можно объяснить активацией фосфолипаз. Это является негативным фактором, поскольку эти фосфолипиды необходимы для функционирования Na+-K+-насоса, ферментов дыхательной цепи митохондрий при синтезе АТФ, моноаминоксидазы и других [1, 2]. Кроме того, так как в их составе преимущественно находятся полиненасыщенные жирные кислоты (арахидоновая, эйкозапентаеновая и докозагексаеновая), то возможно, снижение количества этих фосфолипидов может быть связано и с дефицитом ненасыщенных жирных кислот.
При исследовании показателей нейтральных липидов в плазме крови пациентов с ДЛП в динамике лечения через 30, 90 и 180 дней с использованием различных схем лечения, а также их сравнения с таковыми величинами до лечения, отмечались статистически достоверные изменения (табл. 1).
Предложенные схемы лечения оказывали значительный эффект действия через 30 дней. Так, в плазме крови пациентов 2-й группы по сравнению с таковыми величинами до лечения отмечалось снижение триглицеридов на 5,2 % (р < 0,001), неэтерифицированного холестерина на 7,9 % (р < 0,001) и эфиров холестерина на 5,5 % (р < 0,001). Причем все величины нейтральных липидов были на уровне контрольных значений. В 3-й группе количество триглицеридов снизилось на 10,8 % (р < 0,01), неэтерифицированного холестерина на 11,4 % (р < 0,01) при одновременном снижении эфиров холестерина на 13 % р < 0,001). У пациентов 4-й группы еще более значительно снизилось количество неэтерифицированного холестерина (на 12,9 %, р < 0,001) и эфиров холестерина (на 17,6 %, р < 0,001), при одновременном снижении уровня триглицеридов (на 9,3 %, р < 0,01). То есть лечение в течение 30 дней по трем схемам в сравнении с таковыми величинами до лечения показало однонаправленность изменений во фракциях нейтральных липидов в плазме крови, но с разной степенью выраженности. Через 90 и 180 дней во 2-й группе было зарегистрировано сохранение величин триглицеридов, холестерина и его эфиров на уровне таковых показателей, которые были зарегистрированы на 30-й день лечения, а также на уровне контроля. В то же время наибольший эффект проявился при приеме фуколама (3 группа) и совместном приеме статина и фуколама (4 группа): эти величины были ниже контроля на 13–15 %. То есть фуколам проявлял выраженный статино-подобный эффект.
Таблица 1
Изменение нейтральных липидов в плазме крови пациентов с ДЛП в динамике лечения (в % от суммы всех фракций, М ± m)
|
Показатели |
1 группа (контроль, n = 20) |
Сроки обследования |
2 группа БТ+А10 (n = 36) |
3 группа БТ+Ф (n = 39) |
4 группа БТ+А10+Ф (n = 39) |
|
ТГ |
16,00 ± 0,58 |
до лечения |
***18,15 ± 0,17 |
*18,01 ± 0,35 |
***18,05 ± 0,36 |
|
30 дней |
17,21 ± 0,173 |
16,06 ± 0,462 |
16,37 ± 0,293 |
||
|
90 дней |
16,73 ± 0,163 |
16,65 ± 0,431 |
16,58 ± 0,353 |
||
|
180 дней |
16,82 ± 0,083 |
16,79 ± 0,391 |
16,25 ± 0,303 |
||
|
СЖК |
16,65 ± 0,40 |
до лечения |
15,41 ± 0,21 |
16,99 ± 0,49 |
15,71 ± 0,56 |
|
30 дней |
15,88 ± 0,15 |
16,86 ± 0,45 |
16,29 ± 0,47 |
||
|
90 дней |
16,00 ± 0,21 |
16,24 ± 0,19 |
16,55 ± 0,27 |
||
|
180 дней |
16,80 ± 0,15 |
16,32 ± 0,35 |
16,30 ± 0,19 |
||
|
ЭЖК |
15,65 ± 0,49 |
до лечения |
14,75 ± 0,08 |
14,59 ± 0,53 |
15,15 ± 0,47 |
|
30 дней |
15,13 ± 0,09 |
16,00 ± 0,261 |
15,73 ± 0,44 |
||
|
90 дней |
15,74 ± 0,16 |
15,68 ± 0,49 |
16,27 ± 0,35 |
||
|
180 дней |
16,11 ± 0,14 |
16,37 ± 0,731 |
15,55 ± 0,30 |
||
|
ХС |
17,63 ± 0,50 |
до лечения |
*19,35 ± 0,50 |
**19,64 ± 0,55 |
*19,28 ± 0,50 |
|
30 дней |
17,82 ± 0,133 |
17,41 ± 0,452 |
16,80 ± 0,433 |
||
|
90 дней |
17,00 ± 0,103 |
16,36 ± 0,563 |
***15,05 ± 0,233 |
||
|
180 дней |
16,77 ± 0,143 |
16,81 ± 0493 |
***15,43 ± 0,393 |
||
|
ЭХС |
28,75 ± 0,37 |
до лечения |
***30,50 ± 0,43 |
***31,44 ± 0,53 |
***31,64 ± 0,38 |
|
30 дней |
28,83 ± 0,783 |
**27,37 ± 0,533 |
***26,07 ± 0,533 |
||
|
90 дней |
28,17 ± 0,173 |
**26,92 ± 0,563 |
***26,84 ± 0,453 |
||
|
180 дней |
28,20 ± 0,223 |
**26,42 ± 0,763 |
***26,87 ± 0,323 |
Примечание. Различия статистически значимы при: звездочки слева * – р < 0,05; ** – р < 0,01; *** – р < 0,001 – в сравнении с контрольной группой; цифры справа 1 – р<0,05; 2 – р<0,01; 3 – р < 0,001 – в сравнении с показателями до лечения. Условные обозначения: БТ – базовая терапия; БТ + А10 – пациенты принимали совместно с базовой терапией аторвастатин 10 мг; БТ + Ф – пациенты принимали с базовой терапией фуколам; БТ + А10 + Ф – пациенты принимали с базовой терапией аторвастатин 10 мг и фуколам одновременно. Условные обозначения: ТГ – триглицериды, СЖК – свободные жирные кислоты, ЭЖК – эфиры жирных кислот, ХС – холестерин, ЭХС – эфиры холестерина.
При исследовании влияния использованных схем лечения на динамику показателей фосфолипидных фракций в плазме крови больных ДЛП отмечались достоверные изменения (табл. 2). Так, во 2-й группе через 30 дней лечения количество фосфатидилхолина увеличилось на 4 % ( р < 0,01) при одновременном снижении лизофосфатидилхолина на 14,3 % (р < 0,001) и сфингомиелина на 8,1 % (р < 0,001). Увеличилось количество фосфатидилэтаноламина на 21,9 % (р < 0,001) и снизилось количество лизофосфатидилэтаноламина на 15,7 % (р < 0,001). Одновременно увеличилось количество метаболически активных фракций: фосфатидилсерин на 20,1 % (р < 0,001) и фосфатидилинозит на 19,5 % (р < 0,05). В то же время в 3-й группе количество фосфатидилхолина увеличилось на 9,2 % (р < 0,01) при одновременном снижении лизофосфатидилхолина на 26,7 % (р < 0,001) и сфингомиелина на 19,2 % (р < 0,001). Количество фосфатидилэтаноламина возросло на 33,6 % (р < 0,001), тогда как лизофосфатидилэтаноламина снизилось на 29,7 % (р < 0,001). Уровень метаболически активных фракций увеличился: фосфатидилсерин на 84,2 % (р < 0,001) и дифосфатидилглицерин на 15,2 % (р < 0,001). В плазме крови пациентов 4-й группы через 30 дней лечения количество фосфатидилхолина увеличилось на 10,5 % (р < 0,001).
Одновременно снижались величины лизофосфатидилхолина на 26,4 % (р < 0,001) и сфингомиелина на 18,3 % (р < 0,001). При этом количество фосфатидилэтаноламина возросло на 36,1 % (р < 0,001), а содержание лизофосфатидилэтаноламина снизилось на 34 % (р < 0,001).
Через 90 и 180 дней лечения величины фосфолипидных фракций в плазме крови пациентов всех групп сохранялись на уровне таковых, зарегистрированных через 30 дней лечения, а также на уровне контроля.
Таблица 2
Изменение фосфолипидных фракций в плазме крови пациентов с ДЛП в динамике лечения (в % от суммы всех фракций, М ± m)
|
Показатели |
1 группа (контроль, n = 20) |
Сроки обследования |
2 группа БТ + А10 (n = 36) |
3 группа БТ + Ф (n = 39) |
4 группа БТ + А10 + Ф (n = 39) |
|
ФХ |
46,14 ± 0,76 |
до лечения |
***41,11 ± 0,20 |
***40,27 ± 0,67 |
***40,82 ± 0,59 |
|
30 дней |
42,76 ± 0,432 |
43,97 ± 0,752 |
45,11 ± 0,713 |
||
|
90 дней |
43,24 ± 0,143 |
44,00 ± 0,632 |
44,69 ± 0,483 |
||
|
180 дней |
43,00 ± 0,203 |
44,19 ± 0,653 |
44,33 ± 0,563 |
||
|
ЛФХ |
11,00 ± 0,32 |
до лечения |
***15,17 ± 0,09 |
***15,27 ± 0,41 |
***14,86 ± 0,43 |
|
30 дней |
13,00 ± 0,213 |
11,19 ± 0,353 |
10,94 ± 0,323 |
||
|
90 дней |
13,36 ± 0,173 |
11,62 ± 0,413 |
11,00 ± 0,183 |
||
|
180 дней |
13,00 ± 0,113 |
11,10 ± 0,203 |
11,21 ± 0,173 |
||
|
СМ |
13,00 ± 0,49 |
до лечения |
***15,37 ± 0,16 |
***15,68 ± 0,26 |
***15,05 ± 0,17 |
|
|
|
30 дней |
14,13 ± 0,213 |
12,67 ± 0,333 |
12,29 ± 0,313 |
|
|
|
90 дней |
13,87 ± 0,083 |
12,63 ± 0,513 |
13,48 ± 0,353 |
|
|
|
180 дней |
13,91 ± 0,123 |
12,92 ± 0,343 |
13,50 ± 0,323 |
|
ФЭ |
8,44 ± 0,42 |
до лечения |
***6,27 ± 0,09 |
**6,61 ± 0,33 |
***6,24 ± 0,41 |
|
|
|
30 дней |
7,64 ± 0,123 |
8,83 ± 0,223 |
8,49 ± 0,333 |
|
|
|
90 дней |
7,82 ± 0,203 |
8,47 ± 0,303 |
8,50 ± 0,203 |
|
|
|
180 дней |
7,83 ± 0,093 |
8,62 ± 0,323 |
7,81 ± 0,182 |
|
ЛФЭ |
6,13 ± 0,43 |
до лечения |
***8,71 ± 0,09 |
***8,65 ± 0,27 |
***8,98 ± 0,15 |
|
|
|
30 дней |
7,34 ± 0,193 |
6,08 ± 0,113 |
5,93 ± 0,173 |
|
|
|
90 дней |
6,46 ± 0,153 |
6,10 ± 0,263 |
5,69 ± 0,133 |
|
|
|
180 дней |
6,31 ± 0,093 |
6,11 ± 0,133 |
5,97 ± 0,173 |
|
ФС |
5,00 ± 0,32 |
до лечения |
***3,43 ± 0,09 |
***3,10 ± 0,35 |
**3,75 ± 0,26 |
|
|
|
30 дней |
4,12 ± 0,133 |
5,71 ± 0,323 |
5,51 ± 0,333 |
|
|
|
90 дней |
4,48 ± 0,093 |
5,10 ± 0,502 |
4,99 ± 0,173 |
|
|
|
180 дней |
4,60 ± 0,103 |
5,23 ± 0,293 |
5,10 ± 0,233 |
|
ФИ |
6,10 ± 0,11 |
до лечения |
***4,83 ± 0,07 |
*5,37 ± 0,26 |
**5,24 ± 0,30 |
|
|
|
30 дней |
5,77 ± 0,361 |
5,73 ± 0,09 |
6,14 ± 0,221 |
|
|
|
90 дней |
5,29 ± 0,171 |
6,12 ± 0,251 |
5,64 ± 0,281 |
|
|
|
180 дней |
5,48 ± 0,143 |
5,65 ± 0,26 |
5,92 ± 0,201 |
|
ДФГ |
6,19 ± 0,24 |
до лечения |
***5,11 ± 0,14 |
***5,05 ± 0,11 |
***5,05 ± 0,11 |
|
|
|
30 дней |
5,24 ± 0,05 |
5,82 ± 0,133 |
5,59 ± 0,171 |
|
|
|
90 дней |
5,48 ± 0,13 |
5,96 ± 0,093 |
6,01 ± 0,153 |
|
|
|
180 дней |
5,87 ± 0,003 |
6,20 ± 0,362 |
6,17 ± 0,153 |
Примечание. Различия статистически значимы при: звездочки слева * – р < 0,05; ** – р < 0,01; *** – р < 0,001 – в сравнении с контрольной группой; цифры справа 1 – р < 0,05; 2 – р < 0,01; 3 – р < 0,001 – в сравнении с показателями до лечения. Условные обозначения: БТ – базовая терапия; БТ + А10 – пациенты принимали совместно с базовой терапией аторвастатин 10 мг; БТ + Ф – пациенты принимали с базовой терапией фуколам; БТ + А10 + Ф – пациенты принимали с базовой терапией аторвастатин 10 мг и фуколам одновременно.
Полученные результаты свидетельствуют о том, что используемые схемы лечения пациентов в 3-й и 4-й группах наиболее эффективно восстанавливали этерифицирующую функцию печени, что способствовало преобразованию триглицеридов в фосфолипиды. Кроме того, фуколам, входящий в состав обеих схем лечения, снижал активность фосфолипаз и этим предотвращал разрушение фосфолипидных фракций.
Заключение
Выяснение причин болезней, в том числе и атеросклероза, является в настоящее время одним из перспективных направлений в развитии современной медицины. Введение полисахаридов бурой водоросли Fucus evanescens в виде препарата «Фуколам®» в схему лечения пациентов с ДЛП способствует восстановлению соотношения липидных фракций, входящих в липопротеины плазмы крови, что обусловливает увеличение возможности выведения холестерина из мембран липопротеинами высокой плотности. Кроме того, присутствие в фуколаме полиненасыщенных жирных кислот способствует синтезу фосфолипидных фракций из триглицеридов и, тем самым, снижению гипертриглицеринемии. Уменьшение доли холестерина в мембранах способствует замещению его на фосфолипидные фракции, в частности фосфатидилхолин и фосфатидилэтаноламин, а также метаболически активные фракции. Данный феномен позволяет использовать фуколам не только для коррекции липидного обмена у пациентов с ДЛП, но и как эффективное средство для восстановления структуры клеточных мембран при различных патологических процессах, сопровождающихся их нарушением.
Рецензенты:
Федянина Л.Н., д.м.н., профессор кафедры биотехнологии и функционального питания, Школа биомедицины ФГАОУ ВПО «Дальневосточный федеральный университет», г. Владивосток;
Кузнецова Т.А., д.м.н., заведующая лабораторией иммунологии ФГБУ «Научно-исследовательский институт эпидемиологии и микробиологии им. Г.П. Сомова» СО РАМН, г. Владивосток.
Работа поступила в редакцию 30.12.2014.



