Известно, что световое воздействие вызывает поражение всех клеточных элементов сетчатки [2, 3], механизм которого связан с фотоокислением мембранных структур
[4, 8]. Тяжесть поражения сетчатки во многом зависит от степени расстройства микроциркуляции, так как сетчатка, являясь представителем нервной ткани, чувствительна к гипоксии. Постоянный и непрерывный приток глюкозы и кислорода из кровеносного русла является необходимым условием энергетического обеспечения нервных клеток. Даже при кратковременной гипоксии в нервной ткани резко падает образование АТФ, следствием чего является быстрое развитие необратимых изменений в ткани мозга [1].
Цель исследования – изучение морфологических изменений сосудистых элементов сетчатки и их вклада в развитие процессов деструкции и репарации сетчатки при высокоинтенсивном световом воздействии.
Материал и методы исследования
Эксперименты проведены на 40 белых беспородных половозрелых крысах-самцах массой 200–250 гр. На крыс экспериментальной группы (20 животных) воздействовали в течение 6 час. белым светом, имеющим максимум излучения в желто-зеленой области спектра. Для облучения использовалась специальная установка из прямоугольных рефлекторов с вмонтированными в них люминесцентными лампами ЛБ-40, освещающая клетку с пяти сторон. Освещенность животных составляла 6000 лк. Контрольная группа (n = 20) – интактные животные, содержавшиеся в условиях искусственного светового режима (12 часов в день, 12 часов в ночь), с интенсивностью дневного освещения 25 лк. Материалом исследования служили сетчатки крыс, изъятые сразу после их умерщвления под эфирным наркозом через 1, 7, 14 и 30 суток после освещения, в аналогичные сроки производили взятие контрольного материала.
Центральные участки задней стенки глаза фиксировали в растворе, содержащем смесь 4 % параформальдегида и 0,5 % глютаральдегида на 0,2 М какодилатном буфере (рН 7,4). Материал постфиксировали в 2 % растворе четырехокиси осмия и заливали в эпон. Полутонкие срезы окрашивали толуидиновым синим, ультратонкие – контрастировали уранилацетатом и цитратом свинца, просматривали и фотографировали в электронном микроскопе JEM-7 А. На полутонких срезах с помощью окулярной измерительной сетки Автандилова высчитывали удельную площадь открытых и тромбированных сосудов хориоидеи. Для оценки достоверности различий при сравнении средних величин использовали непараметрический критерий Манна – Уитни.
Результаты исследований
и их обсуждение
На 1-е сут. после светового воздействия, в эндотелиоцитах хориокапилляров наблюдается отек цитоплазмы, вакуолизация большинства органелл. Вероятно, при повышенной световой нагрузке происходит срыв адаптации и окислительное повреждение эндотелиоцитов. Так, P. Kayatz et al. [9] обнаружили транспорт продуктов пероксидации от фоторецепторов к хориокапиллярам. T. Wu et al [11] после освещения зеленым светом интенсивностью 3500 лк в течение 3 часов выявили окислительное повреждение ДНК эндотелиоцитов, перицитов и пигментоцитов (ПЦ).
Дисфункция эндотелия нарушает транспорт метаболитов в пигментоциты и обратный транспорт продуктов обмена. Это приводит к их накоплению в цитоплазме клетки и гибели ПЦ. Цитоплазма таких клеток резко осмиофильна и вакуолизирована, ядра пикнотичны. Кроме того, повреждение эндотелия стимулирует тромбообразование. Тромбоциты выделяют воспалительные цитокины, вызывая хемотаксис лейкоцитов, которые в свою очередь индуцируют апоптоз эндотелиоцитов. Свободные радикалы и продукты перекисного окисления липидов увеличивают ригидность мембран эритроцитов и снижают их способность к деформации, что приводит к задержке форменных элементов в микроциркуляторном русле [5]. Все перечисленные процессы вызывают увеличение удельной площади сосудов со стазом, сладжем форменных элементов и тромбозом сосудов до 7,6 ± 0,5 % (контроль 1,52 ± 0,08 %; р < 0,05) (рис. 1), а также снижение количества открытых сосудов до 20 ± 2,93 % (контроль 36 ± 0,69 %; р < 0,05) (рис. 2).
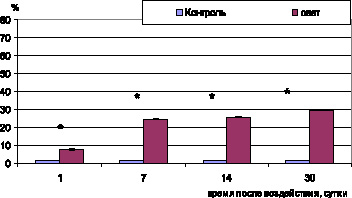
Рис. 1. Удельная площадь сосудов хориоидеи со стазом, сладжем и тромбозом при световом воздействии (6000 лк). Примечание. * – достоверность различий (p < 0,05)
при сравнении с показателями контрольных животных
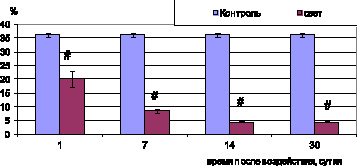
Рис. 2. Удельная площадь открытых неизмененных сосудов хориоидеи глаз крыс при световом воздействии (6000 лк). Примечание. # – достоверность различий (p < 0,05)
при сравнении с показателями контрольных животных
Нарушение перфузии приводит к ишемии наружных слоев сетчатки, не имеющих собственной сосудистой сети. Это, наряду с прямым повреждающим действием света, приводит к очаговому выпадению наружных слоев сетчатки на 7-е сут. после высокоинтенсивного светового воздействия. В очагах поражения наблюдается резкое истончение слоев, образованных нейросенсорными клетками. Встречаются участки, в которых отсутствуют все наружные слои сетчатки, и ассоциативные нейроны внутреннего ядерного слоя оказываются вплотную приближены к мембране Бруха. В области дефектов базального комплекса наблюдаются сосудистые почки, что сопровождается прорастанием новообразованных сосудов хориоидеи в сетчатку (рис. 3).
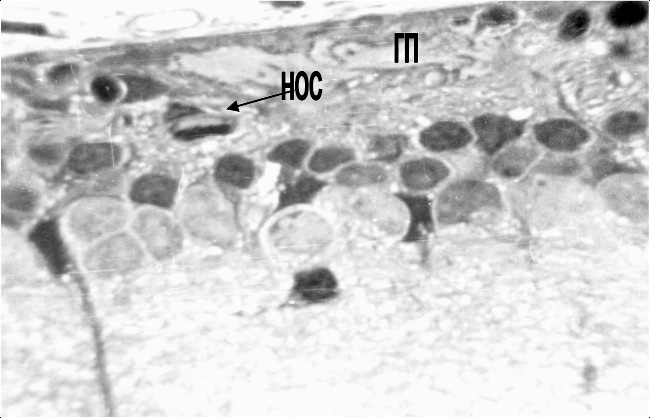
Рис. 3. Структурные изменения сетчатки на 7-е сутки после освещения в очаге поражения. Глиальная пролиферация и новообразованный сосуд в наружном ядерном слое:
ГП – глиальная пролиферация; НОС – новообразованный сосуд. Полутонкий срез.
Окраска толуидиновым синим. Ув. 900
В участках, окружающих дефект, наблюдается усиленная пролиферация пигментоцитов (ПЦ). Обнаружено, что в ПЦ синтезируются два фактора-антагониста. Фактор роста пигментоцитов (PEDF) выделяется через апикальную часть клетки, ингибирует ангиогенез [10], а также обладает нейропротекторным действием. Фактор роста эндотелиоцитов (VEGF) при нормальных условиях функционирования выделяется в небольших количествах через базальную часть пигментоцита и стимулирует активность хориоидального эндотелия [7].
Очевидно, в патологических условиях нарушается баланс, и VEGF начинает выделяться в больших количествах, кроме того, гипоксия индуцирует экспрессию HIF-1α фактора, что инициирует неоваскулогенез [12]. По данным D.N. Ausprunk et J. Folkman [6] в новообразованных сосудах практически отсутствует базальная мембрана. Они очень хрупкие и легко кровоточат.
Очаги поражения сетчатки совпадают по размерам и локализации с изменениями сосудов хориоидеи. Просвет большинства сосудов в очагах в экспериментальной группе резко сужен, причем одни из них не имеют форменных элементов, в других наблюдаются явления тромбоза, стаза и сладжа, что сопровождается резким снижением удельной площади открытых сосудов (рис. 2) до 8,4 ± 0,69 % (контроль 36 ± 0,69 %; р < 0,05) и значительным ростом удельной площади сосудов хориоидеи со сладжем форменных элементов и тромбозом (рис. 1) до 24,4 ± 0,4 % (контроль 1,52 ± 0,08 %; р < 0,05).
На светооптическом уровне сосудистая стенка выглядит утолщенной. При исследовании ультраструктуры хориокапилляров выявляется неравномерное утолщение и разволокнение базальной мембраны эндотелиоцитов, а также дегенеративные изменения части эндотелиоцитов, проявляющиеся деструкцией ядра (пикноз, рексис, лизис) и цитоплазмы (гомогенизация и сморщивание). Обнаруживается неравномерное утолщение базального комплекса вследствие пролиферации волокнистого компонента.
Интраретинальные сосуды проявляют относительную резистентность к повреждающим воздействиям. При электронно-микроскопическом исследовании сосудов сетчатки со стороны стекловидного тела на первый план выступают изменения перикапиллярных элементов радиальной глии. Отростки глиоцитов, окружающие капилляр, отечны, обладают низкой электронной плотностью. В цитоплазме этих отростков выявляются вакуоли, большое число лизосом и фагосом. Перикапиллярное пространство расширено. Базальная мембрана капилляров обладает повышенной электронной плотностью, неравномерной толщиной. Цитоплазма эндотелиоцитов бедна органеллами, содержит пиноцитозные везикулы и крупные вакуоли.
Наибольшая сохранность интраретинальных сосудов во внутренних слоях сетчатки, вероятно, связана с защитными свойствами радиальной и астроцитарной глии, которые выделяют трофические факторы, уменьшающие деструкцию эндотелия, а также с относительной удаленностью от нейросенсорных клеток – основного источника свободных радикалов и продуктов перекисного окисления липидов.
К 14–30-м суткам после освещения в очагах сетчатки с полным отсутствием пигментоцитов и нейросенсорных клеток базальный комплекс утолщен, местами разволокнен, большинство гемокапилляров замещены малодифференцированными клетками фибробластического ряда. В сохранившихся сосудах хориоидеи наблюдается вакуолизация цитоплазмы эндотелиоцитов, снижение количества органелл. Морфометрический анализ показал, что к 30-м суткам после освещения в очагах поражения наблюдается максимальное число тромбированных сосудов – 29,4 ± 0,34 % (контроль 1,52 ± 0,08 %; р < 0,05) и минимальное число открытых сосудов – 4,4 ± 0,27 % (контроль 36 ± 0,69 %; р < 0,05).
Заключение
Обнаружено, что наиболее восприимчивы к повреждающему действию света сосуды хориоидеи, чем интраретинальные гемокапилляры. Деструкция эндотелия, а также гемодинамические нарушения приводят к очаговому выпадению наружных слоев сетчатки и прорыву гематоретинального барьера, что индуцирует сосудистое новообразование. Неоангиогенез, с одной стороны, является адаптивной реакцией, направленной на восстановление кровоснабжения сетчатки, а с другой стороны – ставит нейроны сетчатки в непривычные условия функционирования и инициирует вторичные дегенеративные изменения.
Рецензенты:Солонский А.В., д.м.н., руководитель лаборатории нейробиологии, ФГБУ «Научно-исследовательский институт психического здоровья» СО РАМН, г. Томск;
Мустафина Л.Р., д.м.н., профессор ка-
федры гистологии, эмбриологии и цитологии, ГБОУ ВПО «Сибирский государственный медицинский университет» Минздрава России, г. Томск.



