Одной из основных задач медицинской химии является создание эффективных лекарственных средств для лечения и предупреждения широкого спектра нейродегенеративных расстройств [1, 4]. Комплексные исследования, проведенные ранее авторами по направленному синтезу и изучению биологической активности конденсированных замещенных индолов, в частности производных гамма-карболинов [3, 5–7, 12, 13, 15], показали несомненную привлекательность этих соединений в качестве перспективных нейропротекторов. Следует отметить, что в последнее время, в том числе и нами, широко изучаются аналоги этих соединений, также имеющие 2,3,4,5-тетрагидро-1Н-пиридо[4,3-b]индольный остов – тетрагидрокарбазолы, которые являются, например, антагонистами 5-НТ6 подтипа серотониновых рецепторов [8, 9], ингибиторами перекисного окисления липидов [11]. В связи с этим разработка методов синтеза различных замещенных производных индолов является весьма актуальной и несомненно позволит значительно расширить многообразие этих биологически активных веществ. Цель настоящего исследования заключалась в изучении закономерностей модификации тетрагидрокарбазолов посредством их каталитического алкилирования по индольному атому азота фторсодержащими амидами акриловой кислоты и получения ранее неизвестных фторсодержащих N-замещенных 2,3,4,9-тетрагидро-1Н-карбазолов 3а-m, которые можно рассматривать в качестве структурных аналогов лекарственного препарата «димебон», его фторсодержащего производного «DF-302» [3, 13] и модифицированных пропиламидным фрагментом гамма-карболинов 4, обладающих митопротекторной активностью [2].
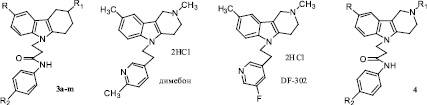
Рис. 1
Результаты исследования и их обсуждение
Основные известные к настоящему времени методы алкилирования замещенных индолов винилсодержащими производными по Михаэлю, как правило, основаны на использовании в качестве промоторов эквимольных количеств сильных оснований, например, метилата и гидрида натрия в ДМСО или метилата натрия в двухфазной системе ДМСО – 60 % водный КОН [5].
В случае декларированных к исследованию фторсодержащих акриламидов N-(4-фторфенил)акриламида и N-(4-трифторметоксифенил)акриламида использование указанных промоторов неприемлемо, так как в условиях реакции (120 °C, ДМСО) заметно происходит нуклеофильное замещение атома фтора в ароматическом ядре или деградация C-F-связи в трифторметоксильной группе. Ввиду этого нами изучена возможность использования в рассматриваемой реакции алкилирования тетрагидрокарбазолов фторсодержащими акриламидами в качестве катализатора фторида цезия.
Показано, что при нагревании в ДМСО при 100°C эквимольных количеств 2,3,4,9-тетрагидро-1Н-карбазолов 1а-f и фторсодержащих акриламидов 2a,b в присутствии каталитических количеств CsF образуются N-замещенные 3-(1,2.3,4-тетрагидрокарбазол-9-ил)пропионамиды 3a-m.
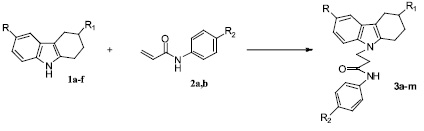
1: R = H, R1 = H (a); CH3 (b); F (c); R = CH3, R1 = H (d); CH3 (e); F (f);
2: R2 = F (a);OCF3 (b);
3: R = H, R1 = H, R2 = F (a); R = CH3, R1 = H, R2 = F (b); R = H, R1 = CH3, R2 = F (c);
R = CH3, R1 = CH3, R2 = F (d); R = F, R1 = H, R2 = F (e); R = F, R1 = CH3, R2 = F (f); R = H,
R1 = H, R2 = OCF3 (g); R = CH3, R1 = H, R2 = OCF3 (h); R = H, R1 = CH3, R2 = OCF3 (i); R = CH3,
R1 = CH3, R2 = OCF3 (k); R = F, R1 = H, R2 = OCF3 (l); R = F, R1 = CH3, R2 = OCF3 (m);
Рис. 2
Синтезированные с выходом 69–81 % N-замещенные 3-(1,2.3,4-тетрагидрокарбазол-9-ил)пропионамиды 3a-m – бесцветные кристаллические вещества, состав и строение которых доказаны элементным анализом и данными спектров ЯМР 1Н и 19F. В спектрах ЯМР 1Н характерны триплетные сигналы метиленовых протонов этиленового спейсера в области 2,3–2,6 и 4,0–4,4 м.д. В спектрах ЯМР 19F характерны мультиплетные сигналы атома фтора для соединений 3a-f в области –42...–39 м.д. и синглетные сигналы трифторметоксигруппы для соединений 3g-m в области 17–19 м.д. Следует отметить, что стабильно высокие выходы целевых продуктов и достаточно простая методика их выделения позволяет рассматривать изученные нами превращения как удобный препаративный метод введения в молекулы замещенных индолов разнообразных пропионамидных фрагментов.
Таким образом, нами предложена оригинальная методика катализирумого фторид-ионом алкилирования тетрагидрокарбазолов фторсодержащими акриламидами, что позволяет с успехом получать потенциальные нейропротекторы в ряду тетрагидрокарбазолов.
Материалы и методы исследования
Спектры ЯМР 1H регистрировали на приборе «Bruker DPX 200» при частоте 200,13 MHz относительно тетраметилсилана (внутренний эталон). Температуры плавления определяли в стеклянном капилляре. Исходные 1,2.3,4-тетрагидрокарбазолы 1a-f и N-замещенные акриламиды 2a,b синтезировали по методикам [10, 14], диметилформамид и фторид цезия («Aldrich») использовали без предварительной очистки.
3-(1,2.3,4-Тетрагидрокарбазол-9-ил)-N-(4-фторфенил)пропионамид (3a). 1 Ммоля тетрагидрокарбазола 1а, 1 ммоля N-замещенного акриламида 2а, 200 мг CsF, и 5 мг гидрохинона в 1,5 мл ДМФА нагревали при перемешивании при 100 C в течение 2 ч. Реакционную массу охладили, вылили в 20 мл воды, выпавший осадок отфильтровали, перекристаллизовали из 50 %-го EtOH. Получен аналогично 3а. Выход 78 %, Тпл 131-132 °С. Найдено (%): С, 63,11; Н, 5,06; N, 6,81, С21H21FN2O. Вычислено (%): С, 74,98; Н, 6,29; N, 8,33, Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 1,53-1,83 м (4Н, СН2); 2,37-2,64 м + т (6Н, СН2 + CH2 Jт = 5,9); 4,21 т (2Н, CH2 Jт = 5,8); 6,22 с (1Н, NH); 6,58 т (2H, CHAr, Jт = 7,8 Гц); 6,70-6,97 м (5Н, СНAr); 7,09-7,17 м (1Н, СНAr). Спектр ЯМР 19F (CDCl3, dF, м.д., J/Гц): -39,92 м.
3-(3-Метил-1,2.3,4-тетрагидрокарбазол-9-ил)-N-(4-фторфенил)пропионамид (3b) Получен аналогично 3а. Выход 73 %, Тпл 75-77 °С. Найдено (%): С, 45,19; Н, 6,81; N, 8,15, С22H23FN2O. Вычислено (%): С, 75,40; Н, 6,62; N, 7,99, Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 1,01 д (3Н, Me, J = 6,0 Гц); 1,17-1,41 м (1Н, СН2): 1,56-1,84 м (2Н, СН2): 1,99-2,18 м (1Н, СН2): 2,36-2,69 м + т (5Н, СН2 + CH2 + CH, Jт = 6,3): 4,09 т (2Н, CH2 Jт = 6,3): 6,53 т (2H, CHAr, Jт = 8,3 Гц,); 6,55-6,92 м (6Н, СНAr + NH); 7,03-7,13 м (1Н, СНAr). Спектр ЯМР 19F (CDCl3, δF, м.д., J/Гц): -39,72 м.
3-(6-Метил-1,2.3,4-тетрагидрокарбазол-9-ил)-N-(4-фторфенил)-пропионамид (3c). Получен аналогично 3а. Выход 77 %, Тпл 66-67 °С. Найдено (%): С, 75,56; Н, 6,40; N, 7,81, С22H23FN2O. Вычислено (%): С, 75,40; Н, 6,62; N, 7,99, Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 1,53-1,77 м (4Н, СН2); 2,34 c (3H, Me); 2,42-2,64 м (4H, СН2); 2,59 т (2Н, CH2 Jт = 5,8); 4,20 т (2Н, CH2 Jт = 5,8); 6,15 с (1Н, NH); 6,54-6,68 м (3H, CHAr); 6,75-6,88 м (3Н, СНAr); 6,93 c (1Н, СНAr). Спектр ЯМР 19F (CDCl3, δF, м.д., J/Гц): -41,82 м.
3-(3,6-Диметил-1,2.3,4-тетрагидрокарбазол-9-ил)-N-(4-фторфенил)-пропионамид (3d). Получен аналогично 3а. Выход 81 %, Тпл 137-139 °С. Найдено (%): С, 75,58; Н, 6,63; N, 6,81, С23H25FN2O. Вычислено (%): С, 75,80; Н, 6,91; N, 7,51, Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 1,01 д (3Н, Me, J = 5,7 Гц); 1,21-1,40 м (1Н, СН2): 1,48-1,86 м (2Н, СН2): 1,99-2,18 м (1Н, СН2): 2,34 с (3Н, Ме); 2,46-2,68 м + т (5Н, СН2 + CH2 + CH, Jт = 6,0): 3,99 т (2Н, CH2 Jт = 6,1): 6,26 с (1Н, NH); 6,54-6,69 м (3Н, СНAr); 6,75-6,80 м (3Н, СНAr); 6,92с (1Н, СНAr). Спектр ЯМР 19F (CDCl3, δF, м.д., J/Гц): -40,02 м.
3-(3-Фтор-1,2.3,4-тетрагидрокарбазол-9-ил)-N-(4-фторфенил)пропионамид (3e). Получен аналогично 3а. Выход 75 %, Тпл 172-174 °С. Найдено (%): С, 71,38; Н, 5,46; N, 7,70, С21H20F2N2O. Вычислено (%): С, 71,17; Н, 5,69; N, 7,90, Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 1,44-1,73 м (4Н, СН2); 2,23-2,48 м + т (5Н, СН2 + CH2 + CH, Jт = 6,0); 3,97 т (2Н, CH2 Jт = 5,9); 6,00 с (1Н, NH); 6,14-6,31 м (3Н, СНAr); 6,37-6,52 м (4Н, СНAr). Спектр ЯМР 19F (CDCl3, δF, м.д., J/Гц): -41,45 м (1F), -49,20 тд (1F, Jт = 9,4 Гц, Jд = 4,3 Гц).
3-(6-Фтор-3-метил-1,2.3,4-тетрагидрокарбазол-9-ил)-N-(4-фторфенил)-пропионамид (3f). Получен аналогично 3а. Выход 78 %, Тпл 155-156 °С. Найдено (%): С, 71,54; Н, 6,23; N, 7,38, С22H22F2N2O. Вычислено (%): С, 71,72; Н, 6,02; N, 7,60, Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 0,96 д (3Н, Me, J = 6,2Гц); 1,19-1,37 м (1Н, СН2): 1,50-1,82 м (2Н, СН2): 1,88-2,06 м (1Н, СН2): 2,32-2,58 м + т (5Н, СН2 + CH2 + CH, Jт = 6,0): 4,01 т (2Н, CH2 Jт = 5,8): 6,02 с (1Н, NH); 6,16-6,34 м (3Н, СНAr); 6,41-6,61 м (4Н, СНAr). Спектр ЯМР 19F (CDCl3, δF, м.д., J/Гц): -41,48 м (1F), -49,22 тд (1F, Jт = 9,4 Гц, Jд = 4,2 Гц).
3-(1,2.3,4-Тетрагидрокарбазол-9-ил)-N-(4-трифторметоксифенил)пропионамид (3g). Получен аналогично 3а. Выход 75 %, Тпл 165-167 °С. Найдено (%): С, 66,42; Н, 5,49; N, 6,61 С22H21F3N2O2, Вычислено (%): С, 65,66; Н, 5,26; N, 6,96, Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 1,45-1,75 м (4Н, СН2): 1,42- 2,25-2,53 м + т (6Н, СН2 + CH2 Jт = 5,6): 3,97 т (2Н, CH2 Jт = 5,5): 6,05 с (1Н, NH): 6,33-6,64 м (7Н, СНAr): 6,77 д (1Н, СНAr, Jд = 6,2). Спектр ЯМР 19F (CDCl3, δF, м.д., J/Гц): 17,84 c.
3-(3-Метил-1,2.3,4-тетрагидрокарбазол-9-ил)-N-(4-трифторметоксифенил)-пропионамид (3h). Получен аналогично 3а. Выход 71 %, Тпл 135-137 °С. Найдено (%): С, 66,57; Н, 5,28; N, 6,94, С23H23F3N2O. Вычислено (%): С, 66,34; Н, 5,57; N, 6,73, Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 0,95 д (3Н, Me, J = 6,2 Гц); 1,12-1,31 м (1Н, СН2): 1,42-1,60 м (1Н, СН2): 1,64-1,76 м (1Н, СН2): 1,90-2,06 м (1Н, СН2): 2,29-2,56 м + т (5Н, СН2 + CH2 + CH, Jт = 6,0): 3,98 т (2Н, CH2 Jт = 6,1): 6,03 с (1Н, NH): 6,32-6,59 м (7Н, СНAr): 6,69-6,80 м (1Н, СНAr). Спектр ЯМР 19F (CDCl3, δF, м.д., J/Гц): 17,75 c.
3-(6-Метил-1,2.3,4-тетрагидрокарбазол-9-ил)-N-(4-трифторметоксифенил)-пропионамид (3i). Получен аналогично 3а. Выход 73 %, Тпл 151-153 °С. Найдено (%): С, 66,52; Н, 5,26; N, 6,91, С23H23F3N2O2, Вычислено (%): С, 66,34; Н, 5,57; N, 6,73, Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 1,51-1,76 м (4Н, СН2): 2,33 c (3H. Me); 2,38- 2,48 м (4H, СН2); 2,61 т (2Н, CH2 Jт = 5,9); 4,16 т (2Н, CH2 Jт = 5,8); 6,26 с (1Н, NH); 6,56-6,76 м (3H, CHAr); 6,78-6,88 м (3Н, СНAr); 6,92 c (1Н, СНAr). Спектр ЯМР 19F (CDCl3, δF, м.д., J/Гц): 19,40 c.
3-(3,6-Диметил-1,2.3,4-тетрагидрокарбазол-9-ил)-N-(4-трифторметоксифенил)-пропионамид (3k). Получен аналогично 3а. Выход 69 %, Тпл 153-155 °С. Найдено (%): С, 66,64; Н, 5,66; N, 6,72, С24H25F3N2O2, Вычислено (%): С, 66,97; Н, 5,85; N, 6,51, Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 0,98 д (3Н, Me, J = 5,8 Гц); 1,27-1,42 м (1Н, СН2): 1,51-1,88 м (2Н, СН2): 2,06-2,19 м (1Н, СН2): 2,33 с (3Н, Ме); 2,48-2,71 м + т (5Н, СН2 + CH2 + CH, Jт = 6,0): 4,02 т (2Н, CH2 Jт = 6,1): 6,18 с (1Н, NH); 6,54 д (1Н, СНAr, J = 6,0); 6,68 д (2Н, СНAr, J = 6,9); 6,73-6,79 м (3Н, СНAr); 6,89 с (1Н, СНAr). Спектр ЯМР 19F (CDCl3, δF, м.д., J/Гц): 19,56 c.
3-(6-Фтор-1,2.3,4-тетрагидрокарбазол-9-ил)-N-(4-трифторметоксифенил)-пропионамид (3l). Получен аналогично 3а. Выход 76 %, Тпл 162-164 °С. Найдено (%): С, 63,11; Н, 5,06; N, 6,81, С22H20F4N2O2, Вычислено (%): С, 62,85; Н, 4,80; N6,66, Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 1,55-1,79 м (4Н, СН2); 1,42- 2,38-2,65 м + т (6Н, СН2 + CH2 Jт = 6,3); 4,19 т (2Н, CH2 Jт = 6,3); 6,35 с (1Н, NH); 6,55 тд (1H, CHAr, Jт = 8,6 Гц, Jд = 2,7 Гц); 6,69-6,97 м (6Н, СНAr). Спектр ЯМР 19F (CDCl3, δF, м.д., J/Гц): 17,80 c (3F), -49,14 тд (1F, Jт = 9,4 Гц, Jд = 4,3 Гц).
3-(6-Фтор-метил-1,2.3,4-тетрагидрокарбазол-9-ил)-N-(4-трифторметоксифенил)пропионамид (3m). Получен аналогично 3а. Выход 74 %, Тпл 160-162 °С. Найдено (%): С, 63,11; Н, 5,06; N, 6,81, С23H22F4N2O2, Вычислено (%): С, 63,59; Н, 5,10; N, 6,45, Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 0,94 д (3Н, Me, J = 6,2 Гц); 1,19-1,41 м (1Н, СН2): 1,51-1,70 м (1Н, СН2): 1,73-1,86 м (1Н, СН2): 1,50-2,13 м (1Н, СН2): 2,41-2,67 м + т (5Н, СН2 + CH2 + CH, Jт = 6,0): 4,18 т (2Н, CH2 Jт = 5,8): 6,34 с (1Н, NH): 6,54 т д (1H, CHAr, Jт = 8,7 Гц, Jд = 2,6 Гц); 6,70-6,95 м (6Н, СНAr). Спектр ЯМР 19F (CDCl3, δF, м.д., J/Гц): 19,37 c, -47,33 т д (Jт = 9,2 Гц, Jд = 4,6 Гц).
Исследование выполнено за счет гранта Российского научного фонда (проект № 14-23-00160).
Рецензенты:
Серков И.В., д.х.н., ведущий научный сотрудник, ФГБУН «Институт физиологически активных веществ» Российской академии наук, Федеральное агентство научных организаций, г. Черноголовка;
Баулин В.Е., д.х.н., ведущий научный сотрудник, ФГБУН «Институт физиологически активных веществ» Российской академии наук, Федеральное агентство научных организаций, г. Черноголовка.
Работа поступила в редакцию 06.10.2014.



