На современном этапе болезни околоносовых пазух являются самой распространенной ЛОР-патологией [7, 10, 13, 19]. Oколо 40 % всех госпитализированных лорбольных составляют пациенты с синуситами. Частой причиной развития верхнечелюстных синуситов являются тесные топографо-анатомические взаимоотношения верхнечелюстной пазухи (ВЧП) с зубами верхней челюсти [1, 2, 4, 16]. По мнению многих авторов, особенности строения стенки верхнечелюстной пазухи повышают степень риска возникновения внутриглазничных и внутричерепных осложнений при воспалительных заболеваниях этой пазухи, что требует участия различных специалистов: офтальмологов, челюстно-лицевых хирургов, стоматологов, отоларингологов и нейрохирургов [18]. Основным методом диагностики заболеваний околоносовых пазух (ОНП) в настоящее время является рентгенологический, который, как и жесткая эндоскопия носовой полости, и возможность компьютерного сканирования (КТ) синусов, тем не менее, не позволяет комплексно оценить состояние всех ОНП, не даёт полного представления о динамике патологического процесса и патогенетических механизмах [8, 14, 15]. Следует учесть, что ни один из этих диагностических методов не доступен для врача общей практики, которому нередко приходится ставить диагноз и лечить синусит на основании клинических симптомов. Диагностика и лечение болезней придаточных пазух носа (ППН) связаны с неспецифичностью и неинформативностью неинвазивных методов обследования. При этом КТ подвергает пациента значительному облучению. Запущенный синусит приводит к распространению инфекции за пределы пазух, приводя к серьезным осложнениям, чаще у детей [3, 5, 12] . При этом, как следствие, эмпирическая неадекватная антибиотикотерапия не является полностью патогенетически обоснованной: при остром синусите отсутствует единое мнение о выборе антибиотика и продолжительности курса лечения, что также подтверждают данные об особенностях анаэробной инфекции у пациентов с различными формами хронических максиллярных синуситов [11]. Микроорганизмы, присутствующие в околоносовых пазухах, не реагируют на антибактериальные средства. Опасность длительного курса антибиотиков заключается в развитии антибиотикорезистентности, риске остаточной инфекции с высокой вероятностью развития осложнений. Поэтому разработка методов гистологической и иммуногистохимической оценки патологического процесса в слизистой оболочке гайморовой пазухи с использованием маркеров CD4/CD8 является наиболее актуальной на современном этапе.
Цель исследования. Установить особенности взаимодействия CD4:CD8 в структурах слизистой гайморовой пазухи и их роль в патогенезе одонтогенного гайморита.
В задачи исследования мы включили получение характеристики морфологических особенностей альтерации структур слизистой оболочки верхнечелюстной пазухи в зависимости от сроков заболевания, а также выявление количественной динамики изменений CD4:CD8 в гайморовой пазухе в зависимости от возраста и давности заболевания.
Материалы и методы исследования
Исследование было проведено с учётом положений Хельсинской декларации (2000) и с разрешением этического комитета ФГАОУ ВПО Дальневосточный Федеральный Университет. По клиническим показаниям и с письменного информированного согласия пациентов с учётом зависимости показателей от циркадных ритмов произвели забор биоптатов слизистой гайморовой пазухи у 42 пациентов в возрасте от 45 до 78 лет, которых распределили с учётом возрастных групп, принятых Международным симпозиумом по возрастной периодизации в Москве (1965 г.) и сроков заболевания одонтогенным гайморитом (табл. 1).
Таблица 1
Распределение больных с учётом возрастной периодизации и сроков давности одонтогенного гайморита
|
Количество больных в возрастных группах |
Всего больных |
Продолжительность заболевания |
||||
|
1 мес. |
1,5 мес |
3 мес. |
0,5 года |
1 год и более |
||
|
VI |
5 |
1 |
1 |
1 |
1 |
1 |
|
VII |
7 |
1 |
1 |
2 |
2 |
1 |
|
VIII |
5 |
1 |
2 |
1 |
1 |
1 |
|
IX |
3 |
1 |
0 |
0 |
0 |
1 |
|
X |
6 |
1 |
1 |
2 |
2 |
0 |
|
XI |
7 |
3 |
1 |
1 |
1 |
1 |
|
XII |
9 |
3 |
3 |
1 |
1 |
1 |
|
Итого |
42 |
11 |
9 |
8 |
8 |
6 |
Клинический анализ материала показал, что причинами одонтогенного гайморита в большинстве случаев были мероприятия по имплантации зубов (35), ретенционные зубы (2) и инфицирование в результате кариозного поражения зубов (5).
По клиническим показаниям и с согласия пациентов производили забор биоптатов с помощью интраназальной этмоидэктомии, образцы нормальный слизистой оболочки были получены из области задней решетчатой пазухи от трех пациентов, у которых заболевание было ограничено передним решётчатым регионом. Кроме того, ни один из этой группы пациентов не получал интраназальных препаратов, оральных стероидов, а также антибиотиков для лечения в течение предыдущих 6 месяцев. Все они имели отрицательные результаты на аллергические пробы. Полученные биоптаты фиксировали в 10 %-м формалине на фосфатном буфере с рН 6,8–7,2 в течение 24-х часов, затем промывали в воде в течение 2-х часов и обезвоживали в спиртах возрастающей концентрации в течение 1 часа в каждой порции. В спирте 96 °С выдерживали в течение 1, 2, 4-х часов, а затем помещали в абсолютный спирт 5 раз по 30 минут, потом оставляли в последней порции на всю ночь. После этого материал помещали в смесь абсолютного спирта и ксилола в соотношении 1:1 на 30 минут, а затем в сменах ксилола в термостате при 37 °С по 30 минут в каждой. После этого использовали смесь ксилола с парафином (1:1) при 56 °С по 20 минут в 2-х порциях, а затем в двух порциях парафина при 56 °С (по 1 часу в каждой порции), после чего проводили заливку. Парафиновые блоки выдерживали в течение суток в термостате при 37 °С, после чего производили срезы толщиной 3–5 мкм. Срезы и вся дальнейшая обработка материала (депарафинирование и обезвоживание) выполнялась на автоматизированной аппаратуре лаборатории патоморфологии Международного медицинского научно-образовательного центра (IMERC, Ниигата, Япония). Идентификация иммунокомпетентных клеток проводилась по одинаковой схеме, в связи с одинаковой локализацией антигена в клеточных структурах. Иммуногистохимическими методами на определение CD4/CD8 в биоптатах слизистой гайморовой пазухи, произвели фенотипирование иммуноцитов и проанализировали их количественные соотношения в слизистой оболочке гайморовой пазухи в норме, а также выявили особенности топографии иммуноцитов при одонтогенном гайморите. Демаскировка антигенных детерминант проводилась в стеклянном контейнере, заполненном восстанавливающим раствором, с созданием водяной бани в течение одного часа. Часть препаратов была обработана в течение 30 минут с помощью микроволнового излучения, которое даёт лучший демаскировочный эффект. Для демаскировки антигенов использовали 10 ммоль/л цитратный буфер с рН 6,0 или DAKO TRS (Target retrieval solution, code № S1700). Остывшие препараты промывали в дистиллированной воде. Антитела применяли в разведении 1:50 и 1:100. Анализ материала проведён с помощью микроскопа Olympus – Bx82 и цифровой камеры РDх25.
Результаты исследования и их обсуждение
Нами установлено, что в группе обследованных пациентов развитие одонотогенного верхнечелюстного синусита чаще было связано с тем, что нижняя стенка, или дно, верхнечелюстной пазухи находилось вблизи задней части альвеолярного отростка верхней челюсти и обычно соответствовало лункам четырех задних верхних зубов, корни которых в 12 случаях отделялись от пазухи лишь мягкими тканями. Также развитию патологического процесса способствовало низкое расположение дна, а также нахождение корней зубов и их луночек вблизи или даже внутри верхнечелюстной полости. При этом было отмечено, что вдающиеся в пазуху луночки зубов имели отверстия, через которые надкостница корня приходила в соприкосновение со слизистой оболочкой пазух. Это способствовало лёгкому распространению одонтогенной инфекции в соответствующих зубах на слизистую оболочку верхнечелюстной пазухи.
Слизистая оболочка, выстилающая верхнечелюстную пазуху, плотно спаяна с костными стенками. Отличие от слизистой оболочки проксимального отдела дыхательного тракта заключается в том, что она не содержит кавернозной ткани, очень тонкая, включает небольшое количество слизистых желез и обильно кровоснабжена. В норме верхнечелюстная пазуха выстлана слизистой оболочкой, покрытой многорядным призматическим мерцательным эпителием. Нами установлено, что толщина слизистой оболочки в околоносовых пазухах составляет 120–1000 мкм и не видна на рентгенограмме, но при воспалении она может увеличиваться в десятки и сотни раз, давая пристеночное затемнение.
Основными морфофункциональными единицами эпителия в пазухах являются реснитчатые, вставочные и бокаловидные клетки. Известно, что реснитчатые клетки имеют на своей поверхности 50–200 ресничек длиной 5–8, диаметром 0,15–0,3 мкм.
Нами отмечено, что препараты, изготовленные из биоптатов больных с продолжительностью процесса 1–1,5 месяца, в сравнении с нормой характеризовались гипертрофией слизистой оболочки и гиперплазией бокаловидных клеток (рис. 1 а, б, в).
 а
а 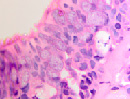 б
б 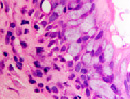 в
в
Рис. 1 а, б. А – в норме количество бокаловидных клеток 2–3 в поле зрения, идентифицируется слой ресничек. Б – гиперплазия и гипертрофия бокаловидных эпителиоцитов. В – слой ресничек разрушен (указано стрелкой). Микрофото. Окраска гематоксилин-эозином. Ув.х400
Известно, что ранние дегенеративные изменения реснитчатых эпителиоцитов проявляются уменьшением удельного объема митохондрий, гранулярной эндоллазматической сети, увеличением ядерно-цитоплазматических отношений, что связано с нарушением эвакуации секрета из бокаловидных клеток.
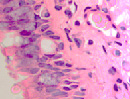
При появлении воспалительного инфильтрата в слое эпителиальной пластинки слизистой оболочки в сочетании с разрушением базальной мембраны и гибели базальных и бокаловидных клеток в отсутствие дифференцировки и специализации происходит замещение однослойных многорядных эпителиоцитов многослойным эпителием в результате реституции пролиферирующих стволовых клеток (рис. 2 а, б, в).
 а
а 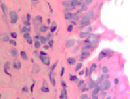 б
б 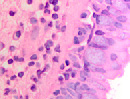 в
в
Рис. 2 а, б. А – расширение кровеносных сосудов с гипертрофированными эндотелиоцитами и лейкоцитарная инфильтрация в собственной пластинке слизистой оболочки. Кровеносный сосуд указан белой стрелкой. Б – разрушение эпителиальной пластинки, реснитчатого эпителия, апоптоз бокаловидных клеток. Микрофото. Окраска гематоксилин-эозином. Ув.х400
Кроме этого, лейкоцитарная инфильтрация, которая при инфицировании наблюдается не только в пределах собственной соединительнотканной пластинки, но и на поверхности слизистой, сопровождается разрушением базальной мембраны (рис. 2 б).
При продолжительности заболевания более 3-х месяцев развивается метаплазия эпителия в однорядный кубический и многослойный плоский ороговевающий или неороговевающий (рис. 2 в).
Нами установлено, что содержание СD4/ СD8 иммуноцитов в слизистой оболочке синусов постепенно увеличивается, но при продолжительности заболевания более 6 месяцев уменьшается содержание CD4 клеток, одновременно возрастает содержание CD8 как в эпителиальной пластинке, так и на поверхности слизистой оболочки (рис. 3; табл. 2).
 а
а  б
б  в
в
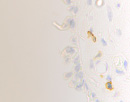 г
г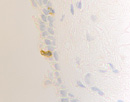 д
д
Рис. 3. а, б. А, б – CD4 инфильтрация в собственной пластинке слизистой оболочки верхнечелюстного синуса. В, г, д – идентификация CD 8 лимфоцитов как в собственной пластинке слизистой оболочки синуса, так и на поверхности эпителия. Наблюдается разрушение эпителиальной пластинки, реснитчатого эпителия, апоптоз бокаловидных клеток. Микрофото. Иммунная гистохимия. Ув.х400
Таблица 2
Показатели иммунного гомеостаза в слизистой оболочке верхнечелюстного синуса в норме и при хронической инфекции
|
Параметры фенотипирования |
CD 4 |
CD8 |
||||||
|
Продолжительность заболевания |
контроль |
1 мес. |
3–6 мес. |
1 год |
контроль |
1 мес. |
3–6 мес. |
1 год |
|
От 20 до 40 лет |
1,69 ± 0,11 |
3,78 ± 0,11 |
3,21 ± 0,05 |
2,60 ± 0,07 |
1,41 ± 0,18 |
2,79 ± 0,23 |
3,45 ± 0,27 |
3,57 ± 0,12 |
|
От 40 до 60 лет |
1,55 ± 0,09 |
2,77 ± 0,09 |
3,64 ± 0,07 |
3,24 ± 0,05 |
1,09 ± 0,24 |
2,53 ± 0,19 |
3,37 ± 0,10 |
3,44 ± 0,13 |
|
Старше 60 лет |
1,43 ± 0,25 |
2,44 ± 0,17 |
3,15 ± 0,11 |
2,99 ± 0,14 |
1,06 ± 0,19 |
2,01 ± 0,18 |
3,24 ± 0,22 |
3,35 ± 0,16 |
Примечание: критерий достоверности при уровне значимости p < 0,05.
Выявленное количество CD4/CD8 в слизистой оболочке верхнечелюстного синуса в группе контроля согласуется с данными литературы о показателях CD4/CD8 в периферической крови, количество CD4 превышает содержание CD8 во всех возрастных группах (р < 0,05). Динамика изменения количества эффекторных иммуноцитов в слизистой оболочке верхнечелюстного синуса в группе контроля согласуется с данными литературы об уменьшении с возрастом количества CD4/CD8 ежегодно на 0,09 %. Повышение соотношения CD4/CD8 отмечается в острой фазе воспалительного процесса, за счёт повышения количества Т-хелперов и снижения Т-супрессоров. При переходе воспалительного заболевания в хронический процесс отмечается медленное снижение содержания Т-хелперов и повышение количества Т-супрессоров. При стихании воспалительного процесса эти показатели и их соотношения нормализуются.
Гиперсекреция слизи является общей чертой при хронических синуситах, сопровождаясь выраженной гиперплазией бокаловидных клеток, что, по мнению, связано с генами, отвечающими за выработку муцина матричными РНК (мРНК), которые выражены в бокаловидных клетках поверхностных эпителиальных пластов респираторного тракта человека. На сегодняшний день идентифицированы 12 генов человека, отвечающие за выработку муцина (MUC1-4, MUC5AC, MUC5B, MUC6-8, MUC9, MUC11, при этом MUC12, MUC5AC, MUC5B, MUC6, MUC7 и MUC8 известны как гены, отвечающие за секреторную активность бокаловидных клеток в дистальных дыхательных путях. Увеличение количества лимфоцитов CD4/CD8 и динамика изменения их соотношения в патогенезе синусита свидетельствуют о том, что эффекторные иммуноциты обеспечивают защитные барьерные свойства покровной ткани в условиях гипер-, гипофункции и гибели эпителиальных пластов.
Таким образом, соотношение CD4/CD8 является интегральным показателем состояния иммунных процессов в слизистой оболочке верхнечелюстного синуса. Несмотря на то, что существует мнение о том, что исследование поверхностных маркеров лимфоцитов периферической крови при заболеваниях, не связанных с классифицированными иммунодефицитами или онкогематологией, не является диагностически значимым, однако эти показатели в слизистой оболочке синусов позволяют оценивать распространенность, тяжесть заболевания и патогенетические особенности воспалительного процесса, прогнозировать развитие патологии.
Фенотипирование лимфоцитов у пациентов с воспалительными заболеваниями дает дополнительную информацию о текущем состоянии больного и может использоваться для мониторинга состояния иммунной системы пациента в процессе лечения.
Работа выполнена при поддержке Научного Фонда ДВФУ и Международного гранта ДВФУ (соглашение № 13-09-0602-м_а от 6 ноября 2013 г.
Рецензенты:
Храмова И.А., д.м.н., профессор, врач акушер-гинеколог, Приморский Краевой Диагностический Центр, г. Владивосток;
Транковская Л.В., д.м.н., профессор, заведующая кафедрой гигиены ТГМУ, г. Владивосток.
Работа поступила в редакцию 25.08.2014.



