Стероидный препарат мифепристон (МФ) обладает высоким сродством к рецепторам прогестерона и глюкокортикоидных гормонов, в силу чего он выступает как конкурентный антагонист этих гормонов, модифицируя их эффекты на уровне тканей-мишеней [11]. Использование МФ в схемах лечения болезни Кушинга и прогестеронзависимых заболеваний способствует улучшению у пациентов гликемического контроля, нормализует артериальное давление, вызывает потерю массы тела и снижение окружности талии, уменьшает депрессию и улучшает общее самочувствие [7, 8, 9]. Лечение больных с бессимптомной опухолью надпочечников МФ привело к снижению у них инсулинорезистентности [6]. Клинические наблюдения согласуются с результатами экспериментальных исследований. Так, введение МФ приводило к снижению концентрации глюкозы в крови натощак и после глюкозной нагрузки, а также уменьшению содержания мРНК ключевых ферментов глюконеогенеза в печени тучных мышей с сахарным диабетом 2 типа [15].
С другой стороны, прием МФ может стимулировать повышение уровня циркулирующих глюкокортикоидных гормонов из-за нарушения регуляции гипоталамо-гипофизарно-надпочечниковой системы (ГГАКС) по механизмам обратной связи, но при этом вызывать и симптоматическую надпочечниковую недостаточность, гипокалиемию и другие побочные эффекты [8, 10]. Такая активация синтеза глюкокортикоидных гормонов в коре надпочечников пациентов с болезнью Кушинга на фоне приема МФ снижает его эффективность как блокатора глюкокортикоидных рецепторов и ограничивает терапевтическую ценность препарата [11].
Все вышесказанное указывает на необходимость проведения детальных исследований механизмов влияния МФ на функциональную активность ГГАКС, подразумевая при этом как синтез кортикостероидных гормонов в надпочечниках, так и их эффекты в тканях-мишенях в условиях здорового и патологически измененного организма.
В работе проведено сравнительное исследование влияния длительного приема per os МФ на глюкокортикоидную функцию коры надпочечников здоровых крыс и животных со стрептозотоциновым диабетом.
Материал и методы исследования
Эксперименты проводили на половозрелых крысах-самцах породы Вистар (n = 20) с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинкской декларации.
Животных содержали в одиночных клетках на стандартном рационе вивария со свободным доступом к воде. Стрептозотоциновый диабет у крыс моделировали однократным внутрибрюшинным введением раствора стрептозотоцина (SIGMA) в 0,85 % водном растворе NaCl в дозе 50 мг/кг массы тела после 12-часового голодания. Через 12 суток после введения стрептозотоцина крыс использовали в эксперименте с МФ. Использовали применяемый в акушерской практике таблетированный препарат «Мифепристон» (МИР-ФАРМ ЗАО Россия), предназначенный для перорального введения. Таблетки, содержащие по 200 мг МФ, растирали и готовили суспензию из расчета 20 мг МФ в 1 мл воды.
Были сформированы 5 групп животных: 1-я группа – интактные крысы; 2-я группа – крысам в течение 13 дней ежедневно в утреннее время (10‒11 часов) дозатором вводили per os по 0,25 мл воды; 3-я группа – крысам аналогично вводили per os суспензию МФ из расчета 20 мг/кг массы тела [3]; 4-я группа – крысам со стрептозотоциновым диабетом вводили per os воду; 5-я группа – крысам со стрепотозотоциновым диабетом вводили per os суспензию МФ. Для оценки суточной экскреции неметаболизированного кортикостерона индивидуально у каждой крысы проводили сбор мочи с использованием мочесборников в течение всего периода введения МФ. Животных выводили из эксперимента на следующие сутки после последнего введения МФ также в утреннее время (10–11 часов). В сыворотке крови определяли концентрацию глюкозы с использованием диагностического набора BioCon (Германия) для подтверждения наличия диабета.
В качестве основного показателя глюкокортикоидной функции надпочечников измеряли экскрецию неметаболизированного свободного кортикостерона с мочой [1], в качестве дополнительных показателей, также характеризующих функциональное состояние коры надпочечников, измеряли относительную массу надпочечников, концентрацию кортикостерона в сыворотке крови и содержание кортикостерона и прогестерона в гомогенатах надпочечников. После экстракции стероидов из биологического материала [14] определяли содержание кортикостерона радиоиммунным методом с использованием [1, 2, 6, 7-3H]-Corticosterone (Amersham) и Corticisterone antiserum (Sigma-Aldrich), прогестерона – иммуноферментным методом с использованием наборов Progesterone-ELISA kits (XEMA, Москва).
Статистическую обработку результатов проводили с использованием пакета прикладных программ Statistica 6.0 (Statsoft, США), для множественных сравнений применяли критерий Краскела ‒ Уоллиса, для парных сравнений – критерий Манна ‒ Уитни. Вероятность справедливости нулевой гипотезы принимали при 5 % уровне значимости. Данные в таблице представлены в виде M ± m, где M – выборочное среднее, m – стандартная ошибка.
Результаты исследования и их обсуждение
Содержание глюкозы в сыворотке крови крыс 4-й и 5-й групп через 12 дней после введения им стрептозотоцина составило 25,2 ± 1,7 ммоль/л, что было выше в четыре раза, чем у крыс 2-й и 3-й групп – 6,3 ± 0,2 ммоль/л, и указывало на сформированный стрептозотоциновый диабет с выраженной гипергликемией.
Экскреция кортикостерона с мочой у интактных крыс составила в среднем на всех сроках эксперимента 157,4 ± 96,3 пмоль/сутки. На рисунке представлены результаты измерения суточной экскреции кортикостерона в динамике эксперимента у крыс 2-й, 3-й (здоровые животные) и 4-й, 5-й (крысы со стрептозотоциновым диабетом) групп. У здоровых крыс в ответ на введение воды, что сопровождалось хэндлингом (взятием крыс в руки), величина суточной экскреции гормона имела тенденцию к повышению после 1–2 введения воды. Это закономерно, так как известно, что хэндлинг является мягким стрессорным воздействием и сопровождается повышением концентрации кортикостерона в крови [4]. В дальнейшем суточная экскреция кортикостерона у крыс 2-й группы не отличалась от величины соответствующего показателя у интактных крыс.
В ответ на введение МФ у крыс 3-й группы экскреция кортикостерона начинала повышаться, достигая максимума после 5–6 введения препарата. Затем началось постепенное снижение величины этого показателя, однако и в конце эксперимента (после 11–12 введений) она оставалась выше, чем у интактных и крыс 2-й группы. Полученные данные позволяют говорить о том, что у здоровых крыс в динамике введения МФ растет активность глюкокортикоидной функции надпочечников. Подобная реакция со стороны гормональной системы, как правило, сопровождается через определенное время ингибированием ее активности, несмотря на продолжение воздействий [2], что мы и отмечали по экскреции кортикостерона с мочой через 7–8 и больше введений МФ. Трудно сказать, на каком уровне – центральном или периферическом, организации ГГАКС в конкретной ситуации осуществляется подобное ингибирование, однако есть основания предполагать определенную роль в этом гипоталамических механизмов [2].
У крыс со стрептозотоциновым диабетом суточная экскреция кортикостерона более чем в 10 раз превышала величину показателя у здоровых крыс (см. рисунок, точка до введения). В ответ на 1–2 введение воды или МФ у крыс 4-й и 5-й групп экскреция кортикостерона снизилась, а, как мы уже обсуждали выше, у крыс 2-й группы – здоровых животных, повысилась. Полученные результаты свидетельствуют о формировании стойкой активации глюкокортикоидной функции надпочечников и нарушении стресс-реактивности у крыс с экспериментальным диабетом, что согласуется с результатами, полученными нами ранее [12, 14], а также со сведениями из научной литературы [5].
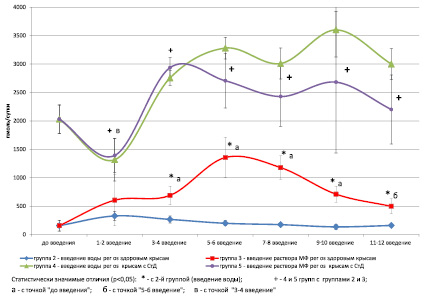
Суточная экскреция кортикостерона с мочой у крыс в динамике эксперимента
В ответ на неоднократное введение воды или МФ отмечена тенденция к повышению величины экскреции кортикостерона у крыс как 4-й, так и 5-й групп. Однако если у крыс 4-й группы величина этого показателя оставалась до конца эксперимента на высоком уровне, то у крыс 5-й группы, аналогично крысам 3-й группы, наметилась слабая тенденция к снижению величины экскреции кортикостерона с мочой.
В таблице представлены результаты измерения содержания кортикостероидов в надпочечниках и кортикостерона в крови, что также характеризует глюкокортикоидную функцию надпочечников.
У здоровых крыс после многократного введения МФ повысилась относительная масса надпочечников, что соответствует результатам о повышении у них экскреции кортикостерона с мочой. У крыс со стрептозотоциновым диабетом величина этого показателя была еще выше, но введение МФ не оказало дополнительного влияния на массу надпочечников, что может быть связано с предшествующей выраженной гипертрофией этой железы, обусловленной введением стрептозотоцина.
У крыс 3-й группы после введения МФ содержание прогестерона в надпочечниках было повышено в два раза относительно величины этого показателя у животных 1-й группы (без введения препаратов) и 2-й группы (введение воды). Известно, что повышение содержания прогестерона в надпочечниках связано с усилением синтеза прегненолона на ранних этапах стероидогенеза, в этой связи можно предположить, что введение МФ не только способствует гипертрофии надпочечников, но и активирует активность процессов синтеза кортикостероидов на этапе образования прегненолона из холестерина. Содержание прогестерона в надпочечниках крыс после введения им воды или МФ на фоне стрептозотоцинового диабета (4-я и 5-я группы) было повышено относительно крыс 1-й группы, но не различалось между собой, что соответствует результатам измерения у них массы надпочечников (см. таблицу). Содержание в надпочечниках кортикостерона, аналогично содержанию прогестерона, было повышено у животных 3-й, 4-й и 5-й групп. Следовательно, у крыс со стрептозотоциновым диабетом дополнительной активации синтеза кортикостероидов в надпочечниках в ответ на введение МФ не происходило.
Относительная масса надпочечников, содержание прогестерона и кортикостерона в надпочечниках, концентрация кортикостерона в сыворотке крови (M ± m)
|
Показатель |
Животные без диабета |
Животные со стрептозотоциновым диабетом |
р |
|||
|
Группа 1 – без введения препаратов |
Группа 2 – введение воды |
Группа 3 – введение МФ |
Группа 4 – введение воды |
Группа 5 – введение МФ |
||
|
1 |
2 |
3 |
4 |
5 |
||
|
Относительная масса надпочечников, мг/100 г массы тела |
13,9 ± 0,9 |
13,8 ± 0,6 |
18,4 ± 0,3 |
23,5 ± 1,6 |
23,7 ± 1,5 |
1,2–3 < 0,05 1,2,3–4,5 < 0,05 |
|
Содержание прогестерона в надпочечниках, пкмоль/мг ткани |
2,28 ± 0,27 |
3,04 ± 0,65 |
5,57 ± 0,99 |
6,17 ± 1,04 |
6,18 ± 0,87 |
1,2–3,4,5 < 0,05 |
|
Содержание кортикостерона в надпочечниках, пкмоль/мг ткани |
20,1 ± 2,2 |
21,5 ± 6,1 |
23,4 ± 2,2 |
23,9 ± 5,5 |
26,3 ± 4,8 |
|
|
Концентрация кортикостерона в сыворотке крови, нмоль/л |
132,6 ± 55,2 |
238,3 ± 58,2 |
278,5 ± 31,9 |
339,3 ± 23,0 |
432,1 ± 78,2 |
1–3,4,5 < 0,05 |
Концентрация кортикостерона в сыворотке крови была повышена у животных 2-й группы относительно у крыс 1-й группы, но не достоверно; у крыс 3-й группы после введения МФ концентрация кортикостерона повышалась дополнительно относительно крыс 2-й группы и становилась достоверно выше, чем у животных 1-й группы. У крыс 4-й и 5-й групп со стрептозотоциновым диабетом концентрация кортикостерона была еще выше, чем у крыс 3-й группы, но не различалась между собой.
Таким образом, у здоровых крыс в ответ на введение им per os МФ отмечена выраженная реакция со стороны ГГАКС, что проявилось гипертрофией надпочечников, усилением синтеза кортикостероидов на ранних этапах стероидогенеза, повышением содержания кортикостерона в сыворотке крови и увеличением экскреции свободного кортикостерона с мочой. При этом следует отметить, что, судя по величине экскреции этого гормона с мочой, реакция со стороны ГГАКС на введение МФ развивалась постепенно, достигая своего максимума после 5–6 введений препарата. Затем ее выраженность начинала снижаться, но экскреция кортикостерона у крыс 3-й группы даже в конце эксперимента оставалась выше величины этого показателя у крыс 2-й группы (с введением воды) почти в три раза.
У крыс после введения стрептозотоцина на фоне сопутствующей стрептозотоциновому диабету резко выраженной активации ГГАКС [14] в ответ на введение МФ дополнительных существенных изменений величин исследованных показателей, характеризующих глюкокортикоидную функцию коры надпочечников, не было обнаружено.
Ранее нами было показано, что у крыс со стрептозотоциновым диабетом меньшему, чем у здоровых крыс повышению концентрации кортикостерона в ответ на трехкратное интраперитонеальное введение мифепристона соответствовало большее увеличение активности фермента тирозинаминотрансферазы в печени крыс. При этом количество мРНК гена глюкокортикоидного рецептора в печени крыс без диабета не изменялось после введения мифепристона, а в печени крыс со стрептозотоциновым диабетом – повышалось [13]. Сопоставление ранее полученных и приведенных в настоящей работе результатов затруднительно в связи с разными сроками и формами введения МФ. Однако общие выявленные закономерности позволяют высказать предположение, что у крыс со стрептозотоциновым диабетом реакция со стороны ГГАКС на введение МФ выражена в меньшей степени, чем у здоровых крыс, но этот феномен ассоциирован с более выраженной реакцией клеток-мишеней на глюкокортикоидные гормоны. Можно также предполагать, что реакция со стороны надпочечников может быть различна в разные сроки после начала введения МФ, что, однако же, требует проведения дальнейших исследований.
Исследование выполнено с использованием оборудования ЦКП «Современные оптические системы» ФГБУ «НЦКЭМ» СО РАМН.
Рецензенты:
Поляков Л.М., д.м.н., профессор, вр.и.о. директора, зав. лабораторией медицинских биотехнологий, ФГБУ «НИИ биохимии» СО РАМН, г. Новосибирск;
Лушникова Е.Л., д.б.н., профессор, зав. лабораторией цитологии и клеточной биологии, ФГБУ «НИИ региональной патологии и патоморфологии» СО РАМН, г. Новосибирск.
Работа поступила в редакцию 15.05.2014.



