В современной морфологии разрабатываются многочисленные проблемы фундаментального и прикладного характера, среди которых значительное место отводится изучению регенераторных возможностей различных тканей и органов [2, 6, 9, 10].
Одной из тканей, восстановительные способности которой привлекают внимание многих гистологов, является мышечная [3, 5, 11].
Из известных мышечных тканей наиболее актуальным, с нашей точки зрения, является изучение наименее исследованных висцеральных мышечных тканей, входящих в состав стенок полых органов и образующих всевозможные сфинктеры [10]. Так, до настоящего времени среди морфологов и акушеров нет четкого представления о морфофункциональных особенностях нижнего сегмента матки, в который принято включать такие анатомические структуры, как шейка и перешеек матки. Полагают, что нижний сегмент матки является не просто сфинктером, выполняющим запирательную функцию шейки матки во время беременности, но и в известной мере индикатором, который позволяет прогнозировать особенности течения родов, предвидеть возможность наступления аномалий родовой деятельности [7, 13, 14].
Известно, что при травматических повреждениях развивается анатомическая недостаточность нижнего сегмента [1, 8]. Травматические повреждения в акушерско-гинекологической практике встречаются при насильственном расширении цервикального канала в случаях проведения искусственных абортов и диагностических выскабливаний, а также при оперативных родах, родах крупным плодом, родоразрешениях при неполном раскрытии маточного зева и др.
Учитывая, что наиболее частой патологией в акушерской практике со стороны шейки матки являются ее ригидность и несостоятельность, развивающиеся преимущественно после травм, а также отсутствие морфологического обоснования, необходимого для последующей разработки методов коррекции данных состояний, нами была определена цель исследования.
Цель исследования – изучить на ультраструктурном уровне изменения миоцитов миометрия нижнего сегмента матки, возникающие при его экспериментальном расширении и в ходе репаративной регенерации.
Для реализации поставленной цели был определен ряд задач:
- Смоделировать у крысы растяжение нижнего сегмента матки.
- Уточнить характер поражения миометрия при экспериментальном растяжении нижнего сегмента матки.
- Выяснить ведущие механизмы, включающиеся в ходе репаративной регенерации в миометрии.
Материал и методы исследования
Объектом исследования служили нерожавшие половозрелые белые крысы в количестве 30 особей. Экспериментальная часть осуществлялась в соответствии с «Правилами проведения работ с использованием экспериментальных животных». Для достижения поставленной цели крысам под эфирным наркозом было выполнено растяжение нижнего сегмента матки до диаметра, не превышающего размеров головки плода. Контролем служил материал от интактных крыс аналогичного возраста. Особенности течения посттравматической регенерации изучали на 3, 7, 10, 15 и 21 сутки. Для этого материал фиксировали в глутаровом альдегиде и заливали в эпон-аралдитовую смесь, контрастировали уранилацетатом и цитратом свинца, а далее готовили полутонкие и ультратонкие срезы.
Результаты исследования и их обсуждение
Растяжение нижнего сегмента матки приводит к неравномерному повреждению гладкой мышечной ткани в гистоархитектонике миометрия. В первые 3 дня после травмы в структуре функционального синцития определяются миоциты, как сохраняющие свое строение, так и дистрофически измененные и некротизирующиеся (рис. 1).
В ядрах дистрофически измененных лейомиоцитов наблюдаются изменения, последовательно сменяющие друг друга, начинающиеся от пристеночной конденсации хроматина, грубой конденсации и далее с развивающимися процессами усугубления состояния вплоть до кариорексиса и лизиса ядер (рис. 1).
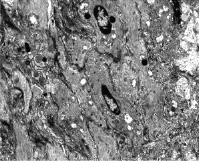
Рис. 1. Миометрий нижнего сегмента матки на 3 сутки после растяжения с пристеночной конденсацией хроматина и карипикнозом. ТЭМ. Увел. 1500Х
В цитоплазме этих клеток заметны явления уплотнения цитоплазматического матрикса. Цистерны саркоплазматического ретикулума расширяются, особенно страдают пристеночно расположенные кавеолы. Нарушается энергетический обмен в клетках. Митохондрии миоцитов набухают, что приводит к частичному и полному разрушению крист. Уменьшается количество органоидов специального назначения.
Контуры отдельных миоцитов нарушаются, что приводит к разрушению межклеточных взаимодействий, а как известно, лейомиоциты контактируют друг с другом при помощи механических и функциональных контактов, а именно десмосом и нексусов (рис. 2).
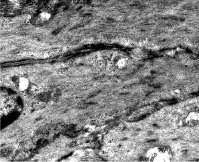
Рис. 2. Гладкие миоциты в единой интегрированной системе миометрия шейки матки интактной крысы. Контакты миоцитов указаны стрелками. ТЭМ. Увел. 5000Х
К 7–10 суткам посттравматического периода, несмотря на массивность альтерации, в гистоархитектонике миометрия нижнего сегмента матки имеются и сохранившиеся миоциты. Преимущественно к ним относятся светлые миоциты. Сходные данные о большей жизнеспособности светлых лейомиоцитов были получены и при экспериментальном растяжении внутреннего сфинктера прямой кишки [10]. В цитоплазме этих клеток заметны изменения в структуре органоидного аппарата. Отмечается уменьшение миофибрилл и наоборот, обилие свободных рибосом и полисом за счет развития гранулярной эндоплазматической сети (рис. 3). Это свидетельствует о смене фенотипа миоцитов с сократительных на синтезирующие.
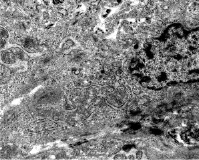
Рис. 3. Гладкий миоцит миометрия нижнего сегмента матки на 10 сутки регенерации. Уменьшение миофибрилл и развитие гранулярной эндоплазматической сети в цитоплазме гладкого миоцита. ТЭМ. Увел. 5000Х
Растяжение нижнего сегмента матки способствует не только разрушению клеток, но и реорганизации структуры межклеточного вещества. С 10 по 21 сутки регенерации заметно расширение межклеточных пространств, в результате чего имеет место глубокое повреждение механической связи между лейомиоцитами. Клетки оказываются изолированными друг от друга. Вероятно, такие изменения в структуре миометрия приведут и к нарушению его функции. В настоящее время существует мнение, что сокращение всех отделов матки происходит синхронно за счет мгновенного распространения возбуждения через щелевые контакты (нексусы), которые являются специальным механизмом проведения возбуждения, координирующим активность миллиардов мышечных клеток миометрия [12].
Межклеточные пространства заполняются белковыми массами, которые приобретают фибриллярное строение. Количество грубой волокнистой соединительной ткани к концу 3 недели регенерации увеличивается. Следует заметить, что ориентация новообразованных волокон резко нарушена
(в норме волокна располагаются по ходу оси лейомиоцита), что также приводит к нарушению упорядоченности расположения клеток в структуре слоев миометрия (рис. 4).
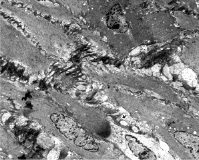
Рис. 4. Миометрий нижнего сегмента матки на 21 сутки регенерации. Нарушение межклеточных контактов за счет развития фибриллярного компонента межклеточного вещества ТЭМ. Увел. 1000Х
К 21 суткам восстановительного периода отмечается некоторое преобладание темных миоцитов над светлыми. В темных клетках, несмотря на более плотное расположение филаментов, заметно нарушение их параллельной ориентации. Контуры клеток имеют зубчатый вид. В примембранной части цитоплазмы количество контрактильного аппарата снижено (рис. 5).
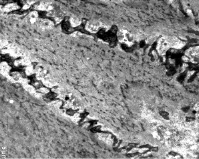
Рис. 5. Миометрий нижнего сегмента матки на 21 сутки регенерации. Нарушение межклеточных контактов за счет развития фибриллярного компонента межклеточного вещества. ТЭМ. Увел. 5000Х
Также стоит заметить, что за весь период наблюдения за ходом репаративной регенерации признаков митотического деления гладких миоцитов обнаружено не было. Следовательно, темные и светлые гладкие миоциты не следует рассматривать как разновидность камбиям [4].
Таким образом, с помощью электронной микроскопии нами было установлено, что при растяжении нижнего сегмента матки гладкие миоциты не участвуют в клеточной пролиферации, что, вероятно, обусловлено высоким уровнем дифференцировки, но вносят значительный вклад в закрытие дефектов погибших структур, суть которого заключается в активном синтезе межклеточного вещества фибриллярного строения, осуществляющегося за счет фенотипической трансформации митоцитов с сократительного (контрактильного) на «синтезирующий» тип. Регенерация миоцитов в нижнем сегменте матки осуществляется на внутриклеточном уровне.
Рецензенты:
Колсанов А.В., д.м.н., профессор, заместитель проректора Самарского государственного медицинского университета, заведующий кафедрой оперативной хирургии и клинической анатомии с курсом инновационных технологий, ГБОУ ВПО СамГМУ, г. Самара;
Дробышева Р.А., д.м.н., профессор кафедры морфологии и патологии НОУ ВПО СМИ «РЕАВИЗ», г. Самара.
Работа поступила в редакцию 07.05.2014.



