Механизм развития родовой деятельности остается одним из ключевых вопросов акушерской практики [1, 2, 6, 10]. В последние годы в мировой науке представлены новые концептуальные воззрения на инициацию сократительной деятельности матки [3]. Однако большинство исследований направлено на изучение механизмов, приводящих к преждевременным родам [1, 5, 7], тогда как до настоящего времени остаются не до конца изученными причины развития родовой деятельности при своевременных родах. Учитывая отсутствие четкого понимания механизмов развития родовой деятельности в доношенном сроке, остаются неясными причины, приводящие к перенашиванию беременности. Вместе с тем частота переношенной беременности в популяции составляет от 3 до 10 % и не имеет тенденции к снижению на протяжении длительного времени [3, 7].
Многочисленные факты свидетельствуют о том, что пролонгирование беременности и связанные с этим нарушения в маточно-плацентарном комплексе, ведущие к развитию аномалий родовой деятельности, внутриутробной гипоксии плода, связаны с изменением реактивности эндотелия кровеносных сосудов [11]. В развитии структурных и функциональных изменений шейки матки, эндотелия кровеносных сосудов маточно-плацентарного комплекса наряду с генетическими и иммунологическими факторами важную роль играют окислительный стресс и недостаточность оксида азота [8, 12]. Считается, что последнее обстоятельство частично обусловлено преобразованием NO в пероксинитрит или же снижением активности NO-синтазы. В то же время считают, что основным источником факторов, вызывающих дисфункцию эндотелия, является плацента [4]. Как известно, эстрогены активируют эндотелиальную eNOS [13], вызывают усиление экспрессии гена индуцибельной iNOS [9, 11]. Изменение содержания свободных аминокислот и их производных в биологических тканях и жидкостях часто свидетельствует о развитии того или иного патологического процесса. Аминокислоты занимают важное место среди азотистых компонентов шейки матки и околоплодных вод и эффективно используются организмом женщины в качестве пластического материала для подготовки шейки матки к родам. Диагностическое значение L-аргинина резко возросло, когда было установлено, что он является предшественником оксида азота (NO), обладающего широким спектром биорегуляторных действий. Основным вазодилататором, продуцируемым эндотелием, является NO, снижение синтеза которого многие связывают с формированием дисфункции эндотелия у человека [11, 12]. Снижение его синтеза связано с повреждением L-аргинин-транспортных систем, а также низким содержанием в крови L-аргинина, который образуется в орнитиновом цикле и является предшественником и активатором синтеза NO [9]. Считается, что снижение уровня NO при беременности может быть следствием активации перекисного окисления липидов, в результате чего NO переходит в пероксинитрит, а также снижения содержания L-аргинина как предшественника NO, что в свою очередь препятствует активации процессов, подготавливающих шейку матки к родовой деятельности [9, 13]. Все это обусловливает дальнейшее изучение вопроса о роли свободного L-аргинина и в целом системы L-аргинин-NO в развитии пролонгированной беременности [8, 12]. До настоящего времени изучение роли оксида азота в формировании родовой доминанты и в подготовке шейки матки к родам не было изучено. В доступной литературе также не уделено достаточного внимания роли оксида азота в процессах «созревания» шейки матки, улучшения оксидативных процессов в ней, а также применения препаратов, стимулирующих образование NO [7, 9]. С учетом предполагаемого участия оксида азота в процессах созревания шейки матки в последние годы появились работы, в которых с этой целью применяют препараты, увеличивающие его концентрацию в тканях [8]. Однако, имеющиеся в литературе исследования малочисленны и часто носят противоречивый характер [1, 7]. Вышеизложенное обусловливает необходимость оптимизации подходов к подготовке шейки матки и родовозбуждению. В связи с этим целью настоящего исследования явилось исследование оксидативного статуса беременных в сроке 41 неделя + 4 дня с целью последующей разработки для повышения эффективности преиндукции родов метода подготовки к родам с использованием активаторов оксида азота.
Материалы и методы исследования
Исследования проводились на кафедрах акушерства, гинекологии и перинатологии и биохимии Кубанского государственного медицинского университета, базой исследования было отделение акушерской патологии и родовое отделение Перинатального центра ГБУЗ «Детская краевая клиническая больница» г. Краснодара. Объект исследования: беременные в сроке 41 неделя + 4 дня, которым была проведена преиндукция родовой деятельности мифепристоном – 43 пациентки:
I группа – эффективная преиндукция, роды без осложнений, заканчивались консервативно, рождением плода без признаков гипоксии (24);
II группа – неэффективная преиндукция, потребовавшая оперативного родоразрешения (19).
Клинико-биохимический контроль – женщины с доношенной беременностью в сроке 40 недель со зрелыми родовыми путями, родоразрешенные консервативно без применения преиндукции родовой деятельности – 20 беременных.
Критерии исключения: рубец на матке, неправильные положения плода, крупный плод, тяжелая экстрагенитальная патология, среднетяжелый и тяжелый гестоз.
Преиндукция родовой деятельности включала пероральный прием мифепристона (200 мг однократно) (в случае необходимости повторный прием в той же дозировке через 48 часов).
Методы исследования: ретроспективный анализ архивного материала (истории родов, амбулаторные карты); клинический – сбор анамнеза, осмотр, общий анализ крови, мочи; наружное акушерское исследование; внутреннее акушерское исследование (в зеркалах и бимануально, оценка состояния степени зрелости шейки матки по шкале Е.Х. Бишопа); ультразвуковой (трансвагинальный, трансперитонеальный доступ) – проведение исследования состояния плода, допплерометрия сосудов маточно-плацентарного комплекса, комплексное определение состояния родовых путей (длина шейки матки, толщина нижнего сегмента матки, диаметр внутреннего зева, задний угол шейки матки, расстояние между головкой плода и промежностью, допплерометрия (ЦДК)); кардиотокография плода; гистерография; биохимический – определение глюкозы, билирубина, трансаминаз, белковых фракций, щелочной фосфатазы в крови. Определение в цервикальной слизи уровня аргинина методом капиллярного электрофореза и содержания метаболитов NO (NO базальный и индуцированный, iNOS) с помощью классической реакции Грисса, пероксинитрита –спектрофотометрически.
Статистическая обработка материала проводилась методом вариационной статистики и корреляционного анализа с помощью программы Microsoft Office Excel 2010 (Windows Office 2010). Результаты исследований были обработаны методом вариационной статистики с определением критерия Фишера (F) для оценки непараметрических показателей групп малых выборок и критерием Стьюдента (t) для независимых групп. Анализ проводился с использованием методов медико-биологической статистики, программы «STATISTICA» 6,0.
Результаты исследования и их обсуждение
Сравнительный анализ показал, что в группе клинико-биохимического контроля уровень аргинина в цервикальной слизи был в 2,8 раза выше, чем в I группе (31,2 ± 3,8 против 11,1 ± 1,2 мг/л; p < 0,005). В группе, где преиндукция оказалась неэффективной – II, различия в уровне аргинина доходили до 4,6 раз (6,8 ± 1,1 мг/л; p < 0,001). Содержание базального (NO) и индуцированного метаболита оксида азота (iNOS) в цервикальной слизи тесно коррелировало с уровнем аргинина, и было выше более, чем в 3 раза, в I группе (36,4 ± 4,2 и 45,1 ± 6,3 мкмоль/л/ч против 11,7 ± 1,5 и 15,1 ± 2,2 мкмоль/л/ч; p < 0,006), по сравнению с группой женщин, родоразрешенных физиологически. В группе родоразрешенных оперативным путем (неэффективность преиндукции) NO и iNOS находился в пределах значений 7,3 ± 2,0 и 3,2 ± 2,1 мкмоль/л/ч (p < 0,003). Пероксинитрит, обладающий окислительной активностью, сопоставимой с реакционной способностью гидроксильного радикала, и вызывающий нитрование некоторых органических соединений, в контрольной группе был на уровне 4,8 ± 1,1 мкмоль/л, а в I и II группах содержание пероксинитрита было в пределах 5,6 ± 2,8 мкмоль/л, но эти различия не были достоверными (p < 0,05) (рис. 1).
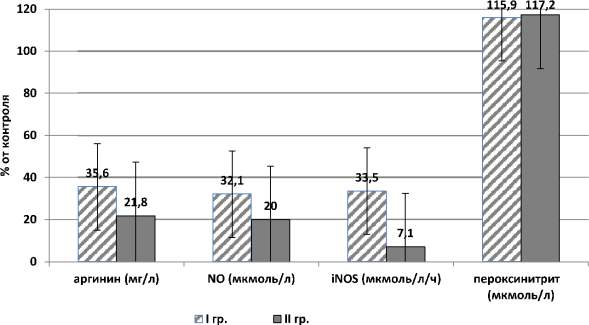
Рис. 1. Содержание L-аргинин – оксид азота – пероксинитрит в цервикальной слизи
В литературе существуют противоположные данные об изменении метаболизма NO при начале родовой деятельности. С началом родов некоторые авторы отмечают интенсификацию синтеза оксида азота, обусловленную, по-видимому, как индуцированной окислительным стрессом усиленной экспрессией iNOS, а также адаптационной интенсификацией экспрессии eNOS в ответ на уменьшающуюся перфузию ткани плаценты, гипоксию и увеличенную резистентность кровеносных сосудов [12]. Выявленное другими авторами снижение интенсивности синтеза оксида азота является результатом мутации гена eNOS и уменьшения содержания его РНК [13]. L. Myatt и соавторы [2010] считают, что уменьшение содержания оксида азота в плаценте может быть вызвано характерной для плацентарной ишемии интенсификацией процессов свободнорадикального окисления, нарушением баланса между NO и супероксидрадикалами (O2–) и трансформацией оксида азота в пероксинитрит. Пероксинитрит участвует в пероксидационных процессах в биологических мембранах, окислении белков, нитрирует их аминокислотные остатки, что обуславливает изменение структуры и функции белков, нарушает тирозинкиназную сигнальную систему, посредством нитрозилирования электроннотранспортных белков митохондрий ингибирует транспорт электронов в митохондриях, способствует деструкции гладкомышечных клеток вороснитчатого эпителия, интенсификации апоптоза и некроза синцитиотрофобласт, нарушения перфузии, транспорта и стероидогенеза в плаценте [4, 6, 9]. По нашему мнению, редокс-зависимая трансформация NO в плаценте, мышечных волокнах шейки и тела матки является основной причиной уменьшения содержания оксида азота, что способствует торможению начала родовой деятельности. Кроме того, уменьшение содержания NO способствует развитию ишемии плаценты, дистрофических изменений и очаговых некрозов синцитиотрофобласт, повреждению кровеносных сосудов, увеличению чувствительности клеток плаценты к проапоптозным стимулам, интенсификации апоптоза и некроза. Таким образом, во время физиологической беременности
оксид азота обеспечивает сохранение баланса между содержанием кислорода и интенсивностью митохондриального дыхания, регуляцию интенсивности окислительного метаболизма, мембранного потенциала митохондрий, защиту клеток от повреждения, а также способствует активизации процессов, запускающих родовую деятельность.
В ходе проведения преиндукции родов оценивался биохимический состав цервикальной слизи до ее проведения и через 12 часов после начала преиндукции родовой деятельности (рис. 2). Уровень аргинина в цервикальной слизи в процессе преиндукции родов в I группе повысился в 7,9 раз (~ в 2,5 раза превысив значения контрольной группы) (82,2 ± 12,6 мг/л; p < 0,5). При этом во II группе также было зарегистрировано некоторое повышение содержания аргинина (~ на 37 %).
Базальные (NO) и индуцированные метаболиты оксида азота (iNOS) в цервикальной слизи после преиндукции в I группе (эффективная преиндукция родов) выросли в 3 раза и соответствовали уровню контроля (NO 38,2 ± 5,6 мкмоль/л; iNOS 51,2 ± 3,3 мкмоль/л/ч; p < 0,005). Во II группе (неэффективная преиндукция) данные показатели также демонстрировали некоторое увеличение по сравнению с исходными данными (12 % NO и 21 % iNOS), но все равно были низкими по сравнению со значениями контроля (NO 8,1 ± 1,6 мкмоль/л, iNOS 4,7 ± 1,2 мкмоль/л/ч; p < 0,005) (рис. 2).
Различия в содержании пероксинитрита носили достоверный (p < 0,005) характер только там, где на фоне проведения преиндукции родовой деятельности выявлены признаки нарастающей плацентарной недостаточности и внутриутробной гипоксии плода (т.е. данное повышение в основном было зарегистрировано во II подгруппе) (рис. 2) и было на уровне 7,8 ± 2,9 мкмоль/л.
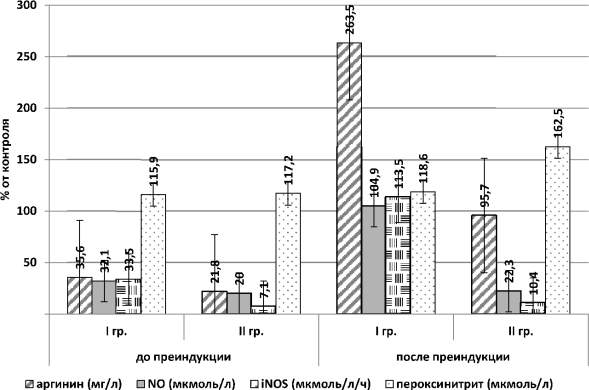
Рис. 2. Биохимические показатели цервикальной слизи
в процессе преиндукции родовой деятельности
Таким образом, выявлено участие окислительного стресса в возникновении пускового механизма родовой деятельности. В связи с чем возможна перспективность оптимизации тактики ведения доношенной и пролонгированной беременности с применением активаторов оксида азота (в частности, L-аргинина). При этом молекулярно-биологические аспекты окислительного стресса и обмена оксида азота еще недостаточно изучены, что требует дальнейшего продолжения исследований в этом направлении.
Рецензенты:
Федорович О.К., д.м.н., профессор кафедры акушерства, гинекологии и перинатологии ФПК и ППС, ГБОУ ВПО «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Краснодар;
Карахалис Л.Ю., д.м.н., профессор кафедры акушерства, гинекологии и перинатологии ФПК и ППС, ГБОУ ВПО «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Краснодар.
Работа поступила в редакцию 28.05.2014.



