Органические фотохромные красители обладают целым рядом полезных свойств, чем обеспечивают неослабевающий интерес исследователей [2]. Отдельным классом таких соединений являются спиропираны индолинового ряда. Влияние заместителей на их фотохромные свойства хорошо изучено на соединениях, содержащих различные p-акцепторные заместители хроменовой части [3]. Исследование влияния p-донорных заместителей ограничено отсутствием их разнообразия, однако представляет несомненный интерес, так как 1,3,3-триметил-6’-гидроксиспиро(индолино-2,2’-[2H]-бензопиран) [5], а также индолиноспиропираны, содержащие метоксигруппу в 2Н-хроменовом фрагменте [4], проявляют фотохромные свойства в твердой фазе. Оригинальной заменой p-донорной метоксигрупы в положении 6’ хроменового ядра является конденсированный фурановый фрагмент.
Цель исследования. Одним из ключевых факторов, влияющих на спектрально-кинетические характеристики фотохромных соединений, содержащих индолиновый спироцикл, является природа заместителя при атоме азота. Таким образом, целью данного исследования стало получение серии индолиновых спиропиранов с аннелированным бензофурановым фрагментом, содержащих метильный и бензильный заместители в индолиновой части молекулы.
Замена метильной группы на бензильный радикал в указанных выше соединениях представляет интерес для исследования строения таких соединений методами многоядерной ЯМР спектроскопии, а также изучения влияния объемного бензильного заместителя в индолиновом фрагменте на фотоиндуцируемые процессы трансформации фотохромной системы.
Результаты исследования и их обсуждение
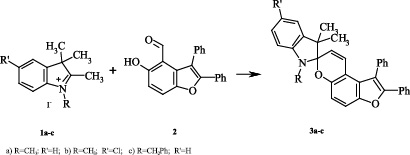
В рамках данного исследования нами был получены спиропираны (3a-c) непродолжительным кипячением эквимолекулярных количеств соответствующих N-замещенных перхлоратов 2,3,3-триметилиндоленилия 1а-с, гидроксиальдегида 2[1] и пиперидина в изопропаноле.
Строение полученного соединения (3a-c) подтверждено данными элементного анализа, ИК, ЯМР 1Н, а для (3с) ЯМР 13С и ЯМР 15N спектроскопии.
Для расшифровки спектров ЯМР 1Н и ЯМР 13С использовался ряд методик двумерной спектроскопии: COSY 1H–1H, HSQC 1Н–13C, HMBC 1Н–13С, HMBC 1H–15N.
а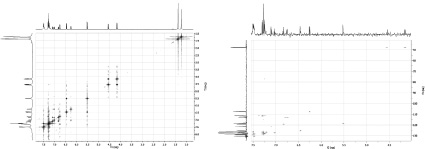 б
б
Рис. 1. Cпектры ЯМР соединения 3c: а – двумерный корреляционный спектр COSY 1H–1H (а); б – одноквантовый гетероядерный корреляционный спектр HSQC 1Н–13C (b)
Корректное отнесение сигналов в спектрах ЯМР 1Н спиропирана 3с подтверждает двумерный корреляционный спектр COSY 1H-1H (рис. 1, a).
Для идентификации сигналов в спектрах ЯМР 13С соединения 3с использовались одноквантовые гетероядерные корреляционные спектры HSQC 1Н-13C (рис. 1, б).
Для отнесения химических сдвигов атомов углерода, не связанных с атомами водорода, были применены методики гетероядерной корреляции по дальним связям: HMBC 1Н-13С (рис. 2, a) и HMBC 1H-15N (рис. 2, б).
Корреляционные спектры по дальним связям, с помощью которых были однозначно идентифицированы все атомы углерода в молекуле, не связанные с атомами водорода, полностью подтвердили строение полученного соединения 3с.
а б
б
Рис. 2. Гетероядерные корреляционные спектры соединения 3c по дальним связям: a – HMBC 1Н–13С; б – HMBC 1H–15N
Сигнал при 104 м.д. был надежно отнесен к спироатому С-2,3′ что полностью соответствует J-константам второго порядка, отображающим взаимодействие атома углерода С-2,3′ с протоном Н-2′, и третьего порядка, показывающим взаимодействие атома углерода С-2,3′ с протонами метильных групп в положении 3, а также метильной группы при атоме азота и протоном Н-1′.
Фото и термохромные спиропираны, содержащие диастереотопные группы, могут быть объектом изучения процесса термоиндуцированной изомеризации методом динамического ЯМР. В спиропиранах 3 такими группами являются гем–диметильные группы в положении 3 индолинового фрагмента. Определение констант скоростей и активационных параметров может быть осуществлено с использованием данных температурной зависимости спектров ЯМР обменивающихся диастереотопных групп. В отсутствие обмена в спектрах проявляются два синглетных сигнала неэквивалентных метильных групп, находящихся в положении 3, которые уширяются с увеличением температуры (рис. 3).
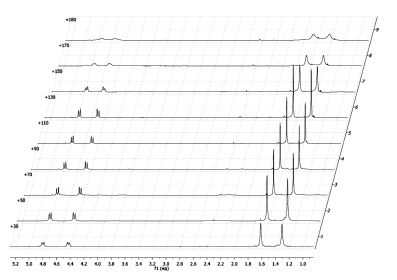
Рис. 3. Динамика сигналов протонов метильных и метиленовых групп в спектре ЯМР 1Н соединения 3с при температурах 30–180 °С в нитробензоле-D5
Динамика изучалась в растворе нитробензола-D5 на примере соединения 3с. Данные ЯМР 1Н спектроскопии при 30 °C подтверждают, что изучаемое соединение 3с находится в спироциклической форме. Об этом свидетельствуют не только два трехпротонных синглетных сигнала от метильных групп в положении 3 индолинового фрагмента при 1,21 и 1,35 м.д., но дублет-дублетный сигнал метиленовой группы бензильного заместителя при 4.12-4.53 м.д. (рис. 3). При нагревании пики сигналов протонов, характеризующие спироциклическую форму 3с на спектре ЯМР 1Н начинают «съезжаться», однако полная коалесценция сигналов ни метильных, ни метиленовых протонов не достигается в условиях эксперимента. Это позволяет сделать вывод о том, что величина свободной энергии конверсии закрытой формы спиропиранов достаточно высока, и для ее определения необходимо применить специальный расчетный аппарат для определения теоретической температуры коалесценции и, соответственно, активационных параметров термоиндуцированной валентной изомеризации спиропиранов 3.
Данные кинетических фотохимических исследований показали незначительный рост интенсивности полосы поглощения в длинноволновой области спектра раствора бензильного производного 3с относительно соединений 3a, b после возбуждения светом с длиной волны 365 нм при комнатной температуре (рис. 4, таблица), в то время как при температуре 203 К наблюдается обратимый фотохромный процесс, протекающий с образованием интенсивно окрашенного раствора (рис. 4). Данное явление можно объяснить невысоким временем жизни окрашенной фотоиндуцированной формы соединения 3c при комнатной температуре, в то время как при –70 °C наблюдается динамичный процесс образования фотоиндуцированного продукта при действии возбуждающего облучения светом с λ = 365 нм с последующей релаксацией (рис. 4).
а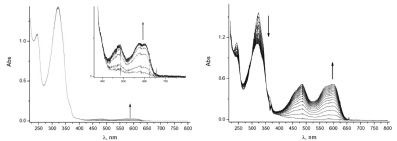 б
б
Рис. 4. Спектры поглощения раствора спиропирана 3с в этаноле при облучении светом с λ = 365 нм в стационарном режиме: а – при Т = 293 К (dt = 1 сек); б – при Т = 226 К (dt = 10 с)
Спектральные характеристики и кинетика обесцвечивания фотоиндуцированных форм 3 в этаноле при 293 К
|
Соединение |
|
|
τ293K, c |
|
3a |
245, 320, 362 sh |
476, 586 |
3,09 |
|
3b |
252, 320, 361 sh |
484, 598 |
1,16 |
|
3c |
244 (22100), 323 (29300), 363 (4500) sh |
482, 596 |
0,69 |
Фотохимические превращения соединения 3с были изучены также в полистирольной пленке, полученной испарением раствора полистирола и соединения 3с в дихлорметане в течение 2 суток в защищенном от света месте. Спектры поглощения были измерены на спектрофотометре Hitachi U3210, спектры в условиях стационарного облучения ртутной лампой высокого давления ДРШ-250, дифракционный монохроматор МДР-12 и фокусирующую оптику из кварца.
Спектры поглощения полистирольной пленки в процессе облучения на длине волны ртутного спектра 365 нм. Интенсивность длинноволновая полосы поглощения при 350 нм на протяжении 50 минут последовательно уменьшалась, при этом в диапазоне 483 нм наблюдался небольшой рост оптической плотности. В более длинноволновой области спектра (550–700 нм) сколько-нибудь заметного роста поглощения зафиксировано не было.
Экспериментальная часть
ИК спектры записаны на спектрометре Varian Excalibrum 3100 FT-IR (методом нарушенного полного внутреннего отражения). Спектры ЯМР 1H записаны на спектрометре Bruker Avance-600 (600 МГц) в импульсном Фурье-режиме в дейтерохлороформе (CDCl3). Электронные спектры поглощения растворов исследуемых соединений до и после облучения регистрировались на спектрофотометре Agilent 5483; в качестве источника фотоактивного УФ-излучения использовалась ртутная лампа ДРШ-250 со светофильтром, выделяющим линию ртутного спектра 365 нм.
1,3,3-триметил-1',2'-дифенилспиро[фуро[3,2-f]хромен-7',2-индолин] 3а. К суспензии 0,2735 г (1 ммоль) перхлората 1,2,3,3тетраметилиндолиния в 10 мл изопропанола при 50 °C прибавляют 0,1 мл пиперидина при перемешивании и к образующемуся раствору прибавляют 0,314 г (1 ммоль) 5-гидрокси-4-формил-2,3-дифенилбензо[b]фурана [5]. Образующийся раствор выдерживают при кипении в течение одного часа. После охлаждения образующийся осадок отфильтровывают, промывают этанолом и сушат. Тпл = 177-180 °C (из этанола), выход 0,337 г (72 %). Найдено, %: C - 84,32; H - 5,92; N - 3,09. С33H27NO2. Вычислено, %: С - 84,41; H - 5,80; N - 2,98. ИК-спектр, ν, см-1: 1643, 1606, 1584, 1500, 1481, 1462, 1446, 1430, 1403, 1381, 1358, 1342, 1297, 1274, 1257, 1238, 1228, 1215, 1190, 1149, 1093, 1058, 1009, 951, 930. Спектр ЯМР 1H: δ, м.д., (J, Гц): 1,13 (3 Н, с, гем. -СН3); 1,34 (3 Н, с, гем. -СН3); 2,72 (3 Н, c, N-СН3); 5,45 (1 Н, д, J = 10,43, Н-2'); 6,5 (1 Н, д, J = 7,65, Н-5); 6,51 (1 Н, д, J = 10,44, Н-1'); 6.74 (1 Н, д, J = 8,8, Н-5'); 6.86 (1 Н, тд, JH-4 = 7,65, JH-7 1,23, Н-5); 7,09 (1 Н, дд, JH-5 = 7,22, JH-6 = 0,94, Н-4); 7,19 (1 Н, т, JH-7 = 7,64, JH-4 1,25, Н-6); 7,24-7,26 (4 Н, м, Н-Ph); 7,25 (1 Н, д, J = 7,6, Н-6'); 7,45-7,55 (6 Н, м, Н-Ph).
1,3,3-триметил-5-хлор-1',2'-дифенилспиро[фуро[3,2-f]хромен-7',2-индолин] 3b получают аналогично соединению 3а из перхлората 5-хлор-1,2,3,3тетраметилиндолиния в и 5-гидрокси-4-формил-2,3-дифенилбензо[b]фурана с выходом 81 %. Тпл = 183 °С (из этанола), Найдено, %: C - 78,51; H - 5,16; Cl - 6,91; N - 2,94. С33H26ClNO2. Вычислено, %: C - 78,64; H - 5,20; Cl - 7,03; N - 2,78. ИК спектр, ν, см-1: 1641, 1604, 1582, 1481, 1445, 1430, 1417, 1352, 1341, 1209, 1256, 1226, 1147, 1092, 1062, 1011, 958, 934. Спектр ЯМР 1H: δ, м.д., (J, Гц): 1,11 (3 Н, с, гем. -СН3); 1,31 (3 Н, с, гем. -СН3); 2,68 (3 Н, c, N-СН3); 5,42 (1 Н, д, J = 10,43, Н-2'); 6,41 (1 Н, д, J = 8,22, Н-7); 6,52 (1 Н, д, J = 10,47, Н-1'); 6,73 (1 Н, д, J = 8,22, Н-5'); 7,02 (1 Н, c, JH-6 = 2,07, Н-4); 7,12 (1 Н, дд, JH-7 = 8,2, JH-4 = 2,1, Н-6); 7,24-7,26 (4 Н, м, Н-Ph); 7,28 (1 Н, д, J = 8,22, Н-6'); 7,45-7,55 (6 Н, м, Н-Ph).
1-Бензил-3,3-диметил-1',2'-дифенилспиро[фуро[3,2-f]хромен-7',2-индолин] 3с получают аналогично соединению 3а из перхлората 1-бензил -2,3,3тетраметилиндолиния и 5-гидрокси-4-формил-2,3-дифенилбензо[b]фурана с выходолм 92,1 %. Tпл = 179-183 °С. Найдено, %: C - 85,82; H - 5,74; N - 2,59. C39H31NO2. Вычислено, %: C 85.84; H 5.73; N 2.57. ИК спектр, ν, см-1: 1639, 1604, 1478, 1455, 1446, 1350, 1286, 1252, 1226, 1156, 1131, 1090, 1059. Спектр ЯМР 1H: δ, м.д., (J, Гц): 1,21 (3 Н, с, гем. -СН3); 1,35 (3 Н, с, гем. -СН3); 4,12-4.53 (2 Н, дд, N-СН2-); 5,49 (1 Н, д, J = 10,44, Н-2'); 6,22 (1 Н, д, J = 7,65, Н-7); 6,42 (1 Н, д, J = 10,46, Н-1'); 6,73 (1 Н, д, J = 7,6, Н-5'); 6,8 (1 Н, тд, JH-4 = 7,54, JH-7 0,92, Н-5); 7,00 (1 Н, т, JH-7 = 7,64, JH-4 1,29, Н-6); 7,08 (1 Н, дд, JH-5 = 7,19, JH-6 = 0,94, Н-4); 7,13-7,25 (8 Н, м, Н-Ph); 7.24 (1 Н, д, J = 7,6, Н-6'); 7,4-7,5 (7 Н, м, Н-Ph).
Работа выполнена с использованием оборудования ЦКП ЮФУ «Молекулярная спектроскопия» и при финансовой поддержке РФФИ (грант 13-03-90437) и ДФДД Украины (договор Ф53/92-2013).
Рецензенты:
Дубоносов А.Д., д.х.н., ведущий научный сотрудник, ЮНЦ РАН, г. Ростовна-Дону;
Черныш Ю.Е., д.х.н., ведущий научный сотрудник, НИИ ФОХ ЮФУ, г. Ростовна-Дону.
Работа поступила в редакцию 01.04.2014.




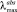 (SP), нм, (ε, М–1см–1)
(SP), нм, (ε, М–1см–1)
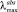 (MC), нм
(MC), нм