Горечавка желтая Gentiana lutea L. – реликтовый европейско-азиатский высокогорный вид, который в Украинских Карпатах находится на северной границе ареала. В связи с уменьшением численности особей, нарушением популяционной структуры, угрозой жизнеспособности популяций через антропогенное воздействие (в частности выпас, вытаптывание, заготовку ценного лекарственного сырья) этот вид охраняется во многих европейских странах. Горечавка желтая отнесена к категории «уязвимые виды» Красной книги Украины (2009 г.). Состояние популяций G. lutea в Украине обусловило необходимость оценки ресурсов вида.
В современных популяционно-генетических исследованиях растений успешно применяют методы молекулярно-генетического анализа на основе полимеразной цепной реакции (ПЦР) с использованием различных типов маркеров. В частности, с помощью ПЦР-маркеров оценен генетический полиморфизм представителей рода Gentiana: RAPD – Gentiana nivalis L., Gentiana acaulis L., Gentiana punctata L., Gentiana cruciata L.; ISSR – Gentiana atuntsiensis W.W. Smith, Gentiana striolata T.N. Ho; SSR – Gentiana crassicaulis Duthie ex Burk и др. [5, 8, 10, 11]. Ранее нами установлен уровень генетического разнообразия и генетическая структура популяций G. lutea методами RAPD-, ISSR- и IRAP-ПЦР [3, 4]. Накопление информации о функционально-важных участках генома, в частности кодирующих и регуляторных участках генов, стимулировало разработку новых методов ПЦР-анализа, основанных на использовании праймеров, гомологичных к консервативным мотивам этих участков. К таким методам исследования относят RGAP-анализ (resistance gene analog polymorphism) с праймерами, гомологичными к консервативным участкам генов устойчивости к патогенам [7]. Проведение такого анализа G. lutea позволит оценить состояние генофонда и генетическую дифференциацию популяций этого вида, а также определить взаимосвязь между уровнем генетической вариабельности и эколого-географическими условиями его роста. Эти данные, в свою очередь, могут быть основой для разработки научно обоснованных методов сохранения и восстановления популяций горечавки желтой.
Целью работы было определение уровня генетического полиморфизма популяций G. lutea с Украинских Карпат с использованием RGAP-маркеров.
Материал и методы исследования
Материалом для исследования служили растения с пяти природных (горы Шешул и Павлик – Sh, полонина Лемская – Lem, гора Гутин Томнатек – HT, горы Трояска-Татарука – Tr, полонина Крачунеска – Kr) и одной искусственно созданной (гора Пожижевская – Pozh) популяций G. lutea с Свидовецкого и Черногорского массивов Украинских Карпат. С разных частей каждой популяции было отобрано по 15 образцов, кроме популяции на горе Гутин Томнатик, с которой, в связи с малой численностью, отобрано 11 образцов.
Выделение растительной ДНК проводили по усовершенствованной нами методике Rogers S.O. i Bendich A.J. [9]. Для ПЦР-анализа использовали 6 пар RGAP праймеров: Cre3Ploop + Cre3-k3, NLRR-INV1 + NLRR-INV2, Pto kin3 + Pto kin4, RLRR for + RLRR rev, XLRR for + XLRR rev, XLRR-INV1 + XLRR-INV2 [2]. ПЦР проводили в термоциклере Терцик МС 2 («Биотехнология», Россия). Реакционная смесь объемом 20 мкл содержала 30 нг ДНК, 0,2 мМ dNTP, 1,25 U Taq-полимеразы, 0,5 мкМ праймера, 1×ПЦР-буфер с 2,5 мM MgCl2. Для предотвращения испарения на нее наслаивали 15 мкл минерального масла. Проба отрицательного контроля содержала полную амплификационную смесь без ДНК. Для проведения RGAP-ПЦР использовали температурный режим: 94 °С – 5 мин, 45 циклов (94 °С – 30 с, 45 °С – 45 с, 72 °С – 1 мин), 72 °C – 7 мин Продукты реакции амплификации разделяли электрофорезом в 1,3 % агарозном геле с 0,5 мкг/мл бромистого этидия, в 1×SB буфере в течение 5–6 часов при напряженности электрического поля 4–5 В/см и фотографировали в УФ-свете. Для определения длины фрагментов использовали ДНК-маркер молекулярной массы (100 bp + 1,5 Kb + 3 Kb DNA Ladder) («ООО-СибЭнзим-М», Москва).
Электрофореграммы представляли в виде бинарных матриц. Каждый амплифицированный фрагмент считали доминантным аллелем отдельного локуса, а его отсутствие расценивали как рецессивный аллель соответствующего локуса. Для оценки уровня генетического полиморфизма использовали следующие параметры: доля полиморфных ампликонов (P), индекс Шеннона (S), ожидаемая гетерозиготность (He), генетические расстояния Жаккарда (Dj) и Неи. На основе генетических расстояний по Неи методом невзвешенной попарно-групповой кластеризации (UPGMA) построена дендрограмма генетического сходства исследованных популяций. Распределение общей генетической изменчивости между исследованными популяциями и в их пределах изучали методом анализа молекулярной дисперсии (AMOVA). Оценку корреляций между матрицами генетических расстояний по Неи и географическими расстояниями исследованных популяций осуществляли с использованием теста Мантела (999 permutations) [6].
Результаты исследования и их обсуждение
В результате RGAP-анализа образцов из шести популяций G. lutea с использованием 6 праймеров получено 84 ампликоны, из которых 79 (94,1 %) были полиморфными. Количество учтенных фрагментов в RGAP-спектрах составляло от 39 до 52 для отдельных популяций (таблица). Исследованные выборки отличались по частотам RGAP-локусов, однако присутствовали ампликоны, характерные только для образцов из отдельных популяций (таблица). Наибольшее количество уникальных ампликонов (8) было в популяции с горы Пожижевская.
Среднее количество ампликонов на популяцию, синтезированных RGAP-праймерами, было самым большим при использовании пары праймеров Cre3Ploop + Cre3-k3 (9 амп./поп.), XLRR for + XLRR rev (10 амп./поп.), XLRR-INV1 + XLRR-INV2 (10,3 амп./поп.), самым меньшим – Pto kin3 + Pto kin4 (4,5 амп./поп.). В общем, во время исследования горечавки желтой установлено, что праймеры на основе LRR, P-loop (phosphate binding loop) доменов амплифицируют большее количество вариантов продуктов, чем праймеры на основе киназного домена. Это позволяет предположить, что LRR-, P-loop-содержащие последовательности в геноме G. lutea более полиморфные по сравнению с другими последовательностями.
Для определения уровня генетического разнообразия популяций G. lutea нами были рассчитаны основные показатели генетической гетерогенности (табл.). Природные популяции с хребта Черногора (Sh, Lem, HT) характеризовались высокими показателями генетического полиморфизма (P, He, S) по сравнению с популяциями из Свидовецкого массива (Kr, Tr). По трем показателям P, He, S все исследованные популяции можно распределить следующим образом: Sh > Lem ≈ HT > Kr ≈ Tr > Pozh, причем наибольшие и наименьшие значения отличались по каждому из показателей примерно в 2–3 раза. Очевидно, это связано с различиями как эколого-географических условий роста популяций, так и их групповых характеристик (плотность, численность) и режима использования. В частности известно, что черногорские популяции находятся в условиях заповедника, тогда как свидовецкие подвергаются значительному пастбищному воздействию [1]. Низким уровнем полиморфизма по всем использованным показателям (P, He, S Dj) характеризовалась агропопуляция с горы Пожижевская (таблица).
Значения основных показателей генетического полиморфизма исследованных популяций G. lutea по данным RGAP-анализа
|
Популяция (местонахождение) |
Учтено ампликонов, шт. |
Фиксированные ампли-коны, шт. |
Уникальные для популяции ампликоны, шт. |
Доля полиморфных ампликонов (Р), % |
Ожидаемая гетерозиготность (He) |
Индекс Шеннона (S) |
Генетические расстояния между растениями по Жаккарду (Dj), % |
Среднее генетическое расстояние между растениями по Жаккарду (Dj), % |
|
Лемская |
51 |
23 |
3 |
33,3 |
0,106 ± 0,019 |
0,160 ± 0,028 |
5,6–37,2 |
23,1 |
|
Гутин Томнатек |
39 |
12 |
1 |
32,1 |
0,106 ± 0,019 |
0,159 ± 0,028 |
3,6–57,6 |
28,2 |
|
Пожижевская |
46 |
27 |
8 |
22,6 |
0,051 ± 0,013 |
0,083 ± 0,019 |
0–34,1 |
15,2 |
|
Шешул ‒ Павлик |
52 |
11 |
1 |
48,8 |
0,177 ± 0,023 |
0,263 ± 0,032 |
7,9–69,6 |
30,7 |
|
Крачунеская |
44 |
23 |
3 |
25 |
0,077 ± 0,017 |
0,118 ± 0,025 |
0–35 |
15,8 |
|
Трояска Татарука |
43 |
24 |
1 |
22,6 |
0,075 ± 0,017 |
0,112 ± 0,025 |
2,8–30,8 |
17,9 |
|
В среднем |
46 |
20 |
3 |
30,8 |
0,099 ± 0,008 |
0,149 ± 0,011 |
3,3–44 |
21,8 |
|
Суммарная выборка растений |
84 |
5 |
– |
94,1 |
0,242 ± 0,020 |
0,376 ± 0,026 |
0–80 |
49,7 |
Наибольшие генетические расстояния (Dj) между растениями установлены в популяции Sh, несколько меньше – в HT и Lem, наименьшие – в Свидовецких популяциях (Kr и Tr) и агропопуляции Pozh (таблица). Высшее (Sh) и низкое (Pozh) средние значения Dj для популяций отличались в 2 раза. Удаленность популяций оценивали по генетическим расстояниям Неи, на основе которых методом UPGMA построена дендрограмма генетического сходства исследованных популяций G. lutea (рисунок). На дендрограмме показано формирование кластера, в который вошли все исследованные природные популяции независимо от принадлежности к горному массиву. Отдельной ветвью от этого кластера отделилась Пожижевская агропопуляция. В пределах полученного кластера наиболее удаленной от других популяций оказалась Крачунеская. Среднее значение расстояний между Tr, Lem, HT, Sh составляло 0,144. По результатам теста Мантела (r = –0,4, p = 0,140) корреляция между генетическими и географическими расстояниями популяций отсутствует.
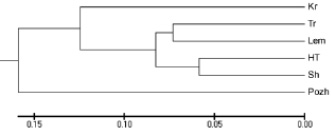
Дендрограмма генетических расстояний между популяциями G. lutea, построена методом UPGMA по генетическим расстояниям Неи на основе данных RGAP-анализа
Анализ молекулярной вариансы (AMOVA) показал, что в составе общей генетической гетерогенности вида 68 % генетического разнообразия G. lutea приходится на межпопуляционные различия, а 32 % составляет доля внутрипопуляционного полиморфизма. Изоляция популяций, очевидно, существовала в течение длительного времени и привела к накоплению межпопуляционных различий.
Сравнительный анализ популяций по основным показателям генетического полиморфизма показал, что уровень генетического разнообразия популяции с гор Шешул и Павлик – крупнейшей популяции G. lutea с Украинских Карпат (площадь ~ 40 га), был высоким. Полученные результаты согласуются с литературными данными – высокому генетическому разнообразию способствуют большие размеры и плотность популяции, при этом значительная численность особей может предотвратить инбридинг и генетический дрейф [11].
В то же время наименее полиморфной (по показаниям He, S, P, Dj) оказалась агропопуляция из г. Пожижевская. Мы предполагаем, что это может быть обусловлено происхождением популяции, для создания которой было взято небольшое количество генотипов с шешульской популяции, а также сравнительно коротким временем ее существования (~40 лет). Низкий внутрипопуляционный полиморфизм растений с г. Пожижевская, очевидно, обусловлен «эффектом основателя», результатом которого является низкий уровень генетического разнообразия по сравнению с родительской популяцией. Как и в случае с RGAP-маркерами, низкий уровень полиморфизма популяции из г. Пожижевская нами ранее показан и с помощью IRAP-анализа [3].
В целом, значения основных параметров генетического разнообразия популяций G. lutea за RGAP-маркерами были ниже по сравнению с полученными нами ранее с использованием RAPD- и ISSR-анализов [4]. Такое различие показателей можно объяснить разной интенсивностью действия отбора на участки генома, ассоциированные с использованными маркерами. Так, в случае RAPD- и ISSR-ПЦР амплифицированные продукты которых представлены преимущественно некодирующей ДНК, скорость накопления изменений является большей, чем в случае представляющих кодирующую ДНК RGAP-маркеров.
Выводы
С помощью RGAP-маркеров исследовано генетическое разнообразие пяти природных и искусственно созданной популяций G. lutea. По всем использованным показателям (He, S, P, Dj) наиболее полиморфной является популяция с гор Шешул и Павлик. Самые низкие показатели генетической гетерогенности характерны для агропопуляции с горы Пожижевская, что, вероятно, связано с ее искусственным происхождением, а также небольшим возрастом (~ 40 лет). Показано, что на различия между популяциями приходится 68 % общей генетической изменчивости, тогда как внутрипопуляционный полиморфизм составляет 32 %, что является свидетельством значительной генетической изоляции и дивергенции исследованных популяций.
Рецензенты:
Грубинко В.В., д.б.н., профессор, заведующий кафедрой общей биологии и методики обучения естественным дисциплинам Тернопольского национального педагогического университета имени Владимира Гнатюка, Министерство образования и науки Украины, г. Тернополь;
Тищенко Е.Н., д.б.н., заведующая отделом генетической инженерии Института физиологии растений и генетики НАН Украины, г. Киев.
Работа поступила в редакцию 21.03.2014.



