В связи с широким распространением инфекционных заболеваний оптимизация фармакотерапии соответствующих больных остается актуальной проблемой. В связи с признанием универсальной роли усиления процессов свободнорадикального окисления в патогенезе различных заболеваний, в т.ч. инфекционных, в качестве вспомогательной терапии больным с бактериальными инфекциями могут назначаться антиоксиданты.
Klebsiella pneumoniae – условно-патогенная бактерия семейства Enterobacteriaceae, являющаяся одним из ведущих возбудителей нозокомиальных инфекций (от 2 до 20 %). В России Klebsiella pneumoniae – третий по частоте грамотрицательный возбудитель нозокомиальных инфекций, в ряде случаев – превалирующий возбудитель (от 24,5 до 43,6 %) [2, 3].
Цель исследования – сравнительная оценка влияния антиоксидантов (аскорбиновая кислота, метилэтилпиридинол, N-ацетилцистеин) на эффективность антибактериальных средств при экспериментальном перитоните, вызванном Klebsiella pneumoniae.
Материалы и методы исследования
Исследование выполнено на 175 крысах-самцах линии Вистар в возрасте 2–3 месяцев массой 245–280 г, полученных из питомника НИИ цитологии и генетики СО РАН (г. Новосибирск). Содержание крыс соответствовало требованиям Хельсинкской декларации Всемирной медицинской ассоциации (2000 г.), Европейской конвенции «О защите позвоночных животных, используемых для экспериментальных или иных научных целей» (Страсбург, 1986 г.). Эксперимент был разделен на 5 серий в соответствии с изучаемыми антибактериальным средствами (гентамицин, ципрофлоксацин, цефтазидим, хлорамфеникол, тетрациклин).
Для каждой серии из 35 животных формировались группы (1–5) по 7 особей в каждой. Всем животным внутрибрюшинно вводилась бактериальная суспензия (2,5 усл. ед. по Мак-Фарланду, 5 мл/кг), полученная из суточной чистой культуры клинического штамма K. pneumoniae, чувствительного ко всем изучаемым антибактериальным средствам. Через 3 часа после введения животным группы № 1 (контроль) каждой серии внутрибрюшинно вводился стерильный изотонический раствор хлорида натрия, № 2 – раствор антибактериального средства, № 3 – последовательно раствор антибактериального средства и аскорбиновой кислоты, № 4 – раствор антибактериального средства и метилэтилпиридинола, № 5 – раствор антибактериального средства и N-ацетилцистеина. Дозы препаратов устанавливались в соответствии с правилами межвидового переноса на основании терапевтических доз, применяемых у человека [5]. Растворы для инъекций готовились из субстанций в асептических условиях (за исключением метилэтилпиридинола) непосредственно перед введением (табл. 1).
Через 24 часа после введения бактериальной суспензии с помощью диагностических наборов (ООО «Витал Диагностикс СПб», Россия) в качестве маркеров поражения печени определялись активность аланинаминотрансферазы и щелочной фосфатазы, маркеров поражения почек – концентрации мочевины и креатинина. Для оценки оксидантного статуса определяли плазменную концентрацию тиобарбитурат-реактивных продуктов [1] и содержание восстановленного глутатиона в эритроцитах [6], в качестве маркера воспаления – концентрацию церулоплазмина в плазме крови, проявляющего также антиоксидантные свойства [7].
Статистическую обработку результатов проводили с использованием непараметического критерия Манна–Уитни с помощью программы SigmaStat 3.5 (Systat Software, Inc., США), различия считали значимыми при P < 0,05 [4].
Таблица 1
Характеристика лекарственных средств
|
Вещество |
Производитель |
Доза, мг/кг |
|
Аскорбиновая кислота |
Panreac, Испания |
80 |
|
Метилэтилпиридинол («Эмоксипин») |
ФГУП МЭЗ, Россия |
80 |
|
N-ацетилцистеин |
Sigma-Aldrich, США |
80 |
|
Гентамицин |
AppliChem, Германия |
30 |
|
Ципрофлоксацин |
Sigma-Aldrich, США |
50 |
|
Цефтазидим |
Sigma-Aldrich, США |
120 |
|
Хлорамфеникол |
Panreac, Испания |
70 |
|
Тетрациклин |
AppliChem, Германия |
80 |
Результаты исследования и их обсуждение
На рис. 1 представлено изменение концентрации церулоплазмина в плазме крови при введении антибактериальных средств и их сочетаний с антиоксидантами. Как видно из графика, антибактериальная монотерапия статистически значимо снижает концентрацию этого маркера воспаления, что свидетельствует о реализации основного действия препаратов. Все антиоксиданты снижают соответствующий эффект гентамицина и ципрофлоксацина, N-ацетилцистеин – цефтазидима, аскорбиновая кислота – хлорамфеникола. Значимое снижение концентрации церулоплазмина наблюдается после введения тетрациклина, а также его комбинаций с антиоксидантами.
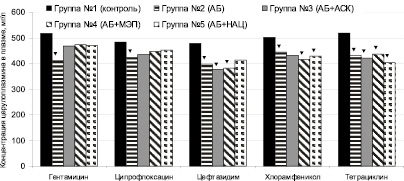
Рис. 1. Концентрация церулоплазмина в плазме в условиях химиотерапии экспериментального перитонита, вызванного Klebsiella pneumoniae (▼– значимое различие с контрольной группой серии, p < 0,05)
Поскольку патогенная роль усиления процессов свободнорадикального окисления в развитии инфекционного процесса неоспорима и демонстрируется многими исследователями, рассмотрение влияния антибактериальных средств на процессы пероксидации в условиях бактериального перитонита представляет особый интерес. С позиции угнетения размножения бактерий химиотерапевтические средства должны обладать антиоксидантным эффектом, однако таковой проявляется только у цефтазидима в режиме монотерапии, вызывающего значимое уменьшение концентрации ТБРП плазмы – продуктов перекисного окисления липидов (рис. 2). Тетрациклин во всех группах, напротив, повышает концентрацию ТБРП вне зависимости от присутствия антиоксидантов, что, вероятнее всего связано с замедлением элиминации продуктов ПОЛ вследствие почечной и печеночной дисфункции, вызываемом антибиотиком при парентеральном введении (табл. 2). Однако при этом содержание восстановленного глутатиона в эритроцитах крыс, получивших тетрациклин, остается неизменным.

Рис. 2. Концентрация ТБРП в плазме в условиях химиотерапии экспериментального перитонита, вызванного Klebsiella pneumoniae (▼– значимое различие с контрольной группой серии, p < 0,05)
Неоднозначное влияние антибактериальных средств на процессы пероксидации, по-видимому, является следствием сочетания собственной про- или антиоксидантной активности вещества со снижением процессов свободнорадикального окисления за счет торможения инфекционного процесса. В связи с этим наиболее выгодным можно считать применение антибактериального средства, обладающего собственными антиоксидантными свойствами. Таким препаратом можно считать цефтазидим – единственный антибиотик, значимо повышающий содержание восстановленного глутатиона в эритроцитах в условиях настоящего эксперимента (рис. 3).
Целесообразность включения антиоксидантов в комплексную терапию при бактериальном перитоните определяется не только изменением интенсивности процессов свободнорадикального окисления, но и возможностью снижения поражения печени и почек эндотоксинами бактерий и химиотерапевтическими средствами. Из данных табл. 2 видно, что изучаемые антиоксиданты не снижают нефротоксичность гентамицина и тетрациклина. Обращает на себя внимание снижение активности АЛТ в плазме под влиянием цефтазидима и его сочетания с N-ацетилцистеином.
Выводы
1. Целесообразность использования антиоксидантов в терапии инфекции, вызванной Klebsiella pneumoniae, определяется механизмом действия, а также антиоксидантной активностью антибактериального средства.
2. Аскорбиновая кислота, метилэтилпиридинол и N-ацетилцистеин снижают активность гентамицина и ципрофлоксацина и не изменяют интенсивность процессов пероксидации при совместном применении с указанными антибактериальными веществами.
3. Аскорбиновая кислота, метилэтилпиридинол и N-ацетилцистеин не уменьшают нефротоксическое действие гентамицина и тетрациклина.
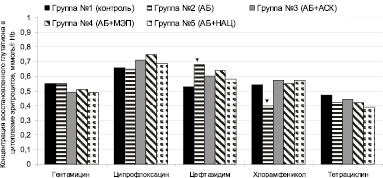
Рис. 3. Концентрация восстановленного глутатиона в цитоплазме эритроцитов в условиях химиотерапии экспериментального перитонита, вызванного Klebsiella pneumoniae (▼– значимое различие с контрольной группой серии, p < 0,05)
Таблица 2
Маркеры поражения печени и почек в условиях экспериментального перитонита
|
Группа |
АЛТ, мкмоль/(с∙л) |
ЩФ, нмоль/(с∙л) |
Мочевина, ммоль/л |
Креатинин, мкмоль/л |
|
Серия «Гентамицин» |
||||
|
1 |
2,32 (1,98; 2,56) |
1493,7 (1281,1; 1557,6) |
2,25 (1,94; 2,56) |
55,83 (49,38; 60,02) |
|
2 |
1,73 (1,71; 1,96)* |
1301,3 (1182,6; 1486,2) |
4,67 (4,48; 5,15)* |
95,64 (88,31; 105,71)* |
|
3 |
1,96 (1,76; 2,17) |
1286,3 (1209,7; 1492,2) |
4,81 (4,60; 5,39)* |
96,14 (89,50; 102,40)* |
|
4 |
2,27 (1,90; 2,31) |
1304,3 (1220,9; 1482,4) |
5,29 (4,40; 5,62)* |
98,14 (90,94; 107,59)* |
|
5 |
1,97 (1,95; 2,22) |
1430,6 (1221,7; 1522,2) |
4,81 (4,41; 5,40)* |
96,89 (86,12; 105,02)* |
|
Серия «Ципрофлоксацин» |
||||
|
1 |
1,99 (1,94; 2,40) |
1514,7 (1368,2; 1941,5) |
1,98 (1,88; 2,30) |
48,32 (46,63; 55,45) |
|
2 |
1,86 (1,73; 2,00) |
1328,4 (1287,1; 1619,2) |
1,96 (1,89; 2,29) |
45,06 (45,06; 50,20) |
|
3 |
2,25 (2,00; 2,56) |
1541,8 (1360,7; 1717,6) |
1,99 (1,86; 2,11) |
55,33 (45,56; 56,20) |
|
4 |
2,08 (1,83; 2,40) |
1325,4 (1269,8; 1757,4) |
2,23 (1,76; 2,35) |
57,08 (46,12; 57,52) |
|
5 |
2,03 (1,74; 2,25) |
1523,7 (1315,6; 1641,0) |
2,01 (1,87; 2,29) |
53,83 (47,69; 59,08) |
|
Серия «Цефтазидим» |
||||
|
1 |
1,89 (1,77; 2,25) |
1556,8 (1314,9; 1748,4) |
1,81 (1,60; 2,33) |
45,31 (43,69; 47,94) |
|
2 |
1,52 (1,25; 1,76)* |
1388,5 (1187,1; 1441,8) |
2,04 (1,96; 2,12) |
44,81 (44,19; 46,00) |
|
3 |
1,69 (1,30; 1,82) |
1403,5 (1302,1; 1492,9) |
2,27 (1,93; 2,54) |
47,57 (46,63; 49,88) |
|
4 |
1,73 (1,27; 1,75) |
1571,8 (1305,9; 1750,7) |
2,17 (1,91; 2,36) |
47,82 (46,38; 51,07) |
|
5 |
1,76 (1,21; 1,81)* |
1463,6 (1291,6; 1628,2) |
2,14 (2,08; 2,39) |
51,32 (48,57; 52,70) |
|
Серия «Хлорамфеникол» |
||||
|
1 |
2,26 (2,07; 2,35) |
1109,0 (1018,8; 1175,9) |
2,31 (1,90; 2,58) |
50,57 (48,82; 53,58) |
|
2 |
2,30 (1,90; 2,44) |
1202,2 (1142,1; 1213,4) |
2,43 (2,01; 2,52) |
52,32 (49,57; 57,71) |
|
3 |
2,32 (1,91; 2,45) |
1250,3 (1187,1; 1325,4) |
2,33 (2,23; 2,42) |
50,32 (48,88; 55,45) |
|
4 |
2,29 (2,00; 2,38) |
1232,2 (1168,4; 1321,6) |
2,28 (2,05; 2,37) |
48,57 (48,19; 50,70) |
|
5 |
2,19 (1,87; 2,35) |
1280,3 (1169,1; 1387,7) |
2,29 (1,78; 2,31) |
48,82 (45,56; 50,45) |
|
Серия «Тетрациклин» |
||||
|
1 |
2,06 (1,77; 2,28) |
1418,6 (1366,0; 1553,0) |
2,26 (1,88; 2,40) |
64,34 (61,09; 73,29) |
|
2 |
2,88 (2,64; 3,26)* |
1226,2 (1166,9; 1256,3) |
8,67 (7,68; 9,64)* |
93,63 (88,31; 105,15)* |
|
3 |
2,85 (2,44; 3,06)* |
1283,3 (1102,2; 1471,9) |
9,52 (8,84; 9,92)* |
89,38 (79,93; 102,83)* |
|
4 |
2,41 (2,09; 2,81) |
1217,2 (1135,3; 1286,3)* |
7,52 (7,19; 8,88)* |
92,13 (84,81; 103,08)* |
|
5 |
2,95 (2,17; 3,31) |
1274,3 (1109,7; 1502,0) |
8,96 (8,60; 10,10)* |
99,14 (84,24; 104,15)* |
Примечание.* – значимое различие с контрольной группой серии (p < 0,05).
Рецензенты:
Смирнов И.В., д.м.н., зав. кафедрой фармакогнозии и ботаники, ГБОУ ВПО АГМУ Минздрава России, г. Барнаул;
Галактионова Л.П., д.б.н., профессор кафедры биохимии и клинической лабораторной диагностики, ГБОУ ВПО АГМУ Минздрава России, г. Барнаул.
Работа поступила в редакцию 19.12.2013.



