Применение цитостатиков в составе различных схем полихимиотерапии позволило достичь значительного улучшения результатов лечения онкологических больных. Кроме терапевтического действия, все противоопухолевые антрациклиновые антибиотики вызывают ряд побочных эффектов, обусловленных низкой избирательностью действия, главным из которых является потенциально необратимая кумулятивная дозозависимая кардиотоксичность, которая ведет к развитию кардиомиопатии и застойной сердечной недостаточности в разные периоды после лечения [2, 7, 8, 9].
Циклофосфамид (ЦФ) – препарат, широко используемый в противоопухолевой терапии как оказывающий алкилирующее воздействие на ДНК и при трансплантации как индуктор толерантности [3, 10]. Отсутствие избирательности действия и выявляемые уро-, нефро- и кардиотоксические свойства ЦФ, его метаболитов, а также нарушения репродуктивной функции создают в ряде случаев серьезную проблему для клинического использования этого препарата [4, 11]. В таких условиях при оценке паренхиматозно-стромальных соотношений в миокарде учитывается пролиферативная активность кардиомиоцитов и морфогенез кардиосклероза на месте диффузной гибели отдельных мышечных клеток сердца. Указанные морфологические проявления кардиомиопатии лежат в основе регенераторно-пластической недостаточности миокарда, которая имеет присущие ей морфологические особенности, отличающие ее от метаболических и ишемических повреждений сердца [1]. Однако характер структурных изменений миокарда при действии цитостатических препаратов практически не изучен. Не выяснены основные типы повреждений кардиомиоцитов, не установлены возможности и типы их регенерации.
Цель исследования: изучить ультраструктурные изменения миокарда при хронической интоксикации цитостатическими препаратами.
Материал и методы исследования
Исследование выполнено на 46 половозрелых крысах-самцах массой 180–250 г на стандартном содержании и питании вивария. Крысам вводили внутрибрюшинно 1 раз в 5 дней «Циклофосфан» («Артериум», Украина) в дозе 15 мг/кг массы тела. Вторая группа – животные, которым кроме введения циклофосфана с целью коррекции эндогенной интоксикации, вводили внутрижелудочно «Карболайн» в дозе 1 г/кг массы тела. Крысам контрольной группы вводили внутрибрюшинно 0,9 % раствор натрия хлорида соответственно. На 30, 60, 90 сутки после начала эксперимента, но не менее чем через 72 часа после последней инъекции [5, 6], животных наркотизировали тиопенталом и путем декапитации проводили их эвтаназию. После декапитации и вскрытия грудной клетки проводили экстирпацию сердца. Ткань миокарда левого желудочка (ЛЖ) фиксировали в течение 30 мин в 2,5–3 % растворе глутаральдегида, изготовленного на 0,1 молярном фосфатном буфере (pH 7,2–7,4). Затем фиксированный материал лезвием разрезали на кусочки размером 0,5–1,0 мм3, промывали их в трех порциях 0,1 молярного фосфатного буфера. Полученные кусочки миокарда фиксировали в 2 % растворе тетраокиса осмия (OsO4) в течение 2 часов. Повторно материал промывали при комнатной температуре в трех порциях 0,1 молярного буфера, по 10 мин в каждой порции, с последующим обезвоживанием в серии спиртов нарастающей концентрации и абсолютном ацетоне по принятой схеме. После дегидратации кусочки миокарда заливали в смесь эпона 812 и аралдита. Полимеризацию проводили при температуре + 37 °С в течение 48 часов. Ультратонкие срезы получали на ультрамикротоме, монтировали их на сетки, контрастировали уранилацетатом и цитратом свинца по методу Рейнольдса. Препараты изучали на электронном микроскопе ПЭМ-125 К при различных увеличениях.
При проведении исследований придерживались международных принципов «Европейской конвенции о защите позвоночных животных, используемых для экспериментов и с другой научной целью» (Страсбург, 1986 г.) и национальных норм по биоэтике (І национальный конгресс по биоэтике, Киев, 2001 г.) [8].
Результаты исследования и их обсуждение
Субмикроскопические исследования миокарда левого желудочка при экспериментальном введении циклофосфана на 30 сутки эксперимента показало, что для кардиомиоцитов характерным является уменьшение размеров ядер. Они сохраняют продолговатую форму, однако их кариолемма имеет инвагинации. Перинуклеарное пространство очагово увеличено, в ядерной оболочке мало ядерных пор. В кариоплазме имеются небольшие ядрышки. Осмиофильные гетерохроматиновые участки локализованы преимущественно возле внутреннего листка ядерной оболочки. Можем наблюдать пересокращение миофибрилл, и нарушено упорядоченное расположение саркомер. На отдельных участках вставные диски сохраняют свою структурированность, а у других установлено различие десмосом с образованием увеличенных промежутков. Упорядоченное расположение митохондрий сохраняется, но часть их гипертрофированные, имеют локально просветленный матрикс и поврежденные кристы. В саркоплазме обнаруживаются вакуолеподобные структуры, образованные за счет канальцев саркоплазматической сетки.
Для гемокапилляров в этот срок эксперимента характерны широкие просветы заполненные эритроцитами, имеется отек цитоплазмы эндотелиоцитов, их просветление, повреждения органелл. Часть митохондрий измененной формы с просветленным матриксом и деструкцией крист. Пиноцитоз хорошо выражен на отдельных участках эндотелиоцитов. Базальная мембрана на отдельных участках утолщена, локально имеются участки просветления. Такое состояние стенки гемокапилляра может свидетельствовать о нарушении транскапилярного обмена.
Субмикроскопические изменения КМЦ, которые мы наблюдали при экспериментальном введении циклофосфана на 60 сутки эксперимента, имели следующий характер. В части кардиомиоцитов наблюдаются инвагинации ядра, иногда глубокие. Миофибриллы разволокненные, утолщенные. Нарушено четкое саркомерное строение, они разной величины, однако лизис миофиламентов выражен незначительно. Возле сарколеммы имеются просветленные участки саркоплазмы, отображающие ее отек. Имеются гипертрофированные митохондрии с просветленным матриксом и локально поврежденными кристами. Однако возле измененных органелл имеются небольшие и средней величины митохондрии с четко контурированными кристами.
На 90 сутки эксперимента при введении ЦФ установлено, что часть миофибрилл истончается, другие сохранившиеся с четким саркомерным строением. Некоторые из них утолщены. В светлых участках саркоплазмы, где миофибриллы были лизированы, имеются признаки репаративной регенерации с новообразованием миофибрилл или замещением дефекта фибриллярными структурами соединительной ткани. Между миофибриллами митохондрии расположены упорядоченно. Кристы относительно сохранены, имеются участки их локального повреждения. Отмечаются скопления таких органелл под сарколеммой возле участка дефекта. Наблюдаются также небольшие по размерам митохондрии, что может свидетельствовать о гиперплазии органелл.
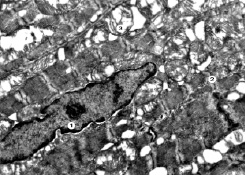
Рис. 1. Субмикроскопические изменения миокарда при экспериментальном введении ЦФ. 30 сутки эксперимента. Ядро продолговатой формы с инвагинациями кариолеммы (1), поврежденные миофибриллы (2), деструктивно изменены митохондрии (3). х 17 000
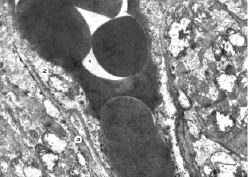
Рис. 2. Субмикроскопические изменения кровеносного капилляра. Миокард животного при экспериментальном введении ЦФ на 30 сутки эксперимента. Широкий просвет гемокапилляра с форменными элементами крови (1), отечная цитоплазма эндотелиоцита (2), базальная мембрана (3). х14 000
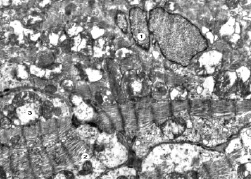
Рис. 3. Субмикроскопические изменения миокарда при экспериментальном введении ЦФ. 60 сутки эксперимента. Ядро с инвагинациями кариолеммы (1), поврежденные миофибриллы (2), деструктивно изменены митохондрии (3). х14 000
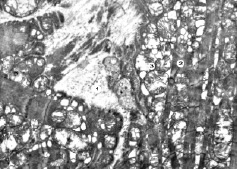
Рис. 4. Субмикроскопические изменения миокарда при экспериментальном введении ЦФ. 90 сутки эксперимента. Саркоплазма (1), поврежденные миофибриллы (2), деструктивно изменены митохондрии (3). х15 000
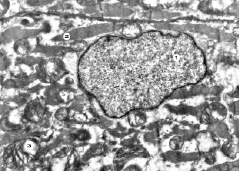
Рис. 5. Субмикроскопические изменения миокарда при экспериментальном введении ЦФ и КЛ. 30 сутки эксперимента. Ядро с неглубокими инвагинациями кариолеммы (1), миофибриллы (2), митохондрии (3). х14 000
На 30 сутки эксперимента при введении циклофосфана в сочетании с введением «Карболайна» наблюдалась лучшая сохранность структурных компонентов кардиомиоцитов по сравнению с группой животных, которым вводили только цитостатик.
Ядра имеют овальную форму с незначительными инвагинациями кариолеммы, четкими контурами их мембран. В кариоплазме преобладает эухроматин и много рибосомальных гранул. Установлены изменения миофибрилл, но они не столь значительны, как наблюдалось в предыдущих исследованиях. Сохраняется их саркомерное строение, менее выражено разволокнение миофиламентов. Часть митохондрий с признаками деструкции, об этом свидетельствует просветленный матрикс и очагово поврежденные кристы. Четко контурированы сарколеммы, отечные явления менее выразительные.
Кровеносные капилляры в этот и последующие сроки эксперимента имеют умеренные просветы, в которых расположены эритроциты преимущественно в один ряд. Цитоплазма эндотелия имеет просветленные утолщенные участки, однако на значительных участках она сохранена и не утолщена, хорошо выражен пиноцитоз. Базальная мембрана относительно равномерна, в отдельных местах утолщена. Такое состояние стенки гемокапилляров свидетельствует об удовлетворительном транскапиллярном обмене.
В условиях совместного введения циклофосфана и «Карболайна» на 60 сутки эксперимента субмикроскопически отмечается сохранность миофибрилл, упорядоченное расположение в них саркомеров. Участки их чрезмерного сокращения наблюдаются не часто. Хорошо сохранены вставные диски, в них четко выражены десмосомальные контакты. Имеется упорядоченное расположение митохондрий ленточками между миофибриллами, но часть их гипертрофирована с очагово просветленным матриксом и умеренной деструкцией крист. Однако имеющиеся органеллы – с четкими плотно упакованными кристами.
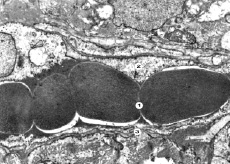
Рис. 6. Субмикроскопические изменения кровеносного капилляра. Миокард животного при экспериментальном введении ЦФ и КЛ на 30 сутки эксперимента. Просвет капилляра (1), цитоплазма эндотелиоцита (2), базальная мембрана (3). х9 000
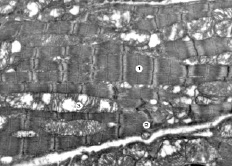
Рис. 7. Субмикроскопические изменения миокарда при экспериментальном введении ЦФ и КЛ. 60 сутки эксперимента. Миофибриллы (1), вставной диск (2), гипертрофированная митохондрия (3). х17 000
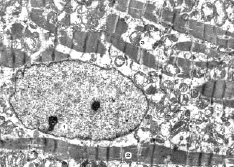
Рис. 8. Субмикроскопические изменения миокарда при экспериментальном введении ЦФ и КЛ. 90 сутки эксперимента. Ядро с ядрышками (1), миофибриллы (2), митохондрии (3). х9 000
На 90 сутки эксперимента при совместном введении ЦФ и «Карболайна» отмечаются кардиомиоциты, в которых ядра имеют присущее им строение, продолговатые овальной формы, с четкими контурами кариолеммы и небольшими инвагинациями. Их кариоплазма электронносветлая, в ней преобладает эухроматин, имеются одно или два ядрышка и рибосомальные гранулы. Сократительный аппарат умеренно изменен. Большинство миофибрилл имеют четкое саркомерное строение, сохраненные миофиламенты, но на отдельных участках наблюдаются их разволокнение и повреждение. Отмечаются перинуклеарные скопления митохондрий, имеющих различные размеры, отображающие гипертрофию и гиперплазию таких органелл. Между миофибриллами эти органеллы расположены относительно упорядоченно, они имеют меньшую степень поражения.
Выводы
Таким образом, при введении цитостатика наблюдаются изменения, характерные для регенераторно-пластической недостаточности кардиомиоцитов, а именно инвагинации ядра, иногда глубокие, нарушение архитектоники и дезорганизация миофибрилл, часть из них истончается, другие сохранившиеся с отчетливым саркомерным строением, небольшие по размерам митохондрии. При ультрамикроскопическом исследовании кардиомиоцитов установлено, что при совместном введении ЦФ и «Карболайна» оказывается положительное влияние применения последнего на структурные компоненты КМЦ на фоне улучшения микроциркуляции. Активизируются ядра КМЦ, лучше сохранен сократительный аппарат и структура миофибрилл, отмечается хорошая сохранность митохондрий, которая отражает энергообеспечение процесса сокращения.
Рецензенты:
Гнатюк М.С., д.м.н., профессор, заведующий кафедрой оперативной хирургии и топографической анатомии ГВУЗ «Тернопольский государственный медицинский университет имени И.Я. Горбачевского», г. Тернополь;
Герасимюк И.Е., д.м.н., профессор, заведующий кафедрой нормальной анатомии ГВУЗ «Тернопольский государственный медицинский университет имени И.Я. Горбачевского», г. Тернополь.
Работа поступила в редакцию 17.10.2013.



