Диагностика, лечение и профилактика атеросклероза остаются важнейшей задачей современной медицины, от решения которой во многом зависит успех борьбы с такими заболеваниями, как инфаркт, инсульт, критическая ишемия нижних конечностей [1, 4, 5].
Введение в клиническую практику технологий локальной реконструкции сосудистой стенки, пораженной атеросклерозом [2, 3, 6, 7], несомненно, внесет весомый вклад в борьбу с этим тяжелым недугом. В качестве средств, способных позитивно воздействовать на интиму и подинтимное пространство крупных артерий, предложены различные варианты биополимеров.
Цель исследования – морфометрическая оценка воздействия имплантированных полисахаридных биополимеров на стенку артерий при ранних признаках экспериментальной хронической ишемии нижних конечностей.
Материалы и методы исследования
В исследовании использованы 48 белых беспородных лабораторных крыс мужского пола, массой 250 ± 15 г, животные были разделены на 8 групп: 1-я группа – интактные животные; 2-я группа – животные, получавшие только холестериновую диету [8, 9, 10] (30 % растительного масла, 2,4 % холестерина, 0,12 % 6-метил-2-тиоурацила, 0,06 % холевой кислоты, 200000 ед. витамина Д2). С третьей по восьмую группы – животным, получавшим холестериновую диету, в околососудистый фасциальный футляр магистральных артерий левой задней конечности с помощью инъекций инфильтрировали один из шести образцов биополимера: 1 % гель хитозана хлоргидрата; 1 % гель хитозана аскорбата; 1 % гель комплекса аскорбата хитозана и альгината натрия; 1 % гель β1,4 D–глюкопиранозин–N–метил–сульфатил натрия; 1 % раствор каррагинана; 1 % раствор полиэтиленгликоля.
Подопытные животные были выведены из эксперимента на 60-е сутки. У всех групп был отпрепарирован комплекс мягких тканей бедра и голени обеих конечностей, включающий магистральный сосудисто-нервный пучок, для выполнения гистологических исследований. Морфометрическое исследование полученных срезов сосудов проводилось при помощи программы «Image Tool». Оценивались следующие морфометрические параметры: диаметр артерии – в мм; площадь средней оболочки бедренной артерии (медии) – в мм2; толщина медии и диаметр просвета артерии– в мкм; отношение толщины средней оболочки бедренной артерии к диаметру просвета; коэффициент гладких миоцитов субинтимальной области (вычислялся как отношение численной плотности субинтимальных миоцитов к площади средней оболочки бедренной артерии); число сосудов в паравазальном пространстве, исключая крупные магистральные сосуды; наличие ксантомных клеток оценивалось в формате дихотомической переменной (да, нет).
Результаты исследования и их обсуждение
Атеросклеротическая диета в течение 60 дней вызывала у крыс гиперлипидемию, о чем свидетельствует увеличение уровней содержания общих липидов в 2,5 раза (13,15 ± 0,04 г/л против 5,13 ± 0,02 г/л у интактных животных), триглицеридов в 2 раза (2,66 ± 0,01 ммоль/л против 1,10 ± 0,01 ммоль/л у интактных животных) и НЭЖК в 26 раз (1,75 ± 0,01 ммоль/л против 0,06 ± 0,01 ммоль/л соответственно). Уровень общих липидов (ОЛ) в стенке бедренной артерии интактных крыс (2,68 ± 0,01 г/л) достоверно меньше (Р < 0,001), чем у животных, получавших в течение 60 суток холестериновую диету (8,15 ± 0,06 г/л). Во всех группах крыс, которым имплантировались биополимеры (с третьей по восьмую), отмечается снижение уровня ОЛ в стенке опытной левой бедренной артерии по сравнению с группой животных, получавших ХД и не подвергнутых имплантации гелевых полимерных конструкций. Существенное падение уровня общих липидов (ОЛ) в тканях стенки бедренной артерии в опытной конечности (биополимерная «рубашка» в околососудистом пространстве) по сравнению с контрольной (биополимер не вводился) наблюдалось при имплантации 1 % геля хитозана хлоргидрата, 1 % геля хитозана аскорбата и 1 % сульфатированного водорастворимого хитозана. Важным результатом имплантации указанных биополимеров следует считать факт достижения уровня ОЛ в тканях стенки бедренной артерии опытных конечностей до уровня интактных животных (1-я группа). Следовательно, эти полимеры при длительном нахождении в параадвентициальном пространстве левой бедренной артерии создают условия для существенно более низкого уровня фракций липидов в стенке сосуда по сравнению с аналогичным сегментом контрольной конечности. Этот результат указывает на признаки реконструкции сосудистой стенки в месте дислокации имплантанта. Анализ показывает, что содержание триглицеридов (ТГ) в тканях стенки бедренной артерии интактных животных достоверно меньше (P < 0,001), чем у животных, получавших холестериновую диету (ХД). Уровень ТГ в правой бедренной артерии (контрольная конечность) не отличался от показателей 2-й группы (животные, получавшие ХД) и составлял соответственно 2,14 ± 0,25 и 2,43 ± 0,84 ммоль/л, но существенно был выше (Р < 0,001) значений у интактных животных – 0,95 ± 0,03 ммоль/л. Таким образом, имплантация биополимера в левую заднюю конечность не оказывает влияния на уровень ТГ в противоположной конечности. При имплантации 1 % геля хитозана хлоргидрата, 1 % геля хитозана аскорбата, 1 % сульфатированного водорастворимого хитозана и 1 % комплексного геля аскорбата хитозана-альгината натрия в околососудистое пространство левой бедренной артерии отмечалось снижение уровня ТГ в тканях артериальной стенки по сравнению с контрольной конечностью, в среднем, в 2,4 раза. Уровни ОЛ в стенке подвздошной артерии контрольной и опытной конечностей были достоверно неразличимы у животных с 4 по 8 группы (Р > 0,05). Однако при имплантации 1 % геля хитозана хлоргидрата в паравазальное пространство левой бедренной артерии (3-я группа) происходило уменьшение уровня ОЛ в стенке подвздошной артерии (соседний с бедренной артерией сегмент) по сравнению с контрольной конечностью (Р < 0,001). Эта находка указывает на факт непосредственной близости расположения имплантированного полисахаридного полимера к левому сегменту наружной подвздошной артерии. Однако в целом слабое влияние имплантатов на соседний артериальный сегмент указывает на строго локальный эффект морфологической реконструкции.
Микроскопический анализ артериальной стенки контрольных конечностей крыс, находящихся в течение 60-ти дней на холестериновой диете, указывает на наличие классических липидных фиброзных бляшек, выступающих в просвет сосудов (рис. 1, а). В образцах средних третей левых и правых бедренных артерий выявляется отек различной степени выраженности (от слабо выраженного до выраженного), который оценивался на основании наличия признаков разобщения волокнистого компонента внутренней эластической мембраны (рис. 1, б). В интиме бедренных артерий (между внутренней эластической мембраной и эндотелиоцитами) выявляются ксантомные клетки-макрофаги с наличием липидов в цитоплазме (рис. 2).
а 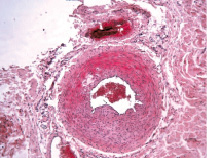 б
б 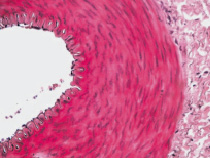
Рис. 1. Гистологический препарат бедренной артерии крысы, содержавшейся в течение 60-ти суток на холестериновой диете. Окраска гематоксилином и эозином: а – классическая липидная бляшка в стенке артерии. Х 100; б – увеличение численной плотности гладких миоцитов в стенке правой бедренной артерии крысы, получавшей ХД в течение 60-ти суток. Х 200
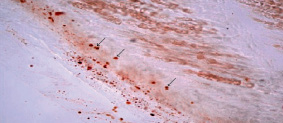
Рис. 2. Наличие ксантомных клеток в субинтимальном слое бедренной артерии крысы, получавшей холестериновую диету в течение 60-ти суток. Окраска судан III. Х 400
В препаратах с введением 1 % сульфатированного водорастворимого хитозана гистологическая картина в стенке левой бедренной артерии с наличием липидной фиброзной бляшки существенно отличается от таковой в артериях правых конечностей. Параллельно с процессами биологической деградации полимера отмечается резорбция компонентов бляшки под воздействием макрофагов, индуцированных имплантированным полимером (рис. 3, а). Численная плотность гладких миоцитов субинтимально и в медии снижается, липидная фиброзная бляшка уплотняется и уменьшается в размере (рис. 3, б). В паравазальном пространстве отмечается выраженная васкуляризация в средней трети длины левой бедренной артерии по сравнению с правой (рис. 4).
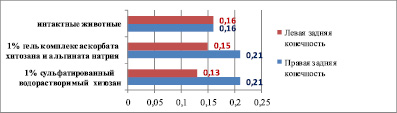
Результаты морфометрии стенок артерий демонстрируют, что площадь медии средней трети бедренной артерии у интактных животных меньше (0,16 ± 0,01 мм2), чем площадь медии в средней трети длины бедренной артерии (биополимер не вводился) у крыс, получавших холестериновую диету в течение 60 суток (0,21 ± 0,02 мм2, р < 0,05), что свидетельствует о прогрессировании атерогенного процесса. При сравнении площади медии в средней трети длины левой бедренной артерии (вокруг которой находился биополимер) и правой (биополимер не вводился) выявлено, что площадь медии уменьшается при введении в паравазальное пространство 1 % сульфатированного водорастворимого хитозана (0,13 ± 0,01 мм2) и при введении 1 % геля комплекса аскорбата хитозана и альгината натрия (0,15 ± 0,02 мм2) по сравнению с правой бедренной артерией (0,21 ± 0,02 мм2, р < 0,05) (табл. 1).
а 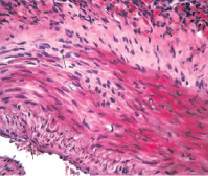 б
б 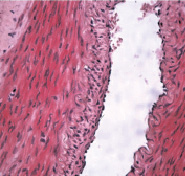
Рис. 3. Гистологический препарат бедренной артерии крысы, содержавшейся в течение 60-ти суток на холестериновой диете в условиях имплантации 1 % геля сульфатированного водорастворимого хитозана. Окраска гематоксилином и эозином: а – Х 300; б – Х 200
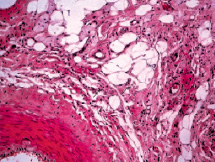
Рис. 4. Выраженная васкуляризация в паравазальном пространстве левой бедренной артерии крыс, получавших ХД в течение 60-ти суток, в условиях имплантации 1 % геля сульфатированного водорастворимого хитозана. Окраска гематоксилином и эозином. Х 200
Таблица 1
Площадь поперечного сечения медии средней трети бедренной артерии (мм2) у интактных животных и на 20-е сутки после имплантации различных биополимеров (60-е сутки холестериновой диеты)
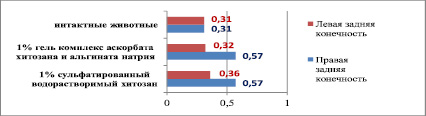
Отношение толщины медии к диаметру просвета сосуда в средней трети длины бедренной артерии интактных животных меньше, чем в средней трети длины правой бедренной артерии и составляет соответственно 0,31 ± 0,10 против 0,57 ± 0,08 (р < 0,05). Таким образом, холестериновая диета в течение 60 суток приводит к увеличению толщины медии и уменьшению диаметра просвета сосуда, общий диаметр сосуда остается неизменным. Следует отметить, что при имплантации 1 % сульфатированного водорастворимого хитозана это отношение уменьшается в левой конечности по сравнению с показателями правой бедренной артерии (биополимер не вводился) и составляет соответственно 0,36 ± 0,06 против 0,57 ± 0,08 (р < 0,05). Такое же уменьшение вышеуказанного отношения в левой конечности происходит при имплантации 1 % геля комплекса аскорбата хитозана и альгината натрия (0,32 ± 0,08) по сравнению с правой бедренной артерией (0,57 ± 0,08) (р < 0,05) (табл. 2).
Таблица 2
Отношение толщины медии к диаметру просвета в средней трети длины бедренной артерии у интактных животных и на 20-е сутки после имплантации различных биополимеров (60-е сутки холестериновой диеты)
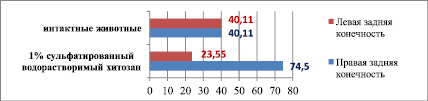
Коэффициент субинтимальных миоцитов верхней трети правой бедренной артерии крыс, получавших в течение 60 суток холестериновую диету, больше, чем у крыс, содержавшихся на стандартном рационе вивария и составляет соответственно 74,50 ± 8,06 против 40,11 ± 13,81, (р < 0,05). Вышеуказанный коэффициент уменьшается у группы животных, которым в области средней трети левой бедренной артерии производилась имплантация 1 % сульфатированного водорастворимого хитозана (23,55 ± 1,68) по сравнению с правой конечностью (74,50 ± 8,06), (р < 0,05) (табл. 3).
Таблица 3
Коэффициент субинтимальных миоцитов верхней трети бедренной артерии у интактных животных и на 20-е сутки после имплантации различных биополимеров (60-е сутки холестериновой диеты)
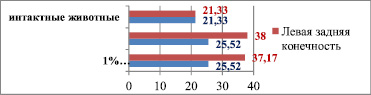
На 60-е сутки холестериновой диеты количество сосудов паравазального пространства правой бедренной артерии крыс соответствующих групп и интактных животных статистически не различается и составляет 25,52 ± 5,67 против 21,33 ± 3,42 соответственно (р > 0,05). На 20-е сутки после имплантации 1 % геля аскорбата хитозана и 1 % сульфатированного водорастворимого хитозана происходит увеличение количества сосудов паравазального пространства (38 ± 4,13 и 37,17 ± 6,59) по сравнению с правой бедренной артерией (25,52 ± 3,63) (р < 0,05) (табл. 4).
Представленные результаты свидетельствуют о значимом влиянии сульфатированного водорастворимого хитозана на уменьшение коэффициента субинтимальных миоцитов и увеличение числа сосудов паравазального пространства, что можно расценивать как антиатерогенный эффект и формирование механизма терапевтического ангиогенеза.
Таблица 4
Сосуды паравазального пространства в средней трети длины бедренной артерии у интактных животных и на 20-е сутки после имплантации различных биополимеров (60-е сутки холестериновой диеты)
Выводы
Хроническая холестериновая диета у экспериментальных крыс является адекватной моделью формирования ранних признаков атерогенного воспаления в стенках магистральных сосудов конечностей. Модельное атерогенное воспаление у экспериментальных животных вызывает выраженный отек интимы в виде разобщения волокнистого компонента внутренней эластической мембраны, появление ксантомных клеток, пролиферацию гладких миоцитов субинтимально и в медии с неравномерным её утолщением и формированием типичной липидной («мягкой») бляшки, покрытой фиброзной оболочкой, приводящие к уменьшению диаметра просвета сосуда. Имплантация ряда гелевых форм биополимеров (хитозан аскорбат, хитозан сульфатированный, хитозан хлоргидрат) со свойствами поликатионных или полианионных полисахаридов способна создавать в ограниченных сегментах стенок артериальных сосудов более низкий (а в ряде случаев, и соответствующий норме) уровень липидных фракций. С позиции ранней профилактики или раннего лечения сосудистых поражений при атеросклерозе у человека эти находки являются весьма важной составляющей, поскольку анализ прицельной перестройки сосудистой стенки при атеросклерозе с использованием известных методов лечения отражен явно недостаточно в научных публикациях. Имплантация в фасциальное ложе магистральных артерий крыс кислых протонированных форм хитозана, а также его сульфатированной формы демонстрирует локальное восстановление толщины среднего слоя на 29–38 %, снижая отношение толщины медии к диаметру просвета сосуда на 37–44 %. Такой эффект имеет место и в вышележащем сегменте магистрального сосуда. Дислокация в паравазальном пространстве сульфатированной формы хитозана в течение 20 суток обеспечивает снижение коэффициента субинтимальных миоцитов в среднем сегменте артерии на 27 %, усиливая эффект реконструкции в верхнем сегменте сосуда на 68 %. Введение в паравазальное пространство магистральной артерии гелевой формы сульфатированного хитозана и кислых протонированных его форм стимулирует новообразование микрососудистого ложа на месте резорбции полимеров, увеличивая число новых сосудов у крыс на 22–49 %. Более высокий эффект терапевтического ангиогенеза ясно прослеживается и при имплантации хитозановых конструкций в ткани интактного животного, составляя прирост через 30 дней постимплантационного периода 85 %.
Рецензенты:
Сухоруков А.М., д.м.н., профессор, НИИ медицинских проблем Севера СО РАМН, г. Красноярск;
Зыкова Л.Д., д.м.н., профессор кафедры патологической анатомии, ГБОУ ВПО «КрасГМУ им. проф. В.Ф. Войно-Ясенецкого», г. Красноярск.
Работа поступила в редакцию 30.05.2013.



