Синапсис хромосом является одним из ключевых моментов мейотического процесса. Именно благодаря ему происходит кроссинговер между гомологами, редукция числа хромосом и их перераспределение между дочерними клетками в мейозе I. При асинаптическом мейозе нарушается конъюгация хромосом со всеми вытекающими от сюда последствиями. В цитогенетической практике было принято различать два понятия: «асинапсис» и «десинапсис» [1]. Однако из-за отсутствия возможности осуществления подобного рода дифференциации часто наблюдается путаница в использовании данных терминов. Поэтому, пользуясь рекомендацией Soost R.K. [10], целесообразно в дальнейшем при описании экспериментального материала использовать понятие «асинапсис».
Изучение генетического контроля мейотических признаков существенным образом затрудняется тем, что по многим из них в пределах вида отсутствует аллелизм по локусам их определяющим. В этой области большие успехи были достигнуты при использовании мутантных форм [2]. Однако в ходе проводимых нами цитогенетических исследований был выявлен коммерческий сорт яровой мягкой пшеницы, у которого конъюгация хромосом определяется геном, не аллельным базисному гену рода Triticum.
Материал и методы исследования
В течение многих лет нами проводилось изучение формообразовательного процесса у межвидовых гибридов Triticumaestivum L. xTriticumdurum Desf. При этом использовались самые различные сорта яровой мягкой и твердой пшениц. Цитологическую идентификацию растений осуществляли на гибридных популяциях второго поколения (F2). Закладку полевых опытов проводили по пару, в оптимальные сроки с площадью питания растений 10×20 см. По каждой комбинации высевали от 200 до 300 гибридных зерен F2. В межфазный период выход в трубку – колошение осуществляли фиксацию микроспороцитов. Для этого с каждого растения брали по одному колосу. В качестве ядерного фиксатора использовали смесь Ньюкомера [5]. Цитологический анализ мейоза проводили с помощью светового микроскопа МБИ-3 при увеличении 20×10. Микрофотосъемку осуществляли с помощью микроскопа МБИ-11 и микрофотонасадки МФН-12У4.2 при увеличении 60×10. Полученные экспериментальные данные обрабатывали математически по хи-квадрат [3].
Результаты исследования и их обсуждение
В ходе проводимых цитологических исследований было проанализировано 15 гибридных комбинаций. По 12 из них мейоз проходил относительно нормально, без особых отклонений. При этом существенных сортовых различий характера расщепления популяций по количественному составу хромосом не обнаружено. Согласно результатам проведенных исследований, в F2 преобладали формы, имеющие в метафазе I 14 бивалентов и от 0 до 7 унивалентов (> 60 %). По мере увеличения уровня плоидности генотипа частота их встречаемости снижалась. Из эуплоидных форм чаще выщеплялись 28-хромосомные, чем 42-хромосомные. В процентном отношение это составило 8,49 и 0,51 % соответственно. Характерно, что во всех случаях отсутствовали растения, которые в метафазе I имели бы от 16 до 19 бивалентов без унивалентов, хотя по уровню плоидности одного гаплоидного ряда (16’ + 1’, 16′ + 2′, 17′ + 1′ и т.д.) такие формы появлялись достаточно часто.
Совершенно неожиданным явилось выщепление растений с асинаптическим мейозом в гибридных комбинациях, где в качестве материнского родителя использовался коммерческий сорт яровой мягкой пшеницы Омская 36 (табл. 1).
Таблица 1
Частота выщепления растений с асинаптическим мейозом у межвидовх гибридов F2 (T. aestivum xT. durum)
|
Исходные родители |
Саратовская золотистая |
Ангел |
Омская янтарная |
Омский кристалл |
||||
|
Всего растений |
Асинаптических, % |
Всего растений |
Асинаптических, % |
Всего растений |
Асинаптических, % |
Всего растений |
Асинаптических, % |
|
|
Памяти Азиева |
79 |
0 |
74 |
0 |
||||
|
ДИАС 2 |
93 |
0 |
89 |
0 |
||||
|
Эр. 59 |
95 |
0 |
88 |
0 |
||||
|
Ом. 37 |
57 |
0 |
61 |
0 |
66 |
0 |
||
|
Линия Г695/01 |
41 |
0 |
37 |
0 |
43 |
0 |
||
|
Омская 36 |
139 |
13,67 |
105 |
15,24 |
56 |
16,07 |
||
По результатам цитологического анализа, в метафазе I и диакинезе вместо бивалентов наблюдались униваленты (рис. 1). Причем общее количество хромосом у растений с асинаптическим мейозом варьировалось от 28 до 35.
а 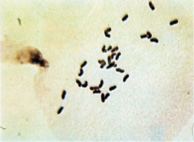 б
б 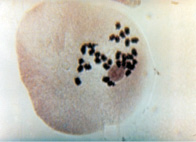
Рис. 1. Проявление асинаптического мейоза на стадии метафазы I (а); профазыI (б)
Фенотипические различия растений с нарушенным мейозом определялись в общем диапазоне варьирования признаков у межвидовых гибридов, которые были обусловлены в основном цитогенетическими факторами (рис. 2). Соответственно все растения с асинаптическим мейозом оказались стерильными.

Рис. 2. Колосья растений межвидовых гибридов F2 с асинаптическим мейозом:1 – мягкая пшеница Омская 36; 2 – 10 – межвидовые гибриды с конфигурацией метафазы I: 2–6 – 28′, 7 – 29′, 8 – 30′, 9 – 31′, 10 – 32′, 11 – сорт твердой яровой пшеницы Омский кристалл
Статистический анализ полученных экспериментальных данных показал, что по всем трем критическим гибридным комбинациям наблюдалось дигенное расщепление (табл. 3). При этом фактическое соотношение растений с нормальным мейозом и асинаптическим оказалось близким к теоретически ожидаемому соотношению 13:3 (табл. 2).
Таблица 2
Характер расщепления популяции межвидовых гибридов F2 (T. aestivumxT. durum) по признаку проявления асинаптического мейоза
|
Гибридная комбинация |
Фактическое расщепление |
Значение хи-квадрат при теоретически ожидаемом расщеплении |
||
|
3:1 |
15:1 |
13:3 |
||
|
Ом. 36 × Ангел |
120 : 19 |
9,74хх |
12,89хх |
2,35 |
|
Ом. 36. × Ом. янтарная |
89 : 16 |
5,33х |
14,48хх |
0,85 |
|
Ом. 36 × Ом. кристалл |
47 : 9 |
2,39 |
9,22хх |
0,26 |
Примечание. Отклонение от теоретически ожидаемого расщепления достоверно при х Р ≤ 0,05; хх Р ≤ 0,01.
Отклонение фактического расщепления (13:3) от теоретически ожидаемого 15:1 могло быть получено в данном случае при неодинаковой экспрессивности генов, когда один из них, будучи в моногетерозиготном состоянии, не мог обеспечить нормальное прохождение мейоза.
Как уже отмечалось выше, аномалии, связанные с нарушениями синапсиса, обычно обусловлены различного рода мутациями мейотических генов [1, 2]. Для исключения такой возможности в данном случае был проведен цитологический анализ метафазы I у сорта Омская 36. В качестве контроля использован сорт яровой мягкой пшеницы Мильтурум 553, который не вызывал подобного рода отклонения при скрещивании его с другими сортами пшеницы (табл. 3).
Как видно из табл. 3, анализируемый сорт обладал достаточно стабильным прохождением мейоза. Омская 36 уступала Мильтурум 553 по количеству кольцевых бивалентов на клетку, но превосходила по числу хиазм на бивалент. Полученные экспериментальные данные показывают, что сорт Омская 36 обладает достаточно эффективным геном детерминации синапсиса хромосом, который идентичен по своему действию аналогичному базисному гену рода Triticum.Очевидно, при создании рассматриваемого сорта произошла транслокация, в результате которой базисный ген, контролирующий синапсис гомологичных хромосом, был перемещен с одной хромосомы на другую. Так как наличие растений с асинаптическим мейозом наблюдалось при гемизиготном состоянии всех хромосом генома D, есть основания полагать, что обмен участками между хромосомами произошел в пределах двух геномов – А и В. Возможность подобного рода хромосомных перестроек в пределах трех вышеперечисленных анализируемых сортов твердой пшеницы исключается. Из табл. 2 видно, что при скрещивании одного из них (сорт Ангел) с другими сортами мягкой пшеницы в F2 отсутствовали растения с асинаптическим мейозом.
Таблица 3
Конъюгация хромосом у сортов яровой мягкой пшеницы
|
Сорт |
Проанализировано клеток |
Количества бивалентов на клетку |
Число хиазм на бивалент |
|
|
кольцевых |
палочковидных |
|||
|
Омская 36 |
78 |
19,60 |
1,40 |
2,008 |
|
Мильтурум 553 |
162 |
20,22 |
0,78 |
1,998 |
|
t |
22,57ххх |
22,57xxx |
2,43x |
|
Примечание. Различия достоверны при х Р ≤ 0,05; xxx P ≤ 0,001.
Нарушение синапсиса гомологичных хромосом может быть вызвано различными генетическими факторами [6]. Их конъюгация является многоступенчатым процессом, включающим ряд последовательных событий. К ним относятся распознавание, выравнивание, спаривание, синапсис с формированием синаптонемального комплекса (СК) и образование хиазм [6, 7, 9]. Однако согласно ранее предложенной концепции «разводящих нитей» всему этому предшествует коориентация хромосом, которая осуществляется зоной исходного полюса [4]. В качестве последней могут быть митотический центр, определенный участок оболочки ядра или иное структурное образование [8]. На основании результатов анализа характера поведения унивалента в анафазе I мейоза у полной серии моносомных линий сорта Мильтурум 553 было показано, что при смене ориентации точек фиксации центромер в зоне исходного полюса относительно линии ее потенциального деления оказывается задействованным только один гаплоидный набор хромосом. В это время их гомологи сохраняют свою прежнюю (митотическую) ориентацию. Подобного рода изменения приводят в соответствие взаимное расположение гомологичных хромосом, после которого начинаются все остальные вышеперечисленные мейотические процессы конъюгации. При нарушениях коориентации, когда сегрегацией зоны исходного полюса оказываются задействованными оба гомолога или они остаются в прежнем митотическом положении синапсис хромосом будет нарушен, так как их гомологи не были сориентированы в пространстве.
Цитологический анализ метафазы I мейоза у межвидовых гибридов с нарушениями синапсиа хромосом показал, что среди аномальных растений наблюдались генотипы, у которых наряду с унивалентами присутствовали и биваленты (рис. 3).
а 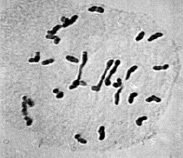 б
б 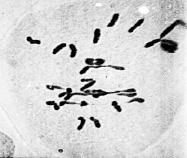
Рис. 3. Метафаза I межвидовых гибридов с унивалентами и 4 палочковидными бивалентами (а); с унивалентами, 4 палочковидными и 2 кольцевыми бивалентами (б)
По данным цитологического анализа количество бивалентов на клетку варьировало от 0 до 5 и более. При этом наблюдались как палочковидные биваленты (рис. 3), так и кольцевые (рис. 3, б). Данное обстоятельство дает основание считать, что у растений с асинаптическим мейозом формирование синаптонемальный комплекса не нарушено и его образование определялось степенью соответствия взаимного расположения плеч гомологичных хромосом. По тем парам хромосом, где коориентация центромер проходила нормально, формировались биваленты, а там, где при коориентации центромер оказывались задействованы полюсной детерминацией оба гомолога либо они в это время оставались в прежней митотической ориентации вместо бивалентов наблюдались в метафазе I униваленты.
Заключение
Результаты проведенных исследований показали, что коммерческий сорт яровой мягкой пшеницы Омская 36 имеет ген, контролирующий синапсис гомологичных хромосом, который не аллелен базисному гену рода Triticum. Его происхождение может быть связано с транслокацией, произошедшей между хромосомами геномов А и В. Сравнительный цитологический анализ метафазы Iмейоза показал, что по своей эффективности он не уступает базисному гену. Есть основания считать, что их функция связана с детерминацией коориентации хромосом при переходе от митоза к мейозу. В связи с этим локусы двух анализируемых генов предлагается обозначить символами Coor 1 и Coor 2 (co-orientation) соответственно. В настоящее время проводятся работы по хромосомной локализации данных генов. Однако проводимые исследования нуждаются в материальной поддержке.
Автор выражает благодарность депутату Законодательного Собрания Омской области Веретено Владимиру Константиновичу и АТПП «Группа «ОША» за оказанную помощь в выполнении экспериментальной части представленной работы.
Рецензенты:
Плотникова Л.Я., д.б.н., профессор кафедры селекции, генетики и физиологии растений, ОмГАУ, г. Омск;
Шаманин В.П., д.с.-х.н., академик РАЕ. Профессор кафедры селекции, генетики и физиологии растений, ОмГАУ, г. Омск.
Работа поступила в редакцию 22.04.2013.



