В процессе беременности в материнском организме возникает комплекс морфофункциональных изменений, охватывающий функции всех его систем и органов. Сформировавшиеся изменения носят компенсаторно-приспособительный характер и создают условия для внутриутробного развития плода и подготовки материнского организма к предстоящим родам [2].
В последние 10–15 лет в биомедицинской практике широко используются золотые наночастицы (ЗНЧ), применяемые в диагностике, направленном транспорте лекарств, оптической визуализации клеточных структур, фототермической и фотодинамической терапии и т.д. [1, 5]. В отечественной и зарубежной литературе в настоящее время активно изучаются биологические особенности воздействия золотых наночастиц на организм животных и человека. Однако малоизученным остается вопрос о влиянии ЗНЧ на особенности морфологических реакций компенсаторно-приспособительного характера внутренних органов животных во время беременности. В пренатальный период важнейшими факторами, воздействующими на развивающийся организм, являются влияния со стороны материнского организма. Пренатальный период как наиболее чувствительный не только для плода, но и для материнского организма, предоставляет возможность для коррекции и управления онтогенезом.
Целью исследования явилось изучение морфологических реакций внутренних органов беременных белых крыс при парентеральном введении золотых наночастиц (ЗНЧ) диаметром 5 и 30 нм.
Материал и методы исследования
Эксперимент был проведен на беременных самках белых беспородных лабораторных крыс, которым в хвостовую вену на II стадии становления гемохориальной плаценты (10 день гестации) вводили 1,5 мл суспензии ЗНЧ (концентрация 0,8 мг(Au)/кг животного) диаметром 5 и 30 нм двукратно через сутки. ЗНЧ были синтезированы цитратным восстановлением HAuCl4 по методу Фрэнса [1], затем их поверхность была функционализована тиолированными молекулами полиэтиленгликоля (PEG-SH, Nektar, USA) для обеспечения стабильности ЗНЧ в кровотоке и их биодоступности [5]. Средний размер частиц определяли на электронном микроскопе Libra-120 (Carl Zeiss, Germany). Контрольной группе беременных самок вводили физиологический раствор аналогичного объема по описанной схеме. Через сутки после второго введения ЗНЧ или физиологического раствора животных выводили из эксперимента под хлороформным наркозом. Все эксперименты, уход и содержание осуществлялись в соответствии с Директивой № 63 от 22 сентября 2010 года Президиума и Парламента Европы «О защите животных, используемых для научных исследований», «Санитарными правилами по устройству, оборудованию и содержанию экспериментально-биологических клиник от 06.04.1993 и приказом Минздрава РФ № 267 от 19.06.2003 «Об утверждении правил лабораторной практики». Морфологические особенности адаптации внутренних органов беременных крыс к парентеральному введению ЗНЧ оценивали в печени, почках, селезенке и головном мозге животных. Экспериментальный материал фиксировали в 10 % нейтральном формалине, заливали в парафин и анализировали по стандартным процедурам гистологической техники. Для визуализации накопления ЗНЧ в клеточных и тканевых структурах применяли метод автометаллографии нитратом серебра [6] на парафиновых гистологических срезах.
Результаты исследования и их обсуждение
Применение метода автометаллографии позволило установить факт проницаемости ЗНЧ диаметром 5 нм для гематоэнцефалического барьера (ГЭБ) беременных животных. Золото определялось в цитоплазме нейроцитов головного мозга самок крыс (рис. 1). Полученные нами данные согласуются с результатами Hillyer J.F., R.M. Albrecht [7, 8], G. Sonavane et al. [11], количественно доказавших проницаемость гематоэнцефалического барьера для 4-нм частиц. На светооптическом уровне 30 нм ЗНЧ в ткани головного мозга нами обнаружены не были, что также соответствует результатам, полученными J.H. Kim et al. [9], установившими, что 20 нм является критическим размером ЗНЧ для их проникновения через ГЭБ.
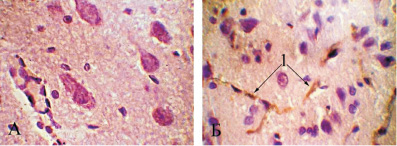
Рис. 1. Микрофото головного мозга беременной крысы:а – после внутривенного введения физиологического раствора; б – после внутривенного введения раствора наночастиц золота диаметром 5 нм; 1 – частицы золота в цитоплазме нейроцитов. Метод автометаллографии с серебром по Hacker G.W. с докрашиванием гематоксилином, ув. ×1000
Введение ЗНЧ диаметром 5 и 30 нм не оказывает видимого морфологическиго воздействия на структуры головного мозга животных – нейроциты и нейроглия головного мозга животных обеих групп не изменены. Сосуды головного мозга полнокровны, в части из них определяется эритростаз.
Введение раствора ЗНЧ диаметром 5 и 30 нм не вызывает также существенных отклонений в морфологии внутренних органов в сравнении с животными контрольной группы. Обращает на себя внимание тот факт, что ЗНЧ диаметром 5 и 30 нм вызывают однотипные морфофункциональные реакции исследуемых органов. В частности, у животных обеих опытных групп сохранена балочная структура печени, гепатоциты несколько набухшие, с незернистой цитоплазмой и четко контурирующимся центрально расположенным ядром. В незначительном числе сосудов эритростаз, синусоиды расширены. По всей площади среза частицы золота выявляются в печеночных макрофагах.
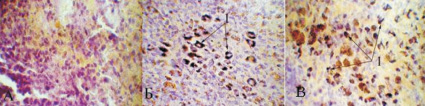
Рис. 2. Микрофото селезенки беременной крысы: a – после внутривенного введения физиологического раствора, б – после внутривенного введения раствора наночастиц золота диаметром 5 нм,в – после внутривенного введения раствора наночастиц золота диаметром 30 нм; 1 – скопления наночастиц золота в макрофагах. Метод автометаллографии с серебром по Hacker G.W. с докрашиванием гематоксилином, микрофото, ув. ×1000
Ткань селезенки животных после введения частиц золота диаметром 5 и 30 нм резко полнокровна. Белая пульпа животных, подвергшихся введению ЗНЧ диаметром 5 нм, состоит из лимфатических узелков с четкими границами, расположенными по периферии органа, часть фолликулов содержит герминативные центры, в лимфоидной ткани органа определяется множество созревающих фолликулов. Внутривенное введение ЗНЧ диаметром 30 нм обусловливает наличие лимфатических узелков с нечёткими краями, герминативные центры в них не определяются. Красная пульпа содержит большое число макрофагов, в цитоплазме которых выявляются наночастицы золота (рис. 2).
При введении ЗНЧ диаметром 5 и 30 нм в ткани почки наблюдаются расширенные капилляры почечных клубочков и переполнение их кровью, часть клубочков коллабирована, полости капсул нефронов практически не определяются. Большая часть извитых канальцев гипохромно окрашены, их просветы резко сужены. Во многих полях зрения сосуды коркового и мозгового вещества почки резко расширены, определяется эритростаз.
В соответствии с литературными данными к механизмам транспорта ЗНЧ через плазматическую мембрану клеток in vivo и in vitro относятся некоторые виды микроэндоцитоза, такие как клатрин-зависимый, кавеолин-зависимый и несколько видов рафт-зависимых [3]. Установление механизмов преодоления цитоструктур ГЭБ для ЗНЧ требует дополнительного изучения на экспериментальных моделях [10]. Результаты нашего исследования подтверждают имеющиеся многочисленные данные [4, 10, 12] о преимущественном накоплении ЗНЧ в клетках ретикуло-эндотелиальной системы. Основным местом накопления ЗНЧ является цитоплазма макрофагов селезенки и звездчатых макрофагов печени. Значительное присутствие наночастиц золота в селезенке и в печени, очевидно, обусловлено синусоидным типом гемокапилляров в указанных органах, а также присутствием значительного числа макрофагов, которые путём неспецифического фагоцитоза осуществляют захват и поглощение агрегатов наночастиц, циркулирующих в крови.
Выводы
Таким образом, введение суспензии ЗНЧ диаметром 5 и 30 нм не вызывает существенных отклонений в морфологии внутренних органов беременных крыс в сравнении с животными контрольной группы, обусловливая однотипные морфофункциональные реакции всех органов, сводящиеся, главным образом, к нарушению в их тканях микроциркуляции. Реактивные изменения органов проявляются в виде застойной гиперемии, эритростаза, тромбоза. Для всех экспериментальных животных характерно полнокровие тканей селезенки, расширенные синусоидные капилляры печени. Формирование устойчивых специфических морфологических реакций внутренних органов беременных крыс на введение ЗНЧ разного диаметра, вероятно, требует более длительного периода их воздействия на их ткани и органы.
Рецензенты:
Слесарев С.М., д.б.н., доцент, заведующий кафедрой биологии и биоэкологии ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск;
Музурова Л.В., д.м.н., профессор кафедры анатомии человека Саратовского государственного медицинского университета им. В.И. Разумовского Министерства здравоохранения и социального развития РФ, г. Саратов.
Работа поступила в редакцию 29.01.2013.



