Изучение структурных основ жизнедеятельности тканей полового аппарата является не только важным разделом современной морфологии и медицины, но и имеет большое значение в сохранении репродуктивного здоровья женщины. Мышечные ткани входят в состав стенок практически всех полых органов; общепризнана их определяющая роль в нормальном функционировании этих органов [1, 3, 4, 7]. Влагалище млекопитающих представляет собой утолщенную спереди и сзади трубку, анатомически и физиологически взаимосвязано с тазовым дном и наружными половыми органами. Уникальность его гистологического строения заключается в том, что его мышечная оболочка представлена двумя типами мышечных тканей, различных по происхождению, строению и механизму сокращения. Известно, что ни одна из современных классификаций тканей (Заварзин А.А., 1976; Клишов А.А., 1984; Данилов Р.К., 1986) однозначно не определяет место мышечных тканей влагалища в общей системе, и этот вопрос до сих пор дискутируется в научной литературе.
Цель настоящей работы - морфологический анализ тканевого состава мышечной оболочки стенки влагалища млекопитающих.
Материал и методы исследования
В работе использован материал от половозрелых самок млекопитающих (беспородные белые крысы - 60 особей, кошки 9 особей, собаки - 9 особей) в соответствии с «Правилами проведения работ с использованием экспериментальных животных». Исследовано также гистологическое строение влагалища женщин в возрасте 20-35 лет (10 случаев), погибших вследствие ДТП. Материал для исследования взят в патологоанатомическом отделении 5-й Муниципальной больницы г. Тольятти.
Для проведения светового исследования использовали фиксацию материала в 10 %-м нейтральном формалине на фосфатном буфере (рН 7,4), заливку в парафин. Для получения изолированных клеток использован метод щелочной диссоциации тканей по В.Я. Бродскому [2]. Определение гистохимического профиля поперечно-полосатой мышцы влагалища проводили с помощью реакции выявления сукцинатдегидрогеназы по стандартной методике Нахласа.
Для электронной микроскопии использовали префиксацию в 2,5 %-м глутаральдегиде на 0,2 М какодилатном буфере (рН 7,4), фиксацию в 1 % ОsО4 и заливали в аралдит. Для обеспечения прицельного электронно-микроскопического анализа получали серийные полутонкие срезы толщиной 1-2 мкм, которые окрашивали 1 %-м раствором метиленового синего. Прицельные ультратонкие срезы толщиной 200-500 нм просматривали в электронном микроскопе Hitachi-HU-12. (Авторы приносят благодарность члену-корреспонденту РАМН, профессору Банину В.В. за помощь в проведении электронно-микроскопического исследования).
Иммуногистохимическое исследование проводили с использованием системы визуализации Ultra Vision ONE c применением моноклональных антител РСNA, ki-67 фирмы Labvision (США).
Для морфометрического исследования использовали мазки изолированных гладких моцитов. Измерение линейных размеров лейомиоцитов и их ядер производили в двух взаимно перпендикулярых направлениях с помощью программы обработки и анализа изображений Image Tool версии 3.0. В соответствии с полученными цифровыми данными вычисляли объемы гладких миоцитов и их ядер (Хесин Я.Е.) [6]. Статистическое исследование данных проводили с использованием статистического пакета SPSS одноименной фирмы.
Проверка данных на соответствие нормальному распределению состояла из следующих процедур:
а) построение гистограмм с наложенной нормальной кривой и нормальных вероятностных графиков;
б) проверка на соответствие нормальному распределению одновыборочным тестом Колмогорова-Смирнова.
Для описания выборочной совокупности данных использовали средние значения со стандартной ошибкой среднего показателя или стандартным отклонением, для определения статистически значимых различий между значениями показателей в группах данных были использованы непараметрические критерии Манна-Уитни (для двух независимых групп) и Крускала-Уоллиса (для более, чем двух независимых групп).
Результаты исследования и их обсуждение
Использование методов классической гистологии позволило установить, что тканевой состав мышечной оболочки стенки влагалища исследованных животных неодинаков в его различных отделах. В дистальном отделе млекопитающих она представлена поперечно-полосатой мышечной тканью, которая наиболее выражена в мышечном аппарате влагалища собак. В средней трети влагалища мышечная оболочка образована гладкой и исчерченной мышечной тканями. В проксимальном отделе - мышечная оболочка представлена гладкой мышечной тканью, располагающейся в 2 слоя, из которых внутренний - циркулярный и наружный продольный. Ближе к шейке матки появляется третий слой гладких миоцитов, мышечная оболочка утолщена. Мышечные волокна и пучки гладкой мышечной ткани отделены друг от друга прослойками эндомизия. Эндомизий представлен рыхлой волокнистой соединительной тканью, межклеточное вещество представлено в основном аморфным компонентом. Среди волокнистых структур соединительной ткани преобладают коллагеновые волокна. Эластические волокна немногочисленны, имеют вид ветвящихся пучков. По отношению к длинной оси мышечных волокон они ориентированы по диагонали и перпендикулярно, связывая группы мышечных волокон друг с другом Ретикулярные волокна окружают отдельные компартменты мышечных волокон.
Поперечно-полосатая мышечная ткань дистального отдела влагалища при электронно-микроскопическом исследовании имеет классическое клеточно-симпластическое строение (рис. 1).
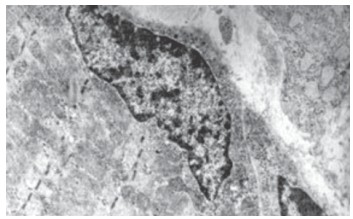
Рис. 1. Ультраструктура фрагмента миосимпласта исчерченной мышечной ткани влагалища крысы. Ув. 12000
Ядра миосимпластов располагаются на периферии, содержат центрально расположенные крупные 1-2 ядрышка, характеризуются умеренной электронной плотностью, содержат мелкодисперсный хроматин. Сарколемма представляет собой типичную мембрану и прилегает к саркоплазме. Базальная пластинка повторяет контуры сарколеммы. Она отличается меньшей электронной плотностью, содержит в своем составе аморфное вещество и фибриллярные компоненты. Саркоплазма заполнена миофибриллами, имеющими четкий саркомерный принцип организации. В пределах саркомера хорошо определяются А, I - диски, Z - линии, Н - зона; достаточно отчетливо контурируются М - линии. Отдельные миофибриллы отделены друг от друга участками саркоплазмы, в которой на уровне Z - линий располагаются митохондрии, округлой или овальной формы. Саркоплазматическая сеть в мышечных волокнах развита умеренно, канальцы расположены между миофибриллами. Скопления рибосом и гликогена, липидные включения (чаще округлой или овальной формы) определяются между миофибриллами и под сарколеммой. Миосателлитоциты отделены от миосимпласта собственной плазмалеммой, а со стороны межклеточного вещества покрыты базальной мембраной; имеют плотное, богатое гетерохроматином ядро.
При определении гистохимического профиля волокна поперечно-полосатой мышечной ткани у половозрелых крыс делятся на несколько типов: красные (39,2 %), белые (29,4 %) и волокна промежуточного типа (31,4 %), т.е. фенотип исчерченных мышечных волокон дистального отдела влагалища можно определить как смешанный (рис. 2).
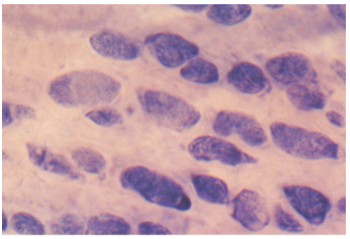
Рис. 2. Гистохимическая реакция на СДГ по Нахласу мышечных волокон влагалища половозрелой крысы. Об. 40, ок. 10
При электронно-микроскопическом исследовании гладкой мышечной ткани влагалища у половозрелых млекопитающих обнаруживаются различные фенотипы лейомиоцитов, что свидетельствует о полиморфизме клеточной популяции. Среди них можно выделить сократительные (светлые и темные, в зависимости от функционального состояния) и сократительно-синтетические миоциты. В светлых гладкомышечных клетках контрактильный аппарат расположен более рыхло, кортикальная зона свободна от миофиламентов. Для темных клеток характерна более упорядоченная организация сократительного аппарата (параллельная ориентация, плотное расположение и определенная локализация миофиламентов). Сократительно-синтетические лейомиоциты имеют в своей цитоплазме хорошо развитый синтетический аппарат - гранулярную эндоплазматическую сеть, аппарат Гольджи, многочисленные митохондрии, гранулы гликогена и секреторные включения. Пучки миофиламентов располагаются на периферии лейомиоцитов. В составе мышечного пласта разные фенотипы клеток располагаются без какой-либо упорядоченности.
По степени дифференцировки в дефинитивной гладкой мышечной ткани при ультраструктурном исследовании можно выделить малодифференцированные, дифференцирующиеся и дифференцированные лейомиоциты. Процесс специфической дифференцировки обусловлен органоспецифической детерминацией и сопровождается изменением ультраструктурной организации и становлением межклеточных контактов. У половозрелых млекопитающих встречаются клетки, имеющие ультраструктурные признаки малодифференцированных лейомиоцитов. Это клетки овальной формы с крупным ядром, в котором хроматин находится в активном состоянии. В цитоплазме содержатся рыхло расположенные миофиламенты, значительное количество рибосом и митохондрий.
Дифференцирующиеся лейомиоциты представляют собой отростчатые веретеновидной формы клетки. Ядра овальной формы, хроматин в них расположен пристеночно. Процесс специфической дифференцировки протекает в них достаточно активно: идет активный синтез миофиламентов, появляются плотные тельца, формируются прикрепительные полоски. Органеллы лейомиоцитов располагаются преимущественно у полюсов ядра. Митохондриальный аппарат в дифференцирующихся клетках хорошо развит: митохондрии округлой или овальной формы имеют светлый матрикс и малое количество крист. В некоторых лейомиоцитах митохондрии образуют скопления, как в перикарионе, так и на периферии клеток. Канальцы гранулярной эндоплазматической сети заполнены аморфным содержимым, что, вероятно, свидетельствует об активно протекающих в них синтетических процессах. Также в лейомиоцитах имеются участки скопления свободных рибосом и полисом, встречаются немногочисленные кортикальные везикулы и липидные включения.
Дифференцированные миоциты характеризуются более мощно развитым контрактильным аппаратом и кавеолярным комплексом. В центральной части клеток локализуются ядра овальной формы. Ядерная оболочка часто образует инвагинации. Уровень развития органелл зависит от функционального состояния клеток. Во многих миоцитах отмечаются скопления гликогена, гипертрофированная гранулярная эндоплазмтическая сеть, многочисленные рибосомы и полисомы. Наличие мышечных клеток разной степени дифференцировки в дефинитивной гладкой мышечной ткани характеризует популяцию лейомиоцитов как полиморфную.
Межклеточные контакты между лейомиоцитами представлены простыми мембранными контактами, в виде взаимных впячиваний, мостиков, нексусов. Нексусы являются обязательным типом межклеточных контактов между гладкими миоцитами и наиболее часто наблюдаются в области инвагинации плазмалемм лейомиоцитов. В сближенных боковых поверхностях лейомиоцитов обнаруживаются контакты, представленные параллельно ориентированными утолщенными мембранами. В этой зоне миофиламенты обычно отсутствуют, как правило, здесь концентрируются везикулы и элементы эндоплазматической сети.
При иммуногистохимическом исследовании с применением моноклональных антител к PCNA, ki-67 в гладкой мышечной ткани половозрелых крыс обнаруживаются единичные пролиферирующие гладкие мышечные клетки.
Проведенный морфологический анализ мазков изолированных клеток показал, что в пределах одной возрастной группы лейомиоциты различаются по размерам. Средний объем гладких миоцитов у половозрелой крысы составляет 3602,60 ± 275,22 мкм3, у кошки 901,44 ± 60,75 мкм3, у собаки 1718,28 ± 77,17 мкм3, у человека - 2658,61 ± 114,32 мкм3.
В мазках изолированных клеток гладкой мышечной ткани влагалища у лабораторных животных и человека определяются единичные фигуры митоза и двуядерные клетки.
Заключение
При комплексном морфологическом исследовании установлено, что мышечная оболочка влагалища представлена двумя типами мышечных тканей. В дистальном отделе расположена поперечно-полосатая мышечная ткань, в среднем поперечно-полосатая и гладкая мышечные ткани, в проксимальном отделе мышечная оболочка влагалища представлена гладкой мышечной тканью.
Поперечно-полосатая мышечная ткань стенки влагалища имеет типичное клеточно-симпластическое строение. Наличие миосателлитоцитов, как маркеров соматической мышечной ткани, доказывает миотомное происхождение исчерченной мышечной ткани влагалища [4, 7]. Однако ее можно рассматривать как разновидность соматической мускулатуры, которая приобрела специфические черты строения в связи с особенностями иннервации и функционирования. Поскольку во влагалище она не участвует в локомоторных функциях, ее следует отнести к группе мышц нелокомоторного (висцерального) аппарата [5, 8, 9, 11, 12]. Таким образом, в соответствии с Terminologia Histologica (2008 г.) исчерченную мышечную ткань влагалища (как и других внутренних органов - пищевода, сфинктеров прямой кишки, уретры) можно классифицировать как несердечную висцеральную исчерченную мышечную ткань [13].
Гладкая мышечная ткань влагалища представлена полиморфной популяцией, где в зависимости от степени дифференцировки можно различить малодифференцированные, дифференцирующиеся и дифференцированные клетки [3, 7, 8, 10]. Фенотипически в гладкой мышечной ткани влагалища различают сократительные и сократительно-синтетические лейомиоциты. Специализированных контактов между двумя типами мышечных тканей не обнаружено.
Реценценты:
Суворова Г.Н., д.м.н., профессор, зав. кафедрой анатомии человека, ГБОУ ВПО «Самарский государственный медицинский университет» Минздравсоцразвития РФ, г. Самара;
Колсанов А.В., д.м.н., профессор, зав. кафедрой ВПО «Самарский государственный медицинский университет» Минздравсоцразвития РФ, г. Самара.
Работа поступила в редакцию 21.12.2012.



