Лечение инфекционных заболеваний, вызываемых вирусами, остается трудно разрешимой проблемой практической терапии. Для молекулярного изучения протеома клеток, в том числе подвергшихся действию вирусной инфекции, активно используются протеомные и фосфопротеомные технологии, благодаря которым становится возможным оценить статус сигнального пути клетки и идентифицировать сигнальные белки, задействованные в ответе на любую вирусную инфекцию вне зависимости от таксономической принадлежности вируса. Такие белки являются наиболее перспективной клеточной мишенью для разработки средств антивирусной терапии, однако для проведения анализа методами протеомики и фосфопротеомики необходима отработка методик предобработки клеточных гомогенатов, применяемых для данного анализа [4, 3].
Как известно, N- и О-связанные олигосахариды являются основными структурными компонентами многих белков, при этом разнообразие олигосахаридных структур, а именно изменение структуры и разная степень насыщенности сайтов гликозилирования в гликопротеине, вносят свой вклад в неоднородность по массе, что обуславливает существенные трудности при анализе белков с использованием различных протеомных и фосфопротеомных методов. Поскольку О-связанные олигосахариды обычно меньше по массе, чем N-связанные гликаны, но при этом являются более многочисленными и более гетерогенными по структуре, подготовка биологического материала к протеомному и фосфопротеомному анализу должна включать дегликозилирование О-гликопротеинов.
Целью настоящей работы явилась разработка метода дегликозилирования гликопротеинов с последующим введением ковалентной метки и визуализацией паттерна первично негликозилированных и дегликозилированных белков в предобработанном клеточном гомогенате для проведения протеомного и фосфопротеомного анализа с использованием J-агрегатов.
Материалы и методы исследования
Приготовление лизата клеток, зараженных модельным штаммом вируса клещевого энцефалита ЭК-328 или вариантом М, полученным из штамма ЭК-328
Суспензию клеток почки эмбриона свиньи СПЭВ после заражения штаммом вируса клещевого энцефалита ЭК-328 или вариантом М штамма ЭК-328 и обработки тщательно перемешивали на ротаторе и отбирали аликвоты следующего объема:
При титре 1:512 – 0,25 мл.
При титре 1:256 – 0,5 мл.
При титре 1:128 – 1 мл.
К клеточным суспензиям в среде DMEM добавляли 100 мг стеклянных шариков диаметром 0,8 мм, 10 мкл на мл коктейля ингибиторов протеолиза «Halt Protease Inhibitor Cocktail» («Thermo Fisher Scientific Inc.», США) и подвергали интенсивной обработке на встряхивателе ВП1-2: 10 серий по 30 с для каждого препарата, поддерживая температуру препарата около 0 °С путем инкубации на ледяной бане. Затем к суспензиям добавляли детергент Triton X-100 до конечной концентрации 1 % и инкубировали на льду при периодическом встряхивании в течение 3 часов. Суспензии декантировали, осветляли посредством центрифугирования при 2000 g в течение 30 мин и замораживали в жидком азоте для дальнейшего использования.
Предобработка клеточных гомогенатов: проведение О-дегликозилирования гликопротеинов по механизму β-элиминирования с последующей ковалентной модификацией дегликозилированных белков цианиновым красителем JC-1
В качестве буферного раствора для клеточного гомогената использовали буферный раствор со слабощелочным pH 7,2 на основе 100 мМ Tris-HCl с добавлением 100 мМ NaCl. Образец объемом 400 мл предварительно концентрировали на ячейке для тангенциальной ультрафильтрации («Amicon», США). Первичный концентрат диализовали против буферного раствора Tris-HCl 100 мМ, NaCl 100 мМ в течение суток при + 4°С. Для дальнейшей работы использовали 3 фракции первого пика. К фракции первого пика вирусного материала объемом 0,5 мл добавляли 0,5 мл 0,1 М раствора NaOH и 38 мг NaBH4. Смесь тщательно перемешивали, нагревали 16 часов при + 45 °С, после этого к смеси добавляли 10 мкл∙10–4 М цианинового красителя JC-1, растворенного в бинарном растворе ацетон–Tris-HCl (С = 0,05 М, pH = 8,5), и инкубировали 15 мин при комнатной температуре. После завершения инкубации вирусный препарат подвергали окончательной очистке методом катионообменной хроматографии на Sepharose 6 Fast Flow при pH 7,2.
Анализ белков из первичного и предобработанного препаратов вирусного гомогената с помощью 2D-электрофореза
Для изучения белкового состава препаратов, полученных до и после проведения О-дегликозилирования гликопротеинов по механизму β-элиминирования с последующим мечением дегликозилированных белков цианиновым красителем JC-1, использовали 2D-электрофорез по О’Фареллу. Для визуализации белков пластины ПААГ окрашивали азотнокислым серебром с использованием набора «PageSilver™ Silver Staining Kit» в соответствии с инструкцией производителя («Thermo Fisher Scientific Inc.», США). Гель-документацию полученных двумерных электрофореграмм проводили методом сканирования на сканере «Epson expression 1680» или с помощью цифровой фотокамеры Panasonic Lumix DMC-GF2C.
Идентификация паттерна негликозилированных и дегликозилированных белков из очищенного предобработанного гомогената клеток, зараженных модельным штаммом вируса клещевого энцефалита ЭК-328 или вариантом М, полученным из штамма ЭК-328
Для однозначной идентификации паттерна изначально негликозилированных и дегликозилированных белков из предобработанного препарата вирусного гомогената после проведения электрофоретического анализа всех белков и окрашивания геля азотнокислым серебром проводили вторичное окрашивание модифицированных красителем дегликозилированных гликопротеинов. Для этого окрашенную азотнокислым серебром пластину ПААГ помещали в камеру для горизонтального электрофореза multiSUB MAXI («Cleaver Scientific Ltd», Великобритания), добавляли 1200 мл 10–5 М цианинового красителя JC-1 в бинарном растворе ацетон–Tris-HCl (С = 0,05 М, pH = 8,5), содержащем также предварительно растворенный ПАВ цетилпиридиний бромид в концентрации 10–3 М. После завершения инкубации раствор для окрашивания сливали, гель промывали охлажденным до +4 °С раствором PBS и документировали формирование молекулярных цепочек J-агрегатов на базе ковалентно-модифицированных красителем дегликозилированных гликопротеинов с помощью трансиллюминатора синего цвета со светофильтром янтарного цвета Safe ImagerTM 2.0 («Life Technologies», США) или UVIblue («Uvitec Cambridge», Великобритания) и цифровой фотокамеры Panasonic Lumix DMC-GF2C в темной комнате.
Результаты исследования и их обсуждение
На основе метода О-дегликозилирования гликопротеинов по механизму β-элиминирования [4, 3] был разработан и оптимизирован способ идентификации паттерна первично негликозилированных и дегликозилированных белков в предобработанном клеточном гомогенате посредством ковалентного связывания дегликозилированных гликопротеинов с цианиновым красителем JC-1 [1], электрофильное присоединение которого, как и в случае с DTT и BAP, происходит по двойной связи [4]. Структурная формула красителя JC-1, используемого в качестве ковалентной метки и базиса для образования J-агрегатов, а также постадийная схема проведения дегликозилирования белков с введением ковалентной модификации и визуализацией паттерна негликозилированных и дегликозилированных белков в предобработанном клеточном гомогенате с использованием J-агрегатов, приведены на рис. 1 и 2 соответственно.
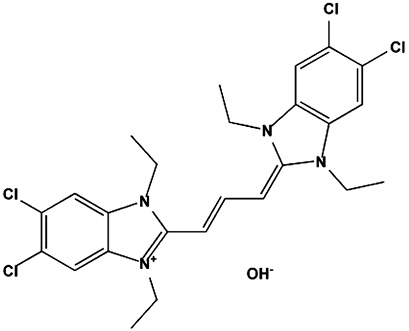
Рис. 1. Структурная формула красителя JC-1, используемого в качестве ковалентной метки и как базиса для образования J-агрегатов
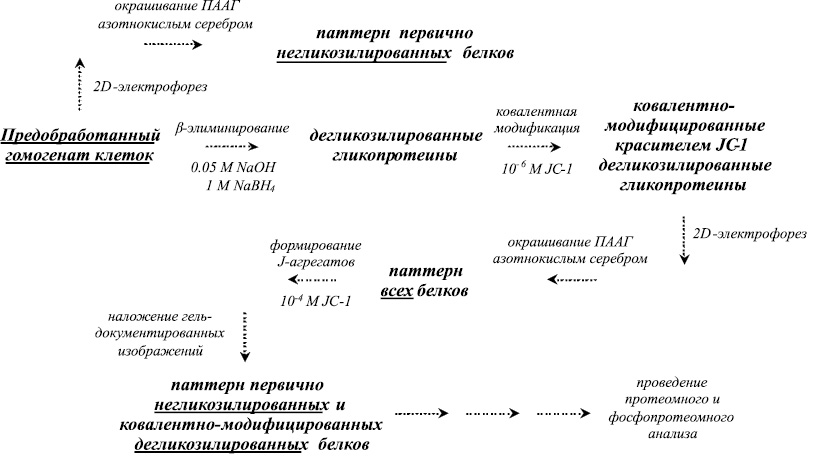
Рис. 2. Постадийная схема преобработки гомогенатов клеток, зараженных модельными штаммами вирусов посредством проведения дегликозилирования гликопротеинов с последующим введением ковалентной метки и визуализацией паттерна негликозилированных и дегликозилированных белков в предобработанном клеточном гомогенате с использованием J-агрегатов
До и после проведения дегликозилирования гликопротеинов по механизму β-элиминирования с ковалентной модификацией и мечением дегликозилированных белков цианиновым красителем JC-1 проводился 2D-электрофорез по О’Фареллу с последующей визуализацией паттерна изначально негликозилированных и модифицированных красителем дегликозилированных белков посредством окрашивания гелей азотнокислым серебром с использованием набора «PageSilver™ Silver Staining Kit» фирмы Thermo Fisher Scientific Inc., США. Далее осуществлялось наложение гель-документированных изображений, полученных после проведения электрофоретического анализа паттерна первично негликозилированных белков (рис. 3 (1,4)) и паттерна всех белков (рис. 3 (2,5)), что позволяло определить возможный паттерн изначально негликозилированных и ковалентно-модифицированных дегликозилированных белков без возможности подтверждения или опровержения артефактности проявившихся на пластине ПААГ полос, предположительно соответствующих именно дегликозилированным гликопротеинам.
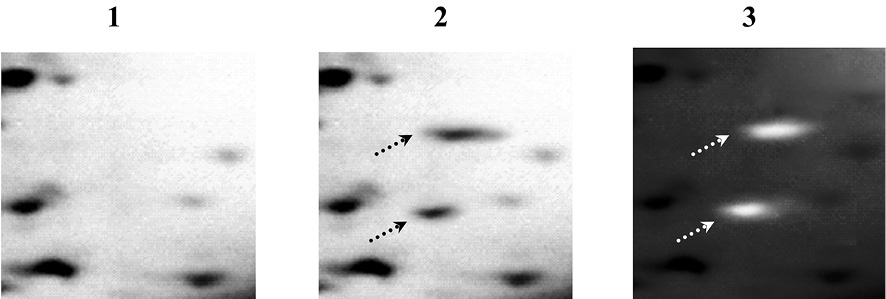
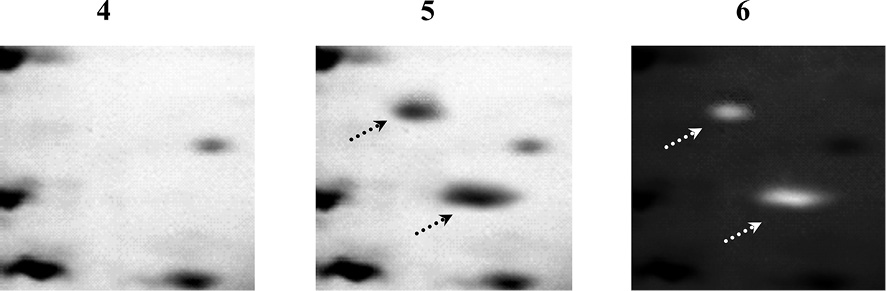
Рис. 3. Электрофоретический анализ паттерна негликозилированных и дегликозилированных белков в гомогенате клеток СПЭВ, зараженных модельным штаммом вируса клещевого энцефалита ЭК-328 (1–3) или вариантом М штамма ЭК-328 (4–6): до проведения дегликозилирования гликопротеинов (1,4), после дегликозилирования и ковалентной модификации гликопротеинов красителем JC-1 без обработки пластины ПААГ (2,5) и с обработкой раствором цианинового красителя JC-1 с образованием упорядоченных молекулярных цепочек J-агрегатов (3,6). Белки разделены методом 2D-электрофореза по О’Фареллу и окрашены на общий белок азотнокислым серебром с использованием набора «PageSilver™ Silver Staining Kit». Стрелками указаны полосы, соответствующие дегликозилированным гликопротеинам
После идентификации паттерна всех белков посредством оценки гель-документированных изображений двумерных электрофореграмм методом сканирования на сканере Epson expression 1680 или с помощью цифровой фотокамеры Panasonic Lumix DMC-GF2C с целью подтверждения проявления на пластине ПААГ полос, соответствующих именно дегликозилированным гликопротеинам, гель помещался в горизонтальную электрофорезную камеру и проводилось окрашивание первично меченых дегликозилированных белков посредством добавления цианинового красителя JC-1 в высокой концентрации с образованием упорядоченных молекулярных цепочек J-агрегатов. Ковалентная модификация дегликозилированных белков может быть осуществлена с использованием других цианиновых красителей, в том числе окса- и тиацианиновых красителей [2, 5], способных к образованию полимолекулярных J-агрегатов. В свою очередь повторная идентификация с использованием трансиллюминатора синего цвета со светофильтром янтарного цвета Safe ImagerTM 2.0 («Life Technologies», США) или UVIblue («Uvitec Cambridge», Великобритания) и цифровой фотокамеры Panasonic Lumix DMC-GF2C в темной комнате с последующим наложением гель-документированных изображений, полученных после проведения электрофоретического анализа паттерна первично негликозилированных белков (рис. 3 (1,4)) и паттерна всех белков (рис. 3 (2,5)) после окрашивания геля азотнокислым серебром, а также паттерна модифицированных красителем дегликозилированных гликопротеинов после вторичного окрашивания (рис. 3 (3,6)), которое приводит к образованию J-агрегатов, позволяет однозначно определить паттерн изначально негликозилированных и ковалентно-модифицированных дегликозилированных белков.
Заключение
Таким образом, в настоящей работе предложен удобный и простой способ определения паттерна изначально негликозилированных белков и ковалентно-модифицированных дегликозилированных белков с использованием J-агрегатов, что делает данный метод оптимальным для использования при подготовке биологического материала к протеомному и фосфопротеомному анализу. Настоящая работа выполнена при финансовой поддержке Министерства образования и науки РФ в рамках Федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007–2013 годы», Государственный контракт от 14 февраля 2011 г. № 16.512.11.2060.
Рецензенты:
Фаизов Т.Х., д.б.н., заведующий лабораторией молекулярно-генетического анализа ФГУ «Федеральный центр токсикологической и радиологической безопасности животных», г. Казань;
Морозов И.А., д.м.н., профессор, заместитель директора по научной работе Института полиомиелита и вирусных энцефалитов имени М.П. Чумакова Российской академии медицинских наук (ИПВЭ им. М.П. Чумакова РАМН), Московская обл., Ленинский р-н., поселок сельского типа Институт полиомиелита.
Работа поступила в редакцию 26.11.2012.



