Введение
Проблема реакционной способности молекулярного азота остается актуальной по ряду причин [30]. Он является основным компонентом земной атмосферы и участвует в биохимических процессах. В последние годы резко возрастает использование воздуха в высокотемпературных процессах: при сжигании топлив на тепловых станциях, в двигателях внутреннего сгорания, при крупных техногенных и природных пожарах, в ряде промышленных производств и т.д.
Долгое время проблема образования и стабилизации нитридов путем связывания азота воздуха решалась в направлении поиска катализаторов и сильных восстановителей для получения азотсодержащих соединений при комнатной температуре [5, 25]. Существенных результатов в этом направлении не было достигнуто: даже в восстановительной атмосфере выходы азотсодержащих соединений были крайне малы.
В ряде работ [24, 26] отмечалось, что в составе конденсированных продуктов сгорания твердых ракетных топлив обнаружен азот в следовых количествах, причем не уточнялось в виде каких соединений он фиксируется.
Отсутствие интереса к проблеме высокотемпературного связывания азота воздуха было также обусловлено устоявшейся точкой зрения, допускающей возможность образования нитридов в качестве лишь промежуточных веществ, но обязательно доокисляющихся до оксидов [2]. Действительно, элементарные расчеты и расчеты с использованием современных программ показывают, что нитриды не должны стабилизироваться в качестве конечных продуктов. Согласно сложившейся точке зрения, при получении нитридов даже небольшие примеси кислорода недопустимы [28].
Цель данной работы - экспериментальное и теоретическое обоснование ранее неизвестного явления химического связывания азота воздуха с образованием кристаллических фаз нитридов при горении порошкообразных металлов, бора и кремния.
Экспериментальные результаты
Впервые образование и стабилизация нитрида были обнаружены при сгорании ультрадисперсных порошков (нанопорошков) алюминия, полученных с помощью электрического взрыва алюминиевых проволочек в среде аргона, водорода, гелия [19-21]. Уже первые эксперименты показали, что в конечных продуктах горения содержалось до 40 % мас. нитрида алюминия в основном в виде кристаллической фазы. Позже, в 1998 г., вышла статья [31], в которой утверждалось, что в продуктах сгорания алюминия также обнаружен нитрид алюминия, но на рентгенограмме в статье рефлексы AlN отсутствовали. К этому времени нами были получены также нитриды бора, кремния, титана и циркония [7, 9, 17]. Кроме того, в качестве подтверждения возможности нитридообразования, была опубликована информация о получении нитрида лантана при горении металлического лантана в воздухе [32]. Процессы горения алюминия и других металлов были подробно изучены [12-13]. Установлено, что при сгорании состаренных и покрытых толстой оксидной оболочкой грубодисперсных порошков в конечных продуктах стабилизируются также соответствующие нитриды [8]. Проведены исследования влияния добавок различных нанопорошков на выход нитрида алюминия при сгорании нанопорошка алюминия [23]. Установлены зависимости выхода нитрида алюминия от массы сгораемого образца [14], от объема воздуха в закрытой камере [18], от давления воздуха в камере [33], от степени агломерированности и от природы пассивирующего функционального покрытия [16]. За счет подбора условий горения были достигнуты максимальные выходы нитридов (% мас.): AlN - 69; BN - 52; ZrN - 90; TiN - 88.
Кроме нитридов элементов III и IV групп Периодической системы недавно были получены нитриды хрома и, возможно, молибдена и вольфрама при сжигании их смесей с нанопорошком алюминия в воздухе [22, 29].
Сжигание в воздухе смесей оксидов (TiO2, ZrO2) с нанопорошком алюминия также приводит к связыванию азота воздуха с образованием стехиометрических по составу нитридов (TiN и ZrN) [10].
Относительно высокое содержание нитрида алюминия (~ 50 % мас.) было обнаружено также при сжигании штатного гидрида алюминия в воздухе [11].
В составе конденсированных продуктов сгорания модельного ракетного топлива на основе октогена обнаружен также нитрид алюминия [34].
Процессы горения нанопорошков и грубодисперсных порошков алюминия, титана и др., гидрида алюминия, смесей металлов и химических соединений с нанопорошком алюминия, с диоксидом титана и циркония в случае образования нитридов протекают в две стадии: сначала происходит выгорание абсорбированного водорода при 800 - 1200ºС (первая стадия), переходящее в высокотемпературное горение при 2000 - 2400ºС (вторая стадия). Синтез нитридов происходит именно при протекании второй - высокотемпературной - стадии. При этом определяющей выход нитридов является температура при горении: чем выше температура и, соответственно, светимость, тем больше выход нитридов. Такая закономерность получена при введении добавок (9 % мас.) в нанопорошок алюминия [23]: добавки нанопорошков (железа, молибдена, вольфрама), способствующие росту температуры, повышали выход нитрида алюминия максимально на 14 % мас. Необходимо отметить, что длительность первой стадии может изменяться от единиц секунд до нескольких минут, в то время как вторая стадия, как правило, протекает с высокой скоростью за 5 - 20 секунд (без учета времени остывания) [13]. При протекании второй стадии над горящим порошком наблюдается образование светящегося факела из газообразных продуктов горения [15].
Механизм связывания азота воздуха
Известно, что молекула азота имеет тройную химическую связь между атомами, энергия ее разрыва составляет 940 кДж/моль, что значительно превышает энергию разрыва связи в молекуле кислорода, водорода и других газов [4]. В то же время, тройная связь сильно поляризуется, и молекула азота становится реакционноспособной даже при комнатной температуре: одним из продуктов окисления металлического лития является нитрид Li3N [27]. Согласно расчетам и экспериментальным данным диссоциация молекул азота становится заметной лишь при 4000ºС [4], поэтому образование нитридов при горении, вероятно, протекает по другому механизму.
Наиболее подробно механизм связывания азота воздуха изучен для горения алюминия. Высокие скорость горения на второй стадии и температура позволили предположить, что на первой стадии процесс окисления алюминия протекает по диффузионному механизму:
2Al + 3/2O2 → Al2O3, ΔH0f = - 1667 кДж/моль, (1)
а затем переходит в газофазный процесс. При этом разрушение оксидной оболочки на алюминии выше 800ºС происходит с образованием летучих субоксидов:
4Alж + Al2O3г ![]() 3Al2Oг (2)
3Al2Oг (2)
В работах [19-21] было предложено на основании термодинамических расчетов, что образование нитрида алюминия протекает при взаимодействии летучего субоксида алюминия (I) с молекулой азота:
2Al2O + 2N2 →4AlN + O2, (3)
причем реакция образования нитрида алюминия даже при прямом взаимодействии алюминия с азотом при 2000 - 2400ºС является эндотермической, что способствует стабилизации нитрида алюминия.
Необходимым условием образования нитрида алюминия в виде самостоятельной фазы является протекание в определенном объеме и в определенном интервале времени только реакции образования нитрида алюминия. Это, в свою очередь, требует накопления исходных для этой реакции реагентов.
В диссертациях [1, 3, 29] и в монографиях [12, 13] приведены термограммы и дериватограммы, на которых видно, что в условиях высокотемпературного горения наблюдаются колебательные процессы: повышение и последующее понижение температуры реакционной смеси (ДТА). Объяснение этим процессам дано в работе [29]: показано, что образование нитрида алюминия, как эндотермический процесс, понижает температуру. Таких колебаний может быть несколько (рис. 1): чем активнее нанопорошок, тем больше колебаний. При этом возможно полное окисление металлического алюминия.
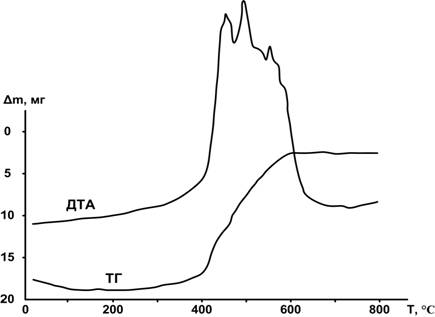
Рис. 1. Дериватограмма нанопорошка алюминия: m = 50 мг, скорость нагрева - 10 º/мин, атмосфера - воздух, тигель - платина.
При горении малоактивных нанопорошков и грубодисперсных порошков колебательные процессы не наблюдались. Тем не менее, оставался неясным процесс запуска реакции взаимодействия интермедиата Al2O с азотом.
Еще в ранних работах были обнаружены колебательные процессы при горении порошков алюминия в воздухе [24, 26]. Считалось, что гетерогенное горение может сопровождаться тепловыми флуктуациями,не связанными с нитридообразованием. Аналогичное объяснение дается при анализе колебательных и пульсационных процессов при горении твердых ракетных топлив и пиротехнических составов. Процессы при горении и других порошкообразных металлов: титана, циркония, хрома, неметаллов: бора и кремния [7] протекают также через образование субоксидов.
Междисциплинарный характер явления
Явление химического связывания азота воздуха с образованием кристаллических фаз нитридов при горении порошкообразных металлов, бора и кремния до наших работ не было известно и связано с протеканием высокотемпературных химических реакций с участием двух окислителей - кислорода и азота. Оно проявляется в процессах горения металлизированных и борсодержащих ракетных топлив и пиротехнических составов: переход горения в газовую фазу увеличивает скорость, а образование и стабилизация нитридов снижает энергетику топлив [34]. Таким образом, необходимо учитывать это влияние на характеристики составов: при окислении 1 моля алюминия до Al2O3 выделяется 837 кДж/моль, а до AlN - только 320 кДж/моль.
Ряд проблем геохимии горных пород может быть разрешен, если допустить, что на определенных этапах эволюции земной коры образовывались нитриды ряда металлов и неметаллов [7]. Дело в том, что в цепочках геохимических превращений имеются так называемые «белые пятна», существование которых можно объяснить участием нитридов.
Перспективным направлением в синтезе нитридсодержащих керамических материалов является синтез сжиганием порошкообразных металлов, бора и кремния, а также их смесей со сложными веществами в воздухе [29]. При этом не требуется сложного оборудования, чистого азота и высоких энергозатрат. Уникальные свойства нитридов могут использоваться при эксплуатации изделий в виде керамических и композиционных материалов.
Связывание азота воздуха сжиганием может быть положено также в основу производства аммиака: сжигание порошка алюминия - гидролиз продуктов сгорания - сушка продуктов гидролиза - электролиз - получение порошка - сжигание [3]. Предварительные расчеты показали, что такой цикл выгоднее в 3 - 4 раза в сравнении с синтезом аммиака по Габеру. При этом расходным компонентом в новой схеме является электроэнергия.
Связывание азота воздуха возможно в условиях техногенных и природных пожаров, особенно при сгорании нефти, угля, сланцев и торфа. Наличие угля и углеводородов как восстановителей при горении способствует образованию и стабилизации нитридов [23].
Заключение
Таким образом, проведенный в течение 20 лет цикл исследований, показал, что высокотемпературное (> 2000 °С) горение порошкообразных металлов: алюминия, титана, циркония, хрома и неметаллов: бора и кремния в воздухе сопровождается образованием и стабилизацией соответствующих нитридов в виде самостоятельных кристаллических фаз, причем их содержание в конечных продуктах при определенных условиях превышает 50 % мас. Согласно термодинамическим расчетам нитриды должны доокисляться кислородом воздуха: наблюдается кинетическое торможение термодинамически разрешенного химического процесса.
Полученные результаты позволяют сформулировать: «установлено ранее неизвестное явление химического связывания азота воздуха при высокотемпературном горении порошкообразных веществ элементов III, IV и VI групп Периодической системы с образованием и стабилизацией соответствующих фаз нитридов».
СПИСОК ЛИТЕРАТУРЫ:
- Ан В.В. Применение нанопорошков алюминия при получении нитрид-содержащих материалов. Дисс. на соиск. уч. степ. к.т.н. - Томск: ТПУ. - 1999. - 160 с.
- Боборыкин В.М., Гремячкин В.М., Истратов А.Г. // ФГВ. - 1983. - №3. - С.22.
- Громов А.А. Получение нитридсодержащих материалов при горении сверхтонких порошков алюминия и бора. Дисс. на соиск. уч. степ. к.т.н. - Томск: ТПУ. - 2000. - 197 с.
- Гурвич Л.В., Карачавцев Л.В., Кондратьев Л.В. и др. Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону. - М.: Наука. - 1974. - 351 с.
- Денисов Н.Т., Кобелева С.И., Шестаков А.Ф. // Кинетика и катализ. - 1996. - Т. 37. - № 4. - С. 528.
- Дитц А.А. Оксинитридные керамические материалы на основе продуктов сжигания промышленных порошков металлов в воздухе. Автореф. дисс. на соиск. уч. степ. к.т.н. Томск: ТПУ, 2006 г. - 22 с.
- Ильин А.П. // Геохимия. - 1993. - № 9. - С. 1371.
- Ильин А.П., Ан В.В., Верещагин В.И., Яблуновский Г.В. // Стекло и керамика. - 1998. - № 3. - С. 24.
- Ильин А.П., Ан В.В., Верещагин В.И., Яблуновский Г.В. // ФГВ. - 2000. - Т. 36. - № 2. - С. 56.
- Ильин А.П., Астанкова А.П., Амелькович Ю.А., Толбанова Л.О. Способ получения нитридов металлов. Заявка № 2007112044. Приор. от 02.04.2007.
- Ильин А.П., Бычин Н.В., Громов А.А. // ФГВ. - 2001. - Т. 37. - № 4. - С. 139.
- Ильин А.П., Громов А.А. Окисление сверхтонких порошков алюминия и бора. - Томск: ТПУ. - 1999. - 131 с.
- Ильин А.П., Громов А.А. Горение алюминия и бора в сверхтонком состоянии. - Томск: Изд-во Том. ун-та. - 2002. - 154 с.
- Ильин А.П., Громов А.А., Попенко Е.М. и др. // ФГВ. - 2001. - Т.37. - №6. - С.56.
- Ильин А.П., Громов А.А., Тихонов Д.В. и др. // ФГВ. - 2002. - Т.38. - №1. - С.139.
- Ильин А.П., Громов А.А., Фозе-Бат У., и др. // ФГВ. - 2006. - Т. 42. - № 2. - С. 1.
- Ильин А.П., Каратаева Е.А., Хабас Т.А., Верещагин В.И. Способ получения графитоподобного нитрида бора. А. с. СССР № 1805627, приор. 16.01.90.
- Ильин А.П., Попенко Е.М., Громов А.А. и др. // ФГВ. - 2002. - Т. 38. - №6. - С.1.
- Ильин А.П., Проскуровская Л.Т. Особенности окисления металлов в ультрадисперсном состоянии. ТПИ. Томск. Деп. в ОНИИ ТЭХИМ. - 1988. - № 905. - 22 с.
- Ильин А.П., Проскуровская Л.Т. // ФГВ. - 1990. - Т. 26. - № 2. - С. 71.
- Ильин А.П., Проскуровская Л.Т. // Порошковая металлургия. - 1990. - № 9. - С. 32.
- Ильин А. П., Толбанова Л.О. // ФГВ. - 2007. - T. 43. - № 4.
- Ильин А.П., Яблуновский Г.В., Громов А.А. // ФГВ. - 1996. - Т. 32. - №2. - С.108.
- Мальцев В.М., Мальцев М.М., Кашпоров Л.Я. Основные характеристики горения. - М.: Химия. - 1977. - 320 с.
- Николаева Г.В., Денисов Н.Т., Ефимов О.Н. и др. // Кинетика и катализ. - 1993. - Т. 34. - № 1. - С. 186.
- Похил П.Ф., Беляев А.Ф., Фролов Ю.В. и др. Горение порошкообразных металлов в активных средах. - М.: Наука. - 1972. - 298 с.
- Рипан Р., Четяну И. Неорганическая химия. - Т.1. - М.: Мир. - 1971. - 560 с.
- Самсонов Г.В. Нитриды. - Киев: Наукова думка. - 1969. - 371 с.
- Толбанова Л.О. Синтез керамических нитридсодержащих материалов сжиганием в воздухе смесей нанопорошка алюминия с нанопорошками W и Mo и порошком Cr. Дисс. на соиск. уч. степ. к.т.н. - Томск: ТПУ. - 2007. - 215с.
- Чатт Дж. Ричардс Л. Новое в химической фиксации азота. - М.: Мир. - 1983. - 304 с.
- Шевченко В.Г., Кононенко В.И., Булатов М.А. и др. // ФГВ. - 1998. - №1. - С.45.
- Шевченко В.Г., Кононенко В.И., Лукин И.В. и др. // ФГВ. - 1999. - № 1. - С. 85.
- Il´in A.P., Kwon Y.S., Gromov A.A., Popenko E.M. // Combustion and Flame. - 2003. - Vol. 133. - No. 4. - P. 349.
- Il´in A.P., Kwon Y.S., Gromov A.A., Popenko E.M. // Combustion Science and Technology. - 2004. - Vol. 176. - No. 2. - P. 277.



